1 . 为测定某有机化合物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是_______ 。
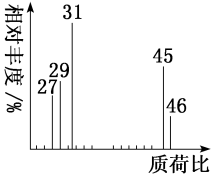
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为_______ ,该物质的分子式是_______ 。
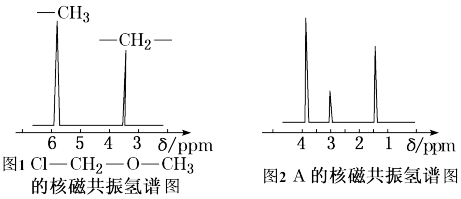
(3)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(Cl-CH2-O-CH3,有2种氢原子)的核磁共 振氢谱如左图所示,经测定,有机物A的核磁共振氢谱图如右图所示,则A的结构简式为_______ 。
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为

(3)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(Cl-CH2-O-CH3,有2种氢原子)的核磁共 振氢谱如左图所示,经测定,有机物A的核磁共振氢谱图如右图所示,则A的结构简式为

您最近一年使用:0次
2 . 一定温度下,在10L密闭容器中加入5molSO2和3molO2,发生反应:2SO2(g)+O2(g) 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
(1)反应生成了____ molSO3,v(SO2)=____ 。
(2)平衡时SO3的浓度是____ ,SO2的转化率是____ 。
(3)平衡时容器内气体的总物质的量为___ mol。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是___ (填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g) SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=___ 。
 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。(1)反应生成了
(2)平衡时SO3的浓度是
(3)平衡时容器内气体的总物质的量为
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g)
 SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=
您最近一年使用:0次
2022-04-11更新
|
532次组卷
|
2卷引用:贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题
解题方法
3 . (1)氟磷灰石在高温下制备黄磷的热化学方程式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
已知相同条件下:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
③SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
则ΔH=__ (用ΔH1、ΔH2、ΔH3表示)。
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=__ 。
已知相同条件下:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
③SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
则ΔH=
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
您最近一年使用:0次
12-13高三上·安徽滁州·阶段练习
名校
解题方法
4 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
752次组卷
|
22卷引用:2015-2016学年贵州省思南中学高二下学期期末化学卷
2015-2016学年贵州省思南中学高二下学期期末化学卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2017届江西省新余一中、宜春一中高三7月联考化学试题安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)安徽省六安中学2021届高三上学期开学考试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
5 . 填空
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石___ (填“>”或“<”)石墨。
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1____ (填“>”或“<”)ΔH2。
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:________ 。
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=____ 。
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=______ 。
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是________ 。
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
2020-12-15更新
|
320次组卷
|
6卷引用:贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题
贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷河北省安平中学2017-2018学年高一下学期期末考试化学试题1(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练
解题方法
6 . 某温度下,在一个体积为2L的固定不变的密闭容器中充入2molSO2和1molO2,发生2SO2(g)+O2(g) 2SO3(g)反应。5min后反应达到化学平衡状态,平衡时测得容器中混合气体为2.4mol。求:
2SO3(g)反应。5min后反应达到化学平衡状态,平衡时测得容器中混合气体为2.4mol。求:
(1)以SO3的浓度变化表示该反应的化学反应速率为________
(2)该反应中SO2的平衡转化率为________
(3)该反应的平衡常数K值为________
 2SO3(g)反应。5min后反应达到化学平衡状态,平衡时测得容器中混合气体为2.4mol。求:
2SO3(g)反应。5min后反应达到化学平衡状态,平衡时测得容器中混合气体为2.4mol。求:(1)以SO3的浓度变化表示该反应的化学反应速率为
(2)该反应中SO2的平衡转化率为
(3)该反应的平衡常数K值为
您最近一年使用:0次
2020-11-09更新
|
154次组卷
|
3卷引用:贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题
7 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:

途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g)ΔH3<0③
2H2(g)+O2(g)=2H2O(g)ΔH4<0④
则途径Ⅰ放出的热量___ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___ 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一CO(g)+2H2(g)⇌CH3OH(g)
方法二CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式:___ 。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
已知:
C(s)+O2(g)=CO2(g)ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g)ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___ 。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1则O3转化为O2的热化学方程式为___ 。
(1)把煤作为燃料可通过下列两种途径:

途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g)ΔH3<0③
2H2(g)+O2(g)=2H2O(g)ΔH4<0④
则途径Ⅰ放出的热量
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一CO(g)+2H2(g)⇌CH3OH(g)
方法二CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式:
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2
 TiCl4+2CO
TiCl4+2CO已知:
C(s)+O2(g)=CO2(g)ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g)ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1则O3转化为O2的热化学方程式为
您最近一年使用:0次
2020-11-06更新
|
293次组卷
|
2卷引用:贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题
名校
解题方法
8 . (1)已知:H2(g)+ Cl2(g) ═ 2HCl(g) △H=-184.6 kJ•mol-1则反应HCl(g) ═1/2 H2(g) +1/2 Cl2(g)的△H为_______ 。
(2)由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是_______ kJ/mol。
(3)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为_______ kJ/mol
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为_________________________________ 。
(2)由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
(3)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为
您最近一年使用:0次
2020-10-19更新
|
914次组卷
|
2卷引用:贵州省思南中学2017-2018学年高二上学期第一次月考化学试题
9 . 某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示。由图中数据分析:
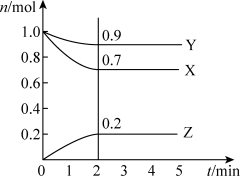
(1)该反应的化学方程式__________ ;
(2)反应开始至2 min末Z的反应速率为________ ,X的转化率为________ 。

(1)该反应的化学方程式
(2)反应开始至2 min末Z的反应速率为
您最近一年使用:0次
2020-10-16更新
|
195次组卷
|
2卷引用:贵州省毕节市实验高级中学2020-2021学年高二上学期第一次月考化学试题
名校
10 . 试回答下列各题:
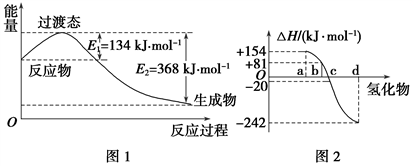
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______________________________ 。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
请填空:
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:__________ 。
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1

请填空:
| 共价键 | H—H | Cl—Cl | H—Cl |
| 键能/(kJ·mol-1) | 436 | 247 |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:
您最近一年使用:0次
2020-10-02更新
|
219次组卷
|
5卷引用:贵州省思南中学2020-2021学年高二上学期第一次月考化学试题
贵州省思南中学2020-2021学年高二上学期第一次月考化学试题2018-2019学年人教版高二化学选修四章:化学反应与能量末测试题重庆市南开中学2018-2019学年高二上学期第一次月考化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高一下学期期中考试化学试题



