名校
解题方法
1 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:


该反应一般认为通过如下步骤来实现:
反应①

反应②
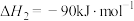
回答下列问题:
(1)
___________ 
(2)有利于提高 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有___________ (填编号)。
A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大 和
和 的初始投料比
的初始投料比
(3)二氧化碳加氢制甲醇的总反应按 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强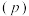 变化如图所示。
变化如图所示。
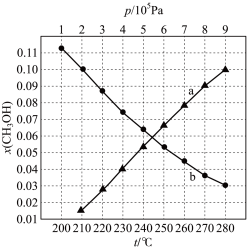
①图中对应在 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是___________ (填“ ”或“
”或“ ”)。判断理由是
”)。判断理由是___________ 。
② 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
③ 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程___________ 。


该反应一般认为通过如下步骤来实现:
反应①


反应②

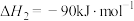
回答下列问题:
(1)


(2)有利于提高
 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大
 和
和 的初始投料比
的初始投料比(3)二氧化碳加氢制甲醇的总反应按
 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强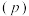 变化如图所示。
变化如图所示。
①图中对应在
 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是 ”或“
”或“ ”)。判断理由是
”)。判断理由是②
 时,反应条件可能为
时,反应条件可能为③
 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程
您最近一年使用:0次
名校
2 . 反应: ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时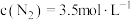 ,
,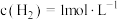 ,
,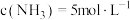 ,求:
,求:
(1) 和
和 的起始浓度
的起始浓度_________ 。
(2) 的转化率
的转化率_________ 。
(3)平衡时压强为开始时压强的百分之几_________ 。
(4)平衡时 占总体积的体积分数
占总体积的体积分数_________ 。
 ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时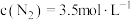 ,
,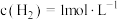 ,
,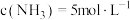 ,求:
,求:(1)
 和
和 的起始浓度
的起始浓度(2)
 的转化率
的转化率(3)平衡时压强为开始时压强的百分之几
(4)平衡时
 占总体积的体积分数
占总体积的体积分数
您最近一年使用:0次
名校
3 . 已知几种含碳物质间的转化及能量变化关系如图所示。
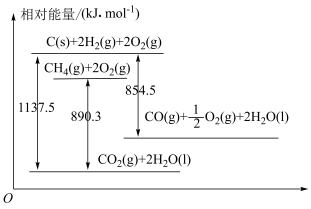
(1)写出表示CO燃烧热的热化学方程式:___________ 。
(2)反应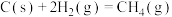

___________  ,该反应中反应物的总键能
,该反应中反应物的总键能___________ (填“大于”、“小于”或“等于”)生成物的总键能。若18gC(s)与 反应,完全转化成
反应,完全转化成 ,需要
,需要___________ (填“吸收”或“放出”)___________ kJ能量。
(3)在25℃、101kPa下,30g由 和CO组成的混合气体完全燃烧生成
和CO组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ。则混合气体中
和液态水,放出热量1031.8kJ。则混合气体中 和CO的物质的量分别为
和CO的物质的量分别为___________ mol、___________ mol。

(1)写出表示CO燃烧热的热化学方程式:
(2)反应
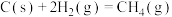

 ,该反应中反应物的总键能
,该反应中反应物的总键能 反应,完全转化成
反应,完全转化成 ,需要
,需要(3)在25℃、101kPa下,30g由
 和CO组成的混合气体完全燃烧生成
和CO组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ。则混合气体中
和液态水,放出热量1031.8kJ。则混合气体中 和CO的物质的量分别为
和CO的物质的量分别为
您最近一年使用:0次
2023-11-21更新
|
142次组卷
|
2卷引用:广东省深圳市第三高级中学2023-2024学年高二上学期期中考试化学试题
名校
4 .  与
与 在高温下发生反应:
在高温下发生反应: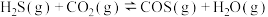
 。在
。在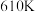 时,将
时,将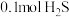 与
与 充入
充入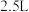 的空钢瓶中,经过
的空钢瓶中,经过 ,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
(1)求 的平衡转化率
的平衡转化率_______ 。
(2)求该温度下的反应平衡常数_______ 。
 与
与 在高温下发生反应:
在高温下发生反应: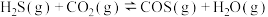
 。在
。在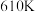 时,将
时,将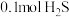 与
与 充入
充入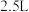 的空钢瓶中,经过
的空钢瓶中,经过 ,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。(1)求
 的平衡转化率
的平衡转化率(2)求该温度下的反应平衡常数
您最近一年使用:0次
名校
解题方法
5 . 在空气中灼烧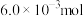 的
的 ,完全转化为
,完全转化为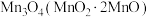 ,将其溶解于
,将其溶解于 溶有
溶有 的稀
的稀 溶液中,锰被还原为+2价。过量的
溶液中,锰被还原为+2价。过量的 需要
需要 的
的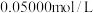 的
的 滴定,计算实验加入的
滴定,计算实验加入的 的质量(注:
的质量(注: 的相对分子质量为392)
的相对分子质量为392) _______ 。
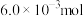 的
的 ,完全转化为
,完全转化为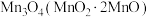 ,将其溶解于
,将其溶解于 溶有
溶有 的稀
的稀 溶液中,锰被还原为+2价。过量的
溶液中,锰被还原为+2价。过量的 需要
需要 的
的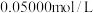 的
的 滴定,计算实验加入的
滴定,计算实验加入的 的质量(注:
的质量(注: 的相对分子质量为392)
的相对分子质量为392)
您最近一年使用:0次
名校
6 . 氢叠氮酸( )和莫尔盐
)和莫尔盐 是两种常用原料。
是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为
①氢叠氮酸在水溶液中的电离方程式为___________ 。
②0.1mol/L的 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为___________ 。
③已知T℃时,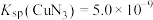 ,
, ,在此温度下,
,在此温度下,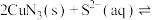
 ,该反应正反应方向
,该反应正反应方向___________ (填“能”或“不能”)基本进行彻底,请通过计算说明___________ 。
(2)在 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
滴定终点的现象是___________ ,通过实验数据,计算该产品的纯度为___________ (用含字母a、c的式子表示)。上表中第一次实验的记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视读数,滴定结束后俯视读数
 )和莫尔盐
)和莫尔盐 是两种常用原料。
是两种常用原料。(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为

①氢叠氮酸在水溶液中的电离方程式为
②0.1mol/L的
 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为③已知T℃时,
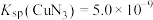 ,
, ,在此温度下,
,在此温度下,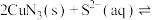
 ,该反应正反应方向
,该反应正反应方向(2)在
 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视读数,滴定结束后俯视读数
您最近一年使用:0次
7 . 在密闭容器中,通入a mol N2和b mol H2,若在一定条件下反应达到平衡时,容器中剩余c mol N2。
(1)达到平衡时,生成NH3的物质的量为_______
(2)若把容器的容积减小到原来的一半,则正反应速率_______ (填“增大”“减小”或“不变”,下同),逆反应速率_______ ,N2的转化率_______ 。
(1)达到平衡时,生成NH3的物质的量为
(2)若把容器的容积减小到原来的一半,则正反应速率
您最近一年使用:0次
名校
8 . 完成下列问题
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为_______ 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=_______ ,若温度不变,0.005 mol·L-1的H2SO4溶液中,由水电离出的c(H+)=_______ 。
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=_______ ;此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为_______ 。
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO )约为
)约为_______ 。
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO
 )约为
)约为
您最近一年使用:0次
2023-03-04更新
|
600次组卷
|
2卷引用:广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
9 . 回答下列问题
(1)在25℃,101kpa下,1g甲醇( )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸气反应的热化学方程式:___________ 。
(3)已知:
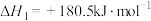

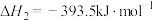
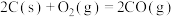
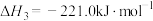
若某反应的平衡常数表达式为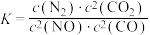 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
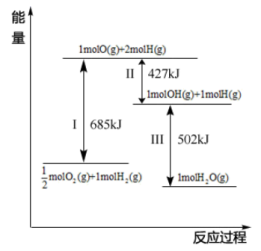
(4)根据图示信息写出热化学方程式:___________ 。
(5)已知:C(s)、CO(g)和 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为

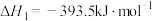


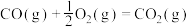
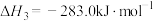
请你根据以上数据,写出C(s)与水蒸气反应生成CO和 的热化学方程式:
的热化学方程式:___________ 。
(1)在25℃,101kpa下,1g甲醇(
 )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)已知几种化学键的键能数据如表所示:
| 化学键 | N—H |  | Br—Br | H—Br |
键能/ | 391 | 946 | 194 | 366 |
(3)已知:

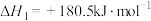

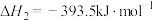
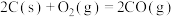
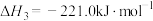
若某反应的平衡常数表达式为
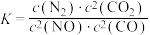 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)根据图示信息写出热化学方程式:

(5)已知:C(s)、CO(g)和
 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为
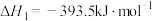


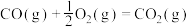
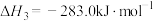
请你根据以上数据,写出C(s)与水蒸气反应生成CO和
 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解题方法
10 . 回答下列问题。(lg2=0.3、lg5=0.7)
(1)25℃时,0.01mol/L的NaOH溶液的pH=_____ ;由水电离出的c(H+)=_____ mol/L。
(2)25℃时,pH=2的盐酸与pH=5的盐酸等体积混合后溶液的pH=_____ 。
(3)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH_____ 4(填“大于”“小于”或“等于”)。
(4)某温度下纯水中c(H+)=4×10-7mol/L,则此时溶液中的c(OH-)=_____ mol/L。
(5)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=_____ mol/L。
(1)25℃时,0.01mol/L的NaOH溶液的pH=
(2)25℃时,pH=2的盐酸与pH=5的盐酸等体积混合后溶液的pH=
(3)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH
(4)某温度下纯水中c(H+)=4×10-7mol/L,则此时溶液中的c(OH-)=
(5)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=
您最近一年使用:0次



