名校
1 . 按要求填空。
(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为___________ ,微粒之间的作用力为___________ 。
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 (如图1)的结构相似,该晶体储氢后的化学式应为
(如图1)的结构相似,该晶体储氢后的化学式应为___________ 。
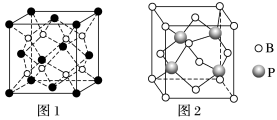
(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为___________ 。
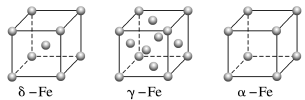
(4)铁有δ、γ、α三种同素异形体,δ−Fe晶胞参数为acm,则铁原子半径为___________ (假设原子为刚性球体);δ、α两种晶胞中铁原子的配位数之比为___________ 。
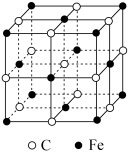
(5)奥氏体是碳溶解在γ−Fe中形成的一种间隙固溶体,无磁性,其晶胞如图所示,若晶体密度为ρg∙cm−3,则晶胞中最近的两个碳原子的距离为___________ pm(阿伏加德罗常数的值用 表示,写出计算式即可)。
表示,写出计算式即可)。
(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与
 (如图1)的结构相似,该晶体储氢后的化学式应为
(如图1)的结构相似,该晶体储氢后的化学式应为
(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为
(4)铁有δ、γ、α三种同素异形体,δ−Fe晶胞参数为acm,则铁原子半径为

(5)奥氏体是碳溶解在γ−Fe中形成的一种间隙固溶体,无磁性,其晶胞如图所示,若晶体密度为ρg∙cm−3,则晶胞中最近的两个碳原子的距离为
 表示,写出计算式即可)。
表示,写出计算式即可)。
您最近一年使用:0次
2023-04-18更新
|
333次组卷
|
2卷引用:河北省张家口市宣化第一中学2022-2023学年高二下学期6月月考化学试题
名校
解题方法
2 . 完成下列问题
(1)某温度(t℃)时,水的Kw=1×10-12,则该温度_______ (填“>”“<”或“=”)25℃
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈_______ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=_______ mol·L-1。
(3)25℃时,0.05mol·L-1H2SO4溶液的pH=_______ ,0.01 mol·L-1NaOH溶液的pH=_______ 。
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是_______ (填序号)。
①HCl ②CH3COOH(Ka=1.7×10-5) ③NH3·H2O(Kb=1.7×10-5) ④Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度_______ pH=10的Ba(OH)2溶液中水的电离程度。(填大于、小于或等于)
(1)某温度(t℃)时,水的Kw=1×10-12,则该温度
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈
(3)25℃时,0.05mol·L-1H2SO4溶液的pH=
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是
①HCl ②CH3COOH(Ka=1.7×10-5) ③NH3·H2O(Kb=1.7×10-5) ④Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度
您最近一年使用:0次
名校
解题方法
3 . 利用“萨巴蒂尔反应”[
 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。
已知:
试回答下列问题:
(1)①表示CO(g)燃烧热的热化学方程式:_______ 。
②C(s)燃烧仅生成CO(g)的热化学方程式:_______ ,当有6gC(s)完全燃烧时,放出_______ kJ热量。
(2)①若2mol由CO(g)、 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是_______ 。
②等质量的CO(g)、 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为_______ (用化学式表示)。
(3)每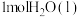 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

_______  。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为_______ (填含a的代数式) 。
。

 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。已知:
| 物质 | CO(g) |  |  | C(s) |
燃烧热/( ) ) | 283 | 285.8 | 890.3 | 393 |
(1)①表示CO(g)燃烧热的热化学方程式:
②C(s)燃烧仅生成CO(g)的热化学方程式:
(2)①若2mol由CO(g)、
 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是②等质量的CO(g)、
 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为(3)每
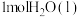 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

 。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为 。
。
您最近一年使用:0次
2022-11-08更新
|
445次组卷
|
3卷引用:河北省邢台市南和区第一中学2022-2023学年高二上学期期中考试化学试题
名校
4 . CO、 、
、 是工业上重要的化工原料。
是工业上重要的化工原料。
已知:①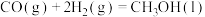
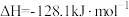
②
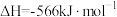
③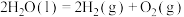
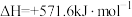
请回答下列问题:
(1)上述反应中属于放热反应的是_______ (填标号)。
(2)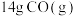 完全燃烧放出的热量为
完全燃烧放出的热量为_______ 。
(3)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
(4)1.5mol由CO和 组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、
组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、 的物质的量分别为
的物质的量分别为_______ mol、_______ mol。
(5)等质量的 、
、 、
、 完全燃烧,放热最多的是
完全燃烧,放热最多的是_______ (填化学式)。
(6)某些常见化学键的键能数据如下表:
则

_______  。
。
 、
、 是工业上重要的化工原料。
是工业上重要的化工原料。已知:①
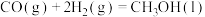
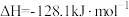
②

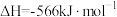
③
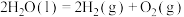
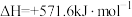
请回答下列问题:
(1)上述反应中属于放热反应的是
(2)
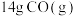 完全燃烧放出的热量为
完全燃烧放出的热量为(3)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(4)1.5mol由CO和
 组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、
组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、 的物质的量分别为
的物质的量分别为(5)等质量的
 、
、 、
、 完全燃烧,放热最多的是
完全燃烧,放热最多的是(6)某些常见化学键的键能数据如下表:
| 化学键 | C=O | H—O | H—H |  |
键能 | 803 | 463 | 436 | 1076 |


 。
。
您最近一年使用:0次
2022-11-07更新
|
346次组卷
|
6卷引用:河北省邢台市2022-2023学年高二上学期第一次月考化学试题
名校
5 . 下列物质中:①CH3COOH②NH3③NH4Cl④盐酸⑤NaOH⑥NaHCO3溶液。
(1)属于弱电解质的是____ (填序号,下同),属于强电解质且其水溶液呈碱性的是____ 。
(2)在氨水中存在电离平衡:NH3•H2O NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是____ (填序号),此时c(OH-)____ (填“增大”“减小”或“不变”,下同), =
=____ 。
(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是____ (填化学式),反应过程中醋酸的电离程度____ (填“增大”“减小”或“不变”,下同),n(CH3COO-)____ ,水的电离程度逐渐____ ,水电离的c(H+)=____ 。
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=____ mol•L-1。
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为____ 。
(1)属于弱电解质的是
(2)在氨水中存在电离平衡:NH3•H2O
 NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是 =
=(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为
您最近一年使用:0次
2022-11-02更新
|
564次组卷
|
3卷引用:河北省邯郸市九校联盟2022-2023学年高二上学期10月期中考试化学试题
解题方法
6 . 在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如表所示:
pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如表所示:
已知2 min内v(Q)=0.075 mol•L-1•min-1,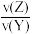 =
= 。
。
(1)试确定以下物质的相关量:起始时n(Y)=_____ ,n(Q)=____ 。
(2)化学方程式中m=_____ ,n=____ ,p=____ ,q=____ 。
(3)用Z表示2 min内的反应速率:_____ 。
(4)2 min末Q的转化率为_____ 。
 pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如表所示:
pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如表所示:| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | 0.8 |
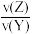 =
= 。
。(1)试确定以下物质的相关量:起始时n(Y)=
(2)化学方程式中m=
(3)用Z表示2 min内的反应速率:
(4)2 min末Q的转化率为
您最近一年使用:0次
2022-09-30更新
|
458次组卷
|
3卷引用:河北省邯郸市魏县第五中学2022-2023学年高二上学期11月期中化学试题
7 . 已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g),平衡常数为K。
CO2(g)+H2(g),平衡常数为K。
(1)557℃时,若起始浓度:CO为1mol·L-1,H2O为1.5mol·L-1,平衡时CO转化率为60%,则H2O的转化率为___________ ;K值为___________ 。
(2)557℃时,若起始浓度改为:CO为1mol·L-1,H2O为3mol·L-1,平衡时H2O的转化率为___________ 。
 CO2(g)+H2(g),平衡常数为K。
CO2(g)+H2(g),平衡常数为K。(1)557℃时,若起始浓度:CO为1mol·L-1,H2O为1.5mol·L-1,平衡时CO转化率为60%,则H2O的转化率为
(2)557℃时,若起始浓度改为:CO为1mol·L-1,H2O为3mol·L-1,平衡时H2O的转化率为
您最近一年使用:0次
2022-08-27更新
|
625次组卷
|
5卷引用:河北省邯郸市魏县2022-2023学年高二上学期期末考试化学试题
河北省邯郸市魏县2022-2023学年高二上学期期末考试化学试题福建省莆田第十五中学2019-2020学年高二上学期期末考试化学试题(已下线)2.2.2 化学平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2.2.1 化学平衡常数-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第09讲 化学平衡常数(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
8 . (1)等质量的两份铝分别和足量的盐酸、氢氧化钠溶液反应,所得H2的体积比为___________ ;
(2)足量的两份铝分别和等体积、等物质的量浓度的盐酸和氢氧化钠溶液反应,产生H2的体积比为___________ ;
(3)甲、乙两个烧杯,各盛有100mL、3mol/L的盐酸和氢氧化钠溶液,向两烧杯分别加入等质量的铝粉,反应后,测得甲、乙两烧杯中产生气体体积比为1:2,则加入铝粉的质量为____ g;
(4)现有100mL、2mol/L的NaOH溶液,欲制Na2CO3,若直接通入CO2,则不容易掌握CO2的用量。因为CO2通得过少,则会有NaOH剩余;若通入过量CO2,则又会有___________ 产生。于是小强同学设计了下列方案:(请补充完整后面步骤)
①先将100mL NaOH溶液分为两等份;
②_______
③_______
则可得到Na2CO3溶液。
(2)足量的两份铝分别和等体积、等物质的量浓度的盐酸和氢氧化钠溶液反应,产生H2的体积比为
(3)甲、乙两个烧杯,各盛有100mL、3mol/L的盐酸和氢氧化钠溶液,向两烧杯分别加入等质量的铝粉,反应后,测得甲、乙两烧杯中产生气体体积比为1:2,则加入铝粉的质量为
(4)现有100mL、2mol/L的NaOH溶液,欲制Na2CO3,若直接通入CO2,则不容易掌握CO2的用量。因为CO2通得过少,则会有NaOH剩余;若通入过量CO2,则又会有
①先将100mL NaOH溶液分为两等份;
②
③
则可得到Na2CO3溶液。
您最近一年使用:0次
9 . 回答下列问题:
(1)在无土栽培中,需配制500mL含有NH 、K+、Cl-、SO
、K+、Cl-、SO 的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol•L-1。该培养液中,c(NH
)=0.4mol•L-1。该培养液中,c(NH )=
)=___ mol•L-1。若用K2SO4、NH4Cl、(NH4)2SO4配制培养液,则需____ g(NH4)2SO4。
(2)已知质量分数为98%的浓硫酸,其物质的量浓度为18.4mol•L-1,则该浓硫酸的密度___ g•cm-3。若某硫酸的质量分数为49%,则其物质的量浓度___ (填“大于”“小于”或“等于”,下同)9.2mol•L-1;若某硫酸的物质的量浓度为9.2mol•L-1,则其质量分数___ 49%。
(3)由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2和H2的体积比为___ 。
(4)在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为___ 。若将该产物用200mL2mol•L-1NaOH溶液充分吸收,则所得溶液中c(CO )=
)=___ mol•L-1 (不考虑溶液体积的变化)。
(1)在无土栽培中,需配制500mL含有NH
 、K+、Cl-、SO
、K+、Cl-、SO 的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol•L-1。该培养液中,c(NH
)=0.4mol•L-1。该培养液中,c(NH )=
)=(2)已知质量分数为98%的浓硫酸,其物质的量浓度为18.4mol•L-1,则该浓硫酸的密度
(3)由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2和H2的体积比为
(4)在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为
 )=
)=
您最近一年使用:0次
名校
解题方法
10 . 研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是____________ 。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为___ mol,放出的热量为_______ kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=__________ 。
(4)已知:N2、O2分子中化学键的键能分别是946kJ·mol−1、497kJ·mol−1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol−1。NO分子中化学键的键能为______ 。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=
(4)已知:N2、O2分子中化学键的键能分别是946kJ·mol−1、497kJ·mol−1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol−1。NO分子中化学键的键能为
您最近一年使用:0次
2021-06-24更新
|
357次组卷
|
2卷引用:河北省顺平县中学2021-2022学年高二上学期第一次月考化学试题



