1 . 0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答:
(1)烃A的分子式为______ 。
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有____ g烃A参加了反应,燃烧时消耗标准状况下的氧气____ L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其氯代物只有一种,则烃A的结构简式为_______ 。
(4)若烃A能使溴水褪色,且在催化剂作用下,与 加成所得产物的分子中含4个甲基,烃A可能的结构简式为
加成所得产物的分子中含4个甲基,烃A可能的结构简式为_______ ,比烃A少2个碳原子的同系物,且能和 发生加成反应生成2-甲基丙烷的是
发生加成反应生成2-甲基丙烷的是_______ (填结构简式),它与溴的四氯化碳溶液反应的化学方程式为_______ 。
(1)烃A的分子式为
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其氯代物只有一种,则烃A的结构简式为
(4)若烃A能使溴水褪色,且在催化剂作用下,与
 加成所得产物的分子中含4个甲基,烃A可能的结构简式为
加成所得产物的分子中含4个甲基,烃A可能的结构简式为 发生加成反应生成2-甲基丙烷的是
发生加成反应生成2-甲基丙烷的是
您最近一年使用:0次
2 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
(2)常温下,将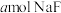 溶于水向该溶液中滴加
溶于水向该溶液中滴加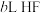 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向 溶液中通入少量
溶液中通入少量 气体:
气体: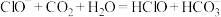
③向 溶液中通入过量
溶液中通入过量 气体:
气体: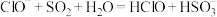
④向 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是_______ (填标号)。
A.室温下,分别取等浓度 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸
B.室温下,浓度为 c1的 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>a
C.室温下,取pH=a(a<3)的 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2
D.标准状况下,取0.10mol/L的 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL
②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为_______ 。当pH为3时,溶液中
_______ 。
 | HF |  |  |  | |
 | 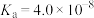 | 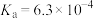 |   | 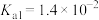  |  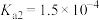 |
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液(2)常温下,将
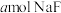 溶于水向该溶液中滴加
溶于水向该溶液中滴加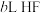 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为 。
。(3)下列离子方程式错误的是
①向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: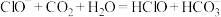
③向
 溶液中通入过量
溶液中通入过量 气体:
气体: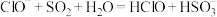
④向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是
A.室温下,分别取等浓度
 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸B.室温下,浓度为 c1的
 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>aC.室温下,取pH=a(a<3)的
 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2D.标准状况下,取0.10mol/L的
 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为

您最近一年使用:0次
名校
3 . 回答下列问题:
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。
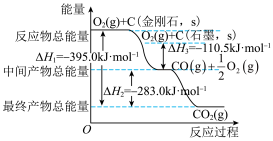
(1)在通常状况下,金刚石和石墨中___________ (填“金刚石”或“石墨”更稳定,石墨的标准燃烧热 为
为___________ 。
(2) 石墨在一定量空气中燃烧,生成气体
石墨在一定量空气中燃烧,生成气体 ,该过程放出的热量为
,该过程放出的热量为___________ 。
(3)已知: 、
、 分子中化学键的键能分别是
分子中化学键的键能分别是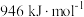 、
、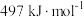 。
。
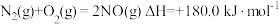
 分子中化学键的键能为
分子中化学键的键能为___________  。
。
(4)综合上述有关信息,请写出 与
与 反应的热化学方程式:
反应的热化学方程式:___________ 。
(5)根据盖斯定律计算
已知下列反应在 时的反应焓变:
时的反应焓变:
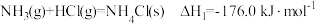
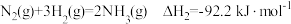
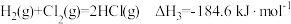
计算反应 在
在 时的焓变
时的焓变___________ 。
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。

(1)在通常状况下,金刚石和石墨中
 为
为(2)
 石墨在一定量空气中燃烧,生成气体
石墨在一定量空气中燃烧,生成气体 ,该过程放出的热量为
,该过程放出的热量为(3)已知:
 、
、 分子中化学键的键能分别是
分子中化学键的键能分别是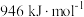 、
、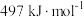 。
。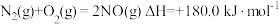
 分子中化学键的键能为
分子中化学键的键能为 。
。(4)综合上述有关信息,请写出
 与
与 反应的热化学方程式:
反应的热化学方程式:(5)根据盖斯定律计算
已知下列反应在
 时的反应焓变:
时的反应焓变: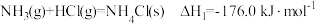
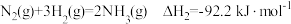
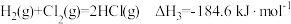
计算反应
 在
在 时的焓变
时的焓变
您最近一年使用:0次
名校
4 . 科学家利用氧化锆锌作催化剂,在一定温度下将 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇 ,其原理为:
,其原理为:
 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题:
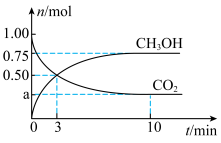
(1)图中
_____ ; 时,
时, 的转化率为
的转化率为_____ 。
(2)下列叙述正确的是_____ (填序号)。
a. 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率
b.由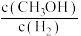 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态
c.当 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态
d.若改变催化剂,则反应达到平衡状态所需的时间一定小于
(3)该温度下达到平衡时,混合气体中 的体积分数为
的体积分数为_____ ,此时体系压强与开始时的压强之比为_____ 。
(4)其他条件不变时,下列措施不能使生成 的反应速率增大的是
的反应速率增大的是_____ (填序号)。
a.增大 的浓度
的浓度
b.将容器的容积变为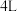
c.恒容条件下充入一定量
d.将恒温恒容容器改为绝热恒容容器
已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量_____ (填“增大”“减小”或“不变”)。
 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇 ,其原理为:
,其原理为:
 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题:
(1)图中

 时,
时, 的转化率为
的转化率为(2)下列叙述正确的是
a.
 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率b.由
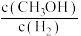 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态c.当
 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态d.若改变催化剂,则反应达到平衡状态所需的时间一定小于

(3)该温度下达到平衡时,混合气体中
 的体积分数为
的体积分数为(4)其他条件不变时,下列措施不能使生成
 的反应速率增大的是
的反应速率增大的是a.增大
 的浓度
的浓度b.将容器的容积变为
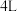
c.恒容条件下充入一定量

d.将恒温恒容容器改为绝热恒容容器
已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量
您最近一年使用:0次
2023-07-12更新
|
624次组卷
|
2卷引用:山东省东明县第一中学2023-2024学年高二上学期10月月考化学试题
名校
5 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: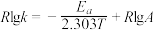 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能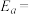
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
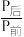 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: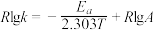 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
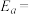

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
473次组卷
|
2卷引用:山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷
名校
6 . 完成下列问题
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为_______ 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=_______ ,若温度不变,0.005 mol·L-1的H2SO4溶液中,由水电离出的c(H+)=_______ 。
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=_______ ;此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为_______ 。
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO )约为
)约为_______ 。
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO
 )约为
)约为
您最近一年使用:0次
2023-03-04更新
|
600次组卷
|
2卷引用:山东省青岛第十九中学2023-2024学年高二上学期期中考试化学试卷
2023高三·全国·专题练习
7 . 已知 时某弱酸
时某弱酸 的电离常
的电离常 ,则
,则 时
时 的
的 溶液中
溶液中 浓度是
浓度是_______ 。
 时某弱酸
时某弱酸 的电离常
的电离常 ,则
,则 时
时 的
的 溶液中
溶液中 浓度是
浓度是
您最近一年使用:0次
解题方法
8 . 在一定温度时的水溶液中,若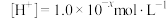 ,
, ,若x和y符合如图所示的线性关系, 过点A和点B。
,若x和y符合如图所示的线性关系, 过点A和点B。

(1)该温度下的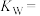
_______ 该中性溶液的pH =_______
(2)在该温度下10 mL 0.01 mol·L-1的盐酸与10 mL 0.015 mol·L-1的Ba(OH)2溶液混合后所得溶液的pH =_______
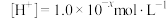 ,
, ,若x和y符合如图所示的线性关系, 过点A和点B。
,若x和y符合如图所示的线性关系, 过点A和点B。
(1)该温度下的
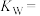
(2)在该温度下10 mL 0.01 mol·L-1的盐酸与10 mL 0.015 mol·L-1的Ba(OH)2溶液混合后所得溶液的pH =
您最近一年使用:0次
解题方法
9 . 25℃时欲使水电离产生的[H+]=10-13 mol·L-1,配制1L溶液,应向其中加入5.0mol·L-1的盐酸溶液_______ L,或加入氢氧化钠晶体_______ g。
您最近一年使用:0次
10 . 我国《生活饮用水卫生标准》中规定生活用水中锅的排放量不超过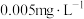 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉 沉淀溶解平衡常数的表达式:
沉淀溶解平衡常数的表达式: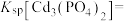
____________ 。
(2)一定温度下, 的
的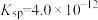 ,
, 的
的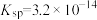 ,该温度下
,该温度下____________ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到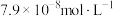 时,废水中
时,废水中 的浓度为
的浓度为_________________  [已知:
[已知: ,此时
,此时____________ (填“符合”或“不符合”)《生活饮用水卫生标准》。
(4)常温下,向50 mL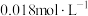 的
的 溶液中加入50 mL
溶液中加入50 mL  的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。
①反应后,溶液的pH=__________________
②如果向反应后的溶液中继续加入50 mL 的盐酸,
的盐酸,______ (填“有”或“无”)白色沉淀生成。
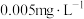 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。(1)写出磷酸镉
 沉淀溶解平衡常数的表达式:
沉淀溶解平衡常数的表达式: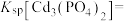
(2)一定温度下,
 的
的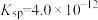 ,
, 的
的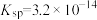 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到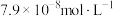 时,废水中
时,废水中 的浓度为
的浓度为 [已知:
[已知: ,此时
,此时(4)常温下,向50 mL
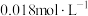 的
的 溶液中加入50 mL
溶液中加入50 mL  的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。①反应后,溶液的pH=
②如果向反应后的溶液中继续加入50 mL
 的盐酸,
的盐酸,
您最近一年使用:0次



