22-23高二上·北京西城·期中
名校
解题方法
1 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属化学平衡。
I.填空。
(1)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_______ 。(已知 )
)
(2)某温度下,水的离子积常数KW=1×10-12。将此温度下pH=11的NaOH溶液aL与pH=1的bLH2SO4溶液混合,若所得混合液pH=2,则a:b=_______
II.已知H2A在水中存在以下平衡:H2A=H++HA-,HA- A2-+H+。
A2-+H+。
(3)常温下 溶液的pH
溶液的pH_______ (填序号),仅用化学用语解释原因_______ 。
A.大于7 B.小于7 C.等于7 D.无法确定
(4)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡: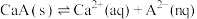
 。若要使该溶液中Ca2+浓度变小,可采取的措施有_______。
。若要使该溶液中Ca2+浓度变小,可采取的措施有_______。
III.
(5)某工业废水中主要含有Fe3+与Cr3+,毒性较大,若使用调节溶液pH的方法处理后的废水中残留的c(Fe3+)=2.0×10-13mol∙L-1,则残留的Cr3+的浓度为_______ (已知:Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Cr(OH)3]= 6.0×10-31)。
I.填空。
(1)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为
 )
)(2)某温度下,水的离子积常数KW=1×10-12。将此温度下pH=11的NaOH溶液aL与pH=1的bLH2SO4溶液混合,若所得混合液pH=2,则a:b=
II.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 A2-+H+。
A2-+H+。(3)常温下
 溶液的pH
溶液的pHA.大于7 B.小于7 C.等于7 D.无法确定
(4)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:
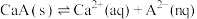
 。若要使该溶液中Ca2+浓度变小,可采取的措施有_______。
。若要使该溶液中Ca2+浓度变小,可采取的措施有_______。| A.升高温度 | B.降低温度 | C.加入NH4Cl晶体 | D.加入Na2A固体 |
III.
(5)某工业废水中主要含有Fe3+与Cr3+,毒性较大,若使用调节溶液pH的方法处理后的废水中残留的c(Fe3+)=2.0×10-13mol∙L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
名校
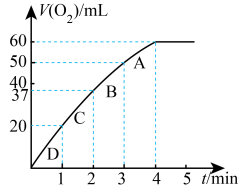
2 . 加0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(1)写出H2O2在MnO2作用下发生反应的化学方程式_______ 。
(2)实验时放出气体的总体积是_______ mL。
(3)反应进行4、3、2、1分钟分别对应曲线上A、B、C、D四点,各点反应速率快慢的顺序为_______ 。用有效碰撞理论解释该反应速率变化的原因_______ 。
(4)计算H2O2的初始物质的量浓度_______ 。(请保留两位有效数字)

(1)写出H2O2在MnO2作用下发生反应的化学方程式
(2)实验时放出气体的总体积是
(3)反应进行4、3、2、1分钟分别对应曲线上A、B、C、D四点,各点反应速率快慢的顺序为
(4)计算H2O2的初始物质的量浓度
您最近一年使用:0次
2022-10-12更新
|
311次组卷
|
2卷引用:北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
3 . 回答下列问题:
(1)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4•CO2催化重整不仅对温室气体的减排有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ•mol﹣1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H2=+165.0kJ•mol﹣1
写出该催化重整反应的热化学方程式:___________ 。
(2)若适量的N2和O2完全反应,每生成92gNO2需要吸收67.8kJ热量,则表示该反应的热化学方程式为___________ 。
(3)在0℃、101kPa时,44.8LH2在足量O2中完全燃烧生成H2O(1)放出571.6k]的热量,则表示H2燃烧热的热化学方程式为___________ 。
(4)我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到;C2H6(g) C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于
C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于 ___________ 。
(5)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) △H1
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2
再燃料水煤气:2CO(g)+O2(g)=2CO2(g) △H3
2H2(g)+O2(g)=2H2O(g) △H4
则△H1=___________ (用△H2、△H3、△H4表示)。
(1)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4•CO2催化重整不仅对温室气体的减排有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ•mol﹣1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H2=+165.0kJ•mol﹣1
写出该催化重整反应的热化学方程式:
(2)若适量的N2和O2完全反应,每生成92gNO2需要吸收67.8kJ热量,则表示该反应的热化学方程式为
(3)在0℃、101kPa时,44.8LH2在足量O2中完全燃烧生成H2O(1)放出571.6k]的热量,则表示H2燃烧热的热化学方程式为
(4)我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到;C2H6(g)
 C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于
C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于 | 化学键 | C﹣H | C﹣C | C=C | H﹣H |
| 键能/(kJ•mol﹣1) | 410 | 345 | 610 | 430 |
(5)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) △H1
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2
再燃料水煤气:2CO(g)+O2(g)=2CO2(g) △H3
2H2(g)+O2(g)=2H2O(g) △H4
则△H1=
您最近一年使用:0次
4 . 根据下列实验数据,写出CuSO4(s) 转化为CuSO4·5H2O(s)的热化学方程式________ (给出具体计算过程,保留整数)。
I.称取3.2 gCuSO4 (160g·mol-1) 置于盛有H2O的烧杯(33.5g) 中搅拌溶解,得到50 mL CuSO4溶液,溶液温度升高5.5 °C。
II.称取5.0 g CuSO4·5H2O (250 g·mol-1)置于盛有H2O的烧杯(33.5g)中搅拌溶解,得到50 mL CuSO4溶液,溶液温度降低1.0 °C。已知: 烧杯、CuSO4溶液的比热容分别为0.84J·g-1·K-1、4.2 J-1·mL-1·K-1。
I.称取3.2 gCuSO4 (160g·mol-1) 置于盛有H2O的烧杯(33.5g) 中搅拌溶解,得到50 mL CuSO4溶液,溶液温度升高5.5 °C。
II.称取5.0 g CuSO4·5H2O (250 g·mol-1)置于盛有H2O的烧杯(33.5g)中搅拌溶解,得到50 mL CuSO4溶液,溶液温度降低1.0 °C。已知: 烧杯、CuSO4溶液的比热容分别为0.84J·g-1·K-1、4.2 J-1·mL-1·K-1。
您最近一年使用:0次
5 . (1)有两种有机物都含有碳92.3%,含有氢7.7%,第一种有机物对氢气的相对密度为13,第二种有机物的密度为3.49g/L(标准状况下),则第一种有机物的结构简式 为___ ,第二种有机物的分子式 为___ 。
(2)某仅由C、H、O三种元素组成的有机化合物,经测定相对分子质量为90,取该有机化合物样品1.8g,在纯氧中完全燃烧将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g,则该有机化合物分子式 为___ 。
(2)某仅由C、H、O三种元素组成的有机化合物,经测定相对分子质量为90,取该有机化合物样品1.8g,在纯氧中完全燃烧将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g,则该有机化合物
您最近一年使用:0次
2021-04-17更新
|
469次组卷
|
2卷引用:北京市第四十三中学2020-2021学年高二下学期第一次月考化学试题
解题方法
6 . 反应 I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
(1)该温度下,该反应的化学平衡常数 K=___________ 。
(2)相同温度下,按以下初始浓度进行实验:
① 反应向__________ 方向(填“正反应”或者“逆反应”)进行,结合计算说明理由:___________ 。
②该反应达到平衡时,容器中c(HI)=___________ mmol•L-1,I2 的转化率是___________ 。
 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)(1)该温度下,该反应的化学平衡常数 K=
(2)相同温度下,按以下初始浓度进行实验:
| 物质 | 初始浓度 |
| c(I2)/mmol•L-1 | 1.00 |
| c(H2)/mmol•L-1 | 1.00 |
| c(HI)/mmol•L-1 | 1.00 |
②该反应达到平衡时,容器中c(HI)=
您最近一年使用:0次
解题方法
7 . 我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料,可以用来制备碳酸钠:将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是___________ 。
已知:I.2NaOH(s)+CO2(g) =Na2CO3(s)+H2O(g) ΔH1=-127.4kJ·mol-1
II.NaOH(s)+ CO2(g) =NaHCO3(s) ΔH2=-131.5 kJ·mol-1
则:2NaHCO3(s)=Na2CO3(s)+CO2(g)+H2O(g) ΔH=___________ kJ·mol−1
已知:I.2NaOH(s)+CO2(g) =Na2CO3(s)+H2O(g) ΔH1=-127.4kJ·mol-1
II.NaOH(s)+ CO2(g) =NaHCO3(s) ΔH2=-131.5 kJ·mol-1
则:2NaHCO3(s)=Na2CO3(s)+CO2(g)+H2O(g) ΔH=
您最近一年使用:0次
解题方法
8 . 工业生产中用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A: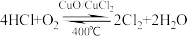 ,对于反应A,下图是4种投料比[
,对于反应A,下图是4种投料比[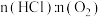 ,分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
,分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
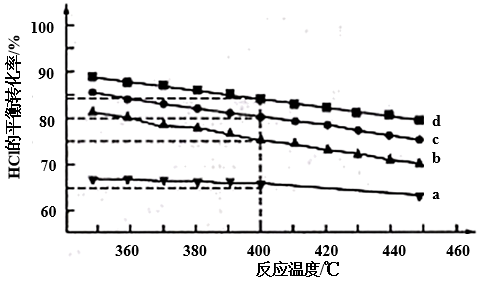
①曲线b对应的投料比是______ 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是_____ 。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是____ 。
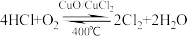 ,对于反应A,下图是4种投料比[
,对于反应A,下图是4种投料比[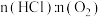 ,分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
,分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是
您最近一年使用:0次
2020-11-20更新
|
133次组卷
|
2卷引用:北京市第四十四中学2021-2022学年高二上学期期中考试化学试题
名校
9 . 已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K= ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为___ ;K值为___ 。
(2)830K时,若只将起始时c(H2O)改为6mol·L-1,则水蒸气的转化率为___ 。
(3)若830K时,起始加入物质为CO和H2O,起始浓度c(CO)=amol·L-1,c(H2O)=bmol·L-1,过段时间,达到平衡时H2的平衡浓度c(H2)=cmol·L-1
①a、b、c之间的关系式是___ ;
②当a=b时,a=___ c。
 CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K= ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。(1)830K时,若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为
(2)830K时,若只将起始时c(H2O)改为6mol·L-1,则水蒸气的转化率为
(3)若830K时,起始加入物质为CO和H2O,起始浓度c(CO)=amol·L-1,c(H2O)=bmol·L-1,过段时间,达到平衡时H2的平衡浓度c(H2)=cmol·L-1
①a、b、c之间的关系式是
②当a=b时,a=
您最近一年使用:0次
2020-10-20更新
|
593次组卷
|
11卷引用:北京市昌平临川育人学校2017-2018学年高二上学期期中考试化学试题
北京市昌平临川育人学校2017-2018学年高二上学期期中考试化学试题2014-2015河北枣强中学高二上学期期末考试化学试卷2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷吉林省梅河口市朝鲜族中学2019-2020学年高二上学期期末考试化学试题陕西省黄陵县中学2020-2021学年高二上学期期中考试化学试题(高新部)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率2.2.3化学平衡常数 课后广东省惠州市龙门县高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 氧化亚铜常用于制船底防污漆。用CuO与Cu高温烧结可制取Cu2O。已知反应:
2Cu(s)+O2(g)=2CuO(s) ΔH=−314kJ/mol
2Cu2O(s)+O2(g)=4CuO(s) ΔH=−292kJ/mol
则反应CuO(s)+Cu(s)=Cu2O(s)的ΔH=_____ 。
2Cu(s)+O2(g)=2CuO(s) ΔH=−314kJ/mol
2Cu2O(s)+O2(g)=4CuO(s) ΔH=−292kJ/mol
则反应CuO(s)+Cu(s)=Cu2O(s)的ΔH=
您最近一年使用:0次



