名校
解题方法
1 . 电化学广泛应用于工业生产和环境保护上。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
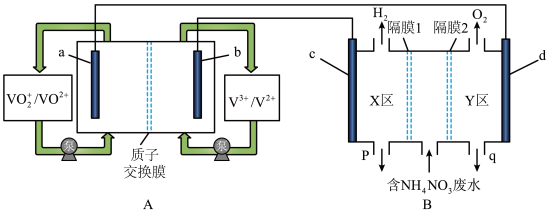
①全钒液流电池放电时,a电极反应式为___________ ,电子的流向由___________ (填“a→导线→d”或“d→导线→a”)。
②隔膜1为___________ 离子交换膜(填“阴”或“阳”),装置B中q口流出液中主要的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
③当装置A中有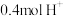 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为___________ L(标准状况下),处理___________ 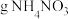 。
。
(2)用电解法可除去硝酸工业产生的尾气NO,并得到 ,工作原理如下图。
,工作原理如下图。
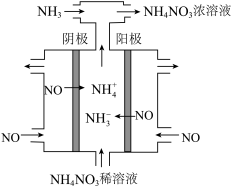
理论上通入 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为___________ 。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含
 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
①全钒液流电池放电时,a电极反应式为
②隔膜1为
③当装置A中有
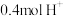 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为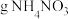 。
。(2)用电解法可除去硝酸工业产生的尾气NO,并得到
 ,工作原理如下图。
,工作原理如下图。
理论上通入
 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为
您最近一年使用:0次
名校
2 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时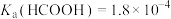
(1)配制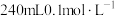 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液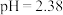 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: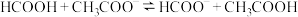 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数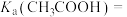
_______ 。
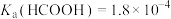
(1)配制
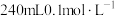 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
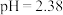 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
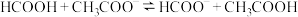 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数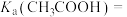
您最近一年使用:0次
2022-11-12更新
|
232次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
解题方法
3 . Ⅰ.金属铝的晶胞结构如图甲所示,原子之间相互位置关系的平面图如图乙所示。若已知 的原子半径为
的原子半径为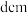 ,
, 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值, 的摩尔质量为
的摩尔质量为 ,请回答:
,请回答:
(1)一个晶胞中 原子的数目为
原子的数目为_______ 。
(2)该晶体的密度为_______  (用字母表示)。
(用字母表示)。
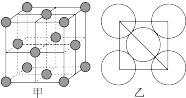
Ⅱ.硫化锌是一种半导体材料,S与Zn所形成化合物晶体的晶胞如图所示。

(3)由图可知,Zn的配位数为_______ 。
(4)原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0);b为( ,0,
,0, );c为(
);c为( ,
, ,0)。则d的坐标参数为
,0)。则d的坐标参数为_______ 。
(5)已知该晶胞的密度为ρg·cm-3,若晶胞的边长为x,则x为_______ pm;则其中阴阳离子间最短的距离为_______ pm。(均用ρ表示,列出计算式即可)
(6)已知Zn和S的原子半径分别为rZnpm和rSpm,则该晶胞中原子的体积占晶胞体积的百分率为_______ 。(用x表示,列出计算式即可)
 的原子半径为
的原子半径为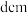 ,
, 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值, 的摩尔质量为
的摩尔质量为 ,请回答:
,请回答:
(1)一个晶胞中
 原子的数目为
原子的数目为(2)该晶体的密度为
 (用字母表示)。
(用字母表示)。Ⅱ.硫化锌是一种半导体材料,S与Zn所形成化合物晶体的晶胞如图所示。

(3)由图可知,Zn的配位数为
(4)原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0);b为(
 ,0,
,0, );c为(
);c为( ,
, ,0)。则d的坐标参数为
,0)。则d的坐标参数为(5)已知该晶胞的密度为ρg·cm-3,若晶胞的边长为x,则x为
(6)已知Zn和S的原子半径分别为rZnpm和rSpm,则该晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
解题方法
4 . 工业以黄铁矿为原料生产硫酸,吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
计算:该铵盐中氮元素的质量分数_______ (计算结果保留两位小数)
| 铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量(g) | m | m | 1.29 | 0 |
计算:该铵盐中氮元素的质量分数
您最近一年使用:0次
解题方法
5 . 恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为___ 。
(2)x=__ 。
(3)下列各项可作为该反应达到平衡状态的标志的是__ 。
A.压强不再变化
B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1
D.A的百分含量保持不变
 xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol·L-1。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化
B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1
D.A的百分含量保持不变
您最近一年使用:0次
2021-04-20更新
|
1130次组卷
|
3卷引用:湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题
湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题河南省济源市第五中学2020-2021学年高二下学期6月月考化学试题(已下线)2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
6 . (1)用系统命名法给下列有机物命名
①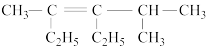
___________ ;
②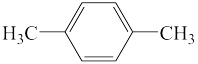
___________ ;
(2)相对分子质量为114,其一氯代物只有一种的链烃的结构简式___________ ,该物质的名称为___________ ;
(3)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的结构简式为___________ 。
①
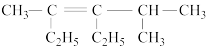
②

(2)相对分子质量为114,其一氯代物只有一种的链烃的结构简式
(3)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的结构简式为
您最近一年使用:0次
7 . 在一个盛有催化剂、容积可变的密闭容器中,保持一定温度和压强,进行以下反应:3H2(g)+N2(g)⇌2NH3(g)。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表已知项)。在相同温度、压强下,保持平衡时各组分的体积分数不变。对下列编号(1)~(3)的状态,填写表中①②③④⑤的内容。
已知 编号 | 起始状态各物质的物质的量(mol) | 平衡时NH3的物质的量(mol) | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
(1) | 1.5 | 6 | 0 | ① |
(2) | ② | ③ | 1 | 0.5a |
(3) | c | b(b≥4c) | ④ | ⑤ |
您最近一年使用:0次
名校
8 . 回答下列问题:
(1) 时,
时, 的盐酸中由水电离出的
的盐酸中由水电离出的 为
为___________ mol·L-1。
(2) 时,向
时,向 的蒸馏水中加入
的蒸馏水中加入 晶体,保持温度不变,测得溶液的
晶体,保持温度不变,测得溶液的 。此时水的离子积
。此时水的离子积
___________ ,溶液中 为
为___________ mol·L-1。
(3) 时,
时,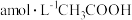 溶液的
溶液的 ,用含a和b的代数式表示
,用含a和b的代数式表示 的电离平衡常数
的电离平衡常数
___________ 。
(1)
 时,
时, 的盐酸中由水电离出的
的盐酸中由水电离出的 为
为(2)
 时,向
时,向 的蒸馏水中加入
的蒸馏水中加入 晶体,保持温度不变,测得溶液的
晶体,保持温度不变,测得溶液的 。此时水的离子积
。此时水的离子积
 为
为(3)
 时,
时,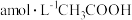 溶液的
溶液的 ,用含a和b的代数式表示
,用含a和b的代数式表示 的电离平衡常数
的电离平衡常数
您最近一年使用:0次
2021-03-01更新
|
248次组卷
|
2卷引用:湖北省石首市第一中学2020-2021学年高二上学期12月月考化学试题
9 . 硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+ O2(g)⇌ SO3(g) ΔH=−98 kJ·mol−1.将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为a,试通过列式计算:
O2(g)⇌ SO3(g) ΔH=−98 kJ·mol−1.将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为a,试通过列式计算:
(1)SO3压强=______
(2)平衡常数Kp=______ (以分压代替浓度,分压=总压×物质的量分数)。(只允许出现m、p、a等符号)
 O2(g)⇌ SO3(g) ΔH=−98 kJ·mol−1.将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为a,试通过列式计算:
O2(g)⇌ SO3(g) ΔH=−98 kJ·mol−1.将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为a,试通过列式计算:(1)SO3压强=
(2)平衡常数Kp=
您最近一年使用:0次
解题方法
10 . 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=___________ ,ΔH___________ 0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=___________ mol·L-1,C的物质的量为___________ mol;若反应经一段时间后,达到平衡时A的转化率为___________ ,如果这时向该密闭容器中再充入0.2 molB气体,平衡时A的转化率为___________ ;
(3)1200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为___________ 。
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 900 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=
(3)1200 ℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为
您最近一年使用:0次



