1 . 0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答:
(1)烃A的分子式为______ 。
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有____ g烃A参加了反应,燃烧时消耗标准状况下的氧气____ L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其氯代物只有一种,则烃A的结构简式为_______ 。
(4)若烃A能使溴水褪色,且在催化剂作用下,与 加成所得产物的分子中含4个甲基,烃A可能的结构简式为
加成所得产物的分子中含4个甲基,烃A可能的结构简式为_______ ,比烃A少2个碳原子的同系物,且能和 发生加成反应生成2-甲基丙烷的是
发生加成反应生成2-甲基丙烷的是_______ (填结构简式),它与溴的四氯化碳溶液反应的化学方程式为_______ 。
(1)烃A的分子式为
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其氯代物只有一种,则烃A的结构简式为
(4)若烃A能使溴水褪色,且在催化剂作用下,与
 加成所得产物的分子中含4个甲基,烃A可能的结构简式为
加成所得产物的分子中含4个甲基,烃A可能的结构简式为 发生加成反应生成2-甲基丙烷的是
发生加成反应生成2-甲基丙烷的是
您最近一年使用:0次
名校
解题方法
2 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数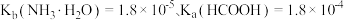 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数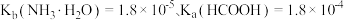 )
)
您最近一年使用:0次
名校
解题方法
3 . 硼元素有两种同位素: (相对原子质量10.0129,丰度19.78%)和
(相对原子质量10.0129,丰度19.78%)和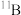 (相对原子质量11.00931,丰度80.22%)。请列式计算硼元素的相对原子质量(计算结果保留至小数点后两位)
(相对原子质量11.00931,丰度80.22%)。请列式计算硼元素的相对原子质量(计算结果保留至小数点后两位)___________ 。
 (相对原子质量10.0129,丰度19.78%)和
(相对原子质量10.0129,丰度19.78%)和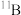 (相对原子质量11.00931,丰度80.22%)。请列式计算硼元素的相对原子质量(计算结果保留至小数点后两位)
(相对原子质量11.00931,丰度80.22%)。请列式计算硼元素的相对原子质量(计算结果保留至小数点后两位)
您最近一年使用:0次
名校
解题方法
4 . 已知水溶液中 和
和 的关系如图所示:
的关系如图所示:
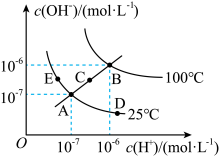
(1)①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是________ 。
②若A点到E点,可采用的措施是________ (填序号,下同);促进水的电离平衡正向移动的措施是________ 。
a.升温 b.加入少量的盐酸 c.加入少量的
(2)已知25℃, 的
的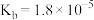 ,
, 的
的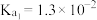 ,
,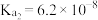 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的 约为
约为________  。将
。将 通入该氨水中,当
通入该氨水中,当 下降至
下降至 时,溶液中
时,溶液中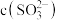 和
和 的比值是
的比值是________ 。
(3)常温下, 的
的 溶液与
溶液与 的硫酸混合,所得溶液的
的硫酸混合,所得溶液的 (近似认为酸碱总体积就是混合液体积),则
(近似认为酸碱总体积就是混合液体积),则 溶液与硫酸的体积比为
溶液与硫酸的体积比为________ 。
 和
和 的关系如图所示:
的关系如图所示:
(1)①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是
②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的

(2)已知25℃,
 的
的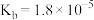 ,
, 的
的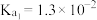 ,
,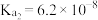 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的 约为
约为 。将
。将 通入该氨水中,当
通入该氨水中,当 下降至
下降至 时,溶液中
时,溶液中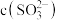 和
和 的比值是
的比值是(3)常温下,
 的
的 溶液与
溶液与 的硫酸混合,所得溶液的
的硫酸混合,所得溶液的 (近似认为酸碱总体积就是混合液体积),则
(近似认为酸碱总体积就是混合液体积),则 溶液与硫酸的体积比为
溶液与硫酸的体积比为
您最近一年使用:0次
5 . 实验室一瓶硫酸亚铁和硫酸铁混合物,取一定量样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·Lˉ1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸铁物质的量是
(2)若在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,最后残渣的质量是
您最近一年使用:0次
解题方法
6 . 研究化学反应中的能量变化具有重要的意义。回答下列问题:
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+ O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
①由上述热化学方程式可知甲醇的燃烧热△H=____________ 。
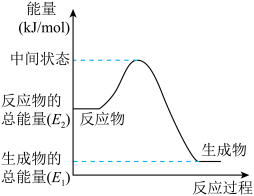
②上述第二个反应的能量变化如图所示,则△H2=___________ k/mol。(用E1、E2的相关式子表示)。.
(2)已知反应N2(g)+3H2(g) 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=________ 。
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是__________ (填化学式)。
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:_____________ 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________ 。
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol①由上述热化学方程式可知甲醇的燃烧热△H=
②上述第二个反应的能量变化如图所示,则△H2=

(2)已知反应N2(g)+3H2(g)
 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近一年使用:0次
解题方法
7 . Ⅰ、
(1)室温下,试计算:
①pH=4的亚硫酸溶液中,c(H+)H2O=___________ 。
②pH=2的盐酸加水稀释到1000倍,溶液的pH=___________ 。
Ⅱ、某温度下的水溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-ymol·L-1。x与y的关系如图所示:

(2)该温度下水的离子积为___________ (填具体数值);该温度___________ (填“高于”“低于”或“等于”)常温。
(3)该温度下0.01mol·L-1NaOH溶液的pH为___________ 。
(4)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性:AG=lg 。则该温度下,0.01mol·L-1盐酸的酸度AG=
。则该温度下,0.01mol·L-1盐酸的酸度AG=___________ 。
(1)室温下,试计算:
①pH=4的亚硫酸溶液中,c(H+)H2O=
②pH=2的盐酸加水稀释到1000倍,溶液的pH=
Ⅱ、某温度下的水溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-ymol·L-1。x与y的关系如图所示:

(2)该温度下水的离子积为
(3)该温度下0.01mol·L-1NaOH溶液的pH为
(4)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性:AG=lg
 。则该温度下,0.01mol·L-1盐酸的酸度AG=
。则该温度下,0.01mol·L-1盐酸的酸度AG=
您最近一年使用:0次
解题方法
8 . “孤蓬自振”学习小组向一定质量的Fe、FeO、Fe2O3的混合物中,加入100mL1.0mol/L的盐酸,恰好使混合物完全溶解并放出约224mL(标准状况)气体,溶液体积仍为100mL,所得溶液中滴加几滴KSCN溶液,溶液未显红色。请回答:
(1)加盐酸后所得溶液的溶质是______ (填化学式),物质的量浓度是______ mol/L。
(2)若用足量的CO在高温下还原相同质量的该混合物,最多能得到单质铁的质量是______ g。
(3)该混合物中铁、氧两种元素的粒子个数比N(Fe):N(O)=______ 。
(1)加盐酸后所得溶液的溶质是
(2)若用足量的CO在高温下还原相同质量的该混合物,最多能得到单质铁的质量是
(3)该混合物中铁、氧两种元素的粒子个数比N(Fe):N(O)=
您最近一年使用:0次
解题方法
9 . 高铁酸盐( )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO饱和溶液与 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为___________ 。
(2)聚合硫酸铁[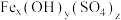 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式_______ (写出计算过程)。
 )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。(1)KClO饱和溶液与
 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为(2)聚合硫酸铁[
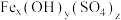 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用
 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。通过计算确定该聚合硫酸铁的化学式
您最近一年使用:0次
10 . 一定温度下,体积为2L的密闭容器中装有4molSO2和2molO2,发生反应2SO2+O2 2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
(1)2min末SO3的浓度是___________ ;
(2)2min内SO2的平均反应速率是___________ 。
(3)2min内O2的转化率是___________ 。
(4)该温度下的平衡常数为K=___________ L·mol-1。(计算结果)
 2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:(1)2min末SO3的浓度是
(2)2min内SO2的平均反应速率是
(3)2min内O2的转化率是
(4)该温度下的平衡常数为K=
您最近一年使用:0次



