2021高三·全国·专题练习
解题方法
1 . 硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:如图是 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
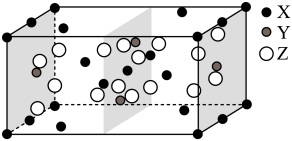
(1)已知化合物中 和
和 的原子个数比为1:4,图中Z表示
的原子个数比为1:4,图中Z表示_______ 原子(填元素符号),该化合物的化学式为_______ ;
(2)已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度
,则该晶体的密度
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
(1)已知化合物中
 和
和 的原子个数比为1:4,图中Z表示
的原子个数比为1:4,图中Z表示(2)已知该晶胞的晶胞参数分别为anm、bnm、cnm,
 ,则该晶体的密度
,则该晶体的密度
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-10-05更新
|
855次组卷
|
9卷引用:专题3 微粒间作用力与物质性质 第一~二单元综合拔高练
专题3 微粒间作用力与物质性质 第一~二单元综合拔高练(已下线)考点35 晶体结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题12 物质结构与性质必拿分数-【微专题·大素养】备战2022年高考化学讲透提分要点(已下线)考点48 晶体结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题52 有关晶体的计算-备战2023年高考化学一轮复习考点微专题(已下线)第31讲 晶体结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题34 晶体结构及相关计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题21 晶体类型晶体结构(选考)(已下线)06 常考题空6 有关晶胞参数的计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
2020高三·全国·专题练习
解题方法
2 . CO2是一种廉价的碳资源,其综合利用具有重要意义,CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)  2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=___________ 。
 2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
您最近一年使用:0次
2022-01-22更新
|
1524次组卷
|
16卷引用:高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测
高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第一节 反应热 高考帮广西岑溪市第一中学2020-2021学年高二9月月考化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测(已下线)专题6.1 化学能与热能(讲)——2020年高考化学一轮复习讲练测(已下线)第19讲 化学能与热能 (精讲)——2021年高考化学一轮复习讲练测(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)难点3 反应热的相关计算-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)二轮专题强化练 专题10 热化学方程式的书写与盖斯定律
2021高三·全国·专题练习
解题方法
3 . 研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=___________ g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。

氨硼烷晶体的密度ρ=
您最近一年使用:0次
2021-08-10更新
|
1173次组卷
|
13卷引用:专题3 微粒间作用力与物质性质 第三~四单元综合拔高练
专题3 微粒间作用力与物质性质 第三~四单元综合拔高练第一~二节综合拔高练2(已下线)小题37 晶体结构与性质(晶体类型与物质性质、晶胞相关计算)——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)考点35 晶体结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(十一)晶胞参数、坐标参数的分析与应用(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向38 晶体结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)考点48 晶体结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题23 晶体密度计算专练(已下线)第31讲 晶体结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题讲座(十二) 晶胞参数、坐标参数的分析与应用(练)-2023年高考化学一轮复习讲练测(全国通用)突破超重点 物质结构与性质 超重点4 晶胞计算问题(已下线)第五章 物质结构与性质 元素周期律 热点强化11 晶胞参数、坐标参数的分析与应用(已下线)06 常考题空6 有关晶胞参数的计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
2021高三·全国·专题练习
解题方法
4 . LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有___________ 个。
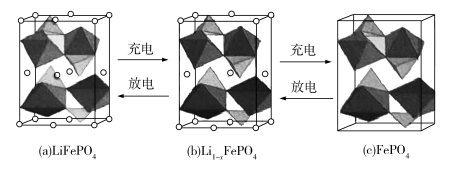
电池充电时,LiFePO4脱出部分Li+,形成Li1−xFePO4,结构示意图如(b)所示,则x=___________ ,n(Fe2+ )∶n(Fe3+)=___________ 。

电池充电时,LiFePO4脱出部分Li+,形成Li1−xFePO4,结构示意图如(b)所示,则x=
您最近一年使用:0次
2021-08-10更新
|
579次组卷
|
7卷引用:专题3 微粒间作用力与物质性质 第一~二单元综合拔高练
专题3 微粒间作用力与物质性质 第一~二单元综合拔高练第三节 综合拔高练(已下线)考点35 晶体结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(十一)晶胞参数、坐标参数的分析与应用(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向38 晶体结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)考点48 晶体结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 二轮专题突破 专题21 晶体类型晶体结构(选考)
名校
5 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
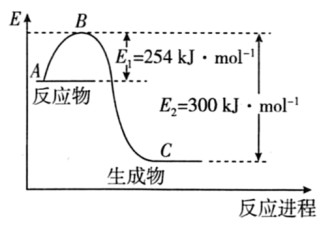
(1)如图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶___________
(2)若已知下列数据∶
试根据表中及图中数据计算N-H的键能∶___________ kJ·mol-1
(3)用 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知:
 ①
①
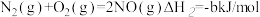 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3___________ kJ/mol(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I: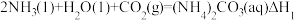
反应II: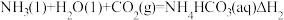
反应Ⅲ: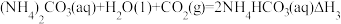
则△H3与△H1、△H2之间的关系是△H3=___________ 。
(1)如图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶
(2)若已知下列数据∶
| 化学键 | H-H | N=N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能∶
(3)用
 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知: ①
①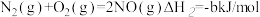 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:
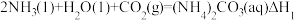
反应II:
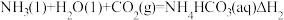
反应Ⅲ:
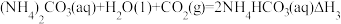
则△H3与△H1、△H2之间的关系是△H3=
您最近一年使用:0次
2021-06-20更新
|
1310次组卷
|
7卷引用:第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
名校
解题方法
6 . (1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:_______ 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+ O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=_______ kJ/mol。氢气的燃烧热为_______ kJ/mol。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为_______ 。
 O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为
您最近一年使用:0次
7 . (1)有两种有机物都含有碳92.3%,含有氢7.7%,第一种有机物对氢气的相对密度为13,第二种有机物的密度为3.49g/L(标准状况下),则第一种有机物的结构简式 为___ ,第二种有机物的分子式 为___ 。
(2)某仅由C、H、O三种元素组成的有机化合物,经测定相对分子质量为90,取该有机化合物样品1.8g,在纯氧中完全燃烧将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g,则该有机化合物分子式 为___ 。
(2)某仅由C、H、O三种元素组成的有机化合物,经测定相对分子质量为90,取该有机化合物样品1.8g,在纯氧中完全燃烧将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g,则该有机化合物
您最近一年使用:0次
2021-04-17更新
|
464次组卷
|
2卷引用:专题1 有机化学的发展及研究思路 第一~二单元 综合拔高练
8 . (1)某温度(t℃)时,水的Kw=1×10-12,则该温度___________ (填“>”“<”或“=”)25℃,其理由是___________ 。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈___________ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=___________ mol·L-1。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________ 移动。
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是___________ (填序号)。
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度___________ pH=10的Ba(OH)2溶液中水的电离程度。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度
您最近一年使用:0次
2021-04-16更新
|
1600次组卷
|
5卷引用:第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)广西贵港市立德高级中学2020-2021学年高二下学期3月月考化学试题(已下线)3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)山东省滨州市沾化区实验高级中学2022-2023学年高二10月月考化学试题
名校
解题方法
9 . 室温时20mL某气态烃X与过量的氧气混合,完全燃烧后恢复至室温,气体体积减少了60 mL,剩余气体再通过足量氢氧化钠溶液,体积又减少了80mL。完成下列各小题:
(1) X的分子式为_______ ;
(2) 若X能使溴的四氯化碳溶液褪色也能使紫色的酸性KMnO4溶液褪色,且其分子结构中无支链,则X的结构简式为_______ ,_______ ;
(3)与X具有相同的组成通式且比X多一个碳原子的烃Y,已知Y不能使溴的四氯化碳溶液褪色,则Y可能有的结构简式有_____ 种,这些结构的Y中,核磁共振H-NMR谱图上只有两个峰的结构简式为_______ (用键线式表示)。
(1) X的分子式为
(2) 若X能使溴的四氯化碳溶液褪色也能使紫色的酸性KMnO4溶液褪色,且其分子结构中无支链,则X的结构简式为
(3)与X具有相同的组成通式且比X多一个碳原子的烃Y,已知Y不能使溴的四氯化碳溶液褪色,则Y可能有的结构简式有
您最近一年使用:0次
2021-04-12更新
|
854次组卷
|
3卷引用:专题3 综合检测-苏教版2020选择性必修3
名校
10 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。已知①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2 kJ·mol-1,②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4 kJ·mol-1,又知CH4的燃烧热为890.3 kJ·mol-1。
(1)写出甲烷完全燃烧的热化学方程式:______ 。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______ 。
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的分别是______ ,等质量的A和H2,化学能较低的是______ 。______ 。
(1)写出甲烷完全燃烧的热化学方程式:
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的分别是


您最近一年使用:0次
2021-04-09更新
|
1064次组卷
|
2卷引用:第一章 化学反应的热效应(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)



