23-24高二下·全国·单元测试
1 . 有机物K在工业生产中有着重要的应用,其合成路线如下:
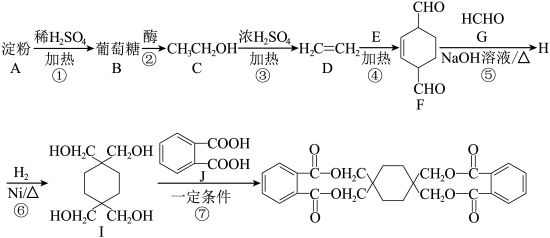
已知:i. +||
+||
ii.H3CCHO+3HCHO
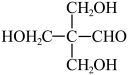
回答下列问题:
(1)葡萄糖的分子式为_____ ,有机物E的结构简式为_____ 。
(2)③的反应类型_____ ,有机物H中的含氧官能团名称为_____ 。
(3)反应⑦的条件为_____ 。
(4)有机物F与足量H2催化加氢后的产物与有机物J形成聚酯的化学方程式_____ 。
(5)有机物F满足下列条件的同分异构体有_____ 种。
①含有苯环,且苯环上有2个取代基
②可以和FeCl3溶液发生显色反应
③1mol的有机物和足量Na反应可产生1molH2
(6)根据上述流程,请设计由乙醇合成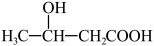 的流程:
的流程:_____ 。
(7)有机物E与M互为同分异构体,则M中含有两个甲基、碳碳双键和羧基的结构有_____ 种。

已知:i.
 +||
+||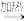

ii.H3CCHO+3HCHO


回答下列问题:
(1)葡萄糖的分子式为
(2)③的反应类型
(3)反应⑦的条件为
(4)有机物F与足量H2催化加氢后的产物与有机物J形成聚酯的化学方程式
(5)有机物F满足下列条件的同分异构体有
①含有苯环,且苯环上有2个取代基
②可以和FeCl3溶液发生显色反应
③1mol的有机物和足量Na反应可产生1molH2
(6)根据上述流程,请设计由乙醇合成
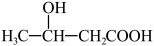 的流程:
的流程:(7)有机物E与M互为同分异构体,则M中含有两个甲基、碳碳双键和羧基的结构有
您最近一年使用:0次
名校
解题方法
2 . 新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(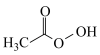 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为___________ ;基态氯原子的价电子排布图为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚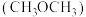 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
(3)Na、K等活泼金属在 中燃烧得到的
中燃烧得到的 、
、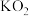 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知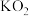 的晶胞如图所示:
的晶胞如图所示:
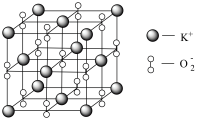
设阿伏加德罗常数的值为 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚
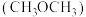 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是(3)Na、K等活泼金属在
 中燃烧得到的
中燃烧得到的 、
、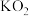 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知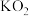 的晶胞如图所示:
的晶胞如图所示:
设阿伏加德罗常数的值为
 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
3 . 湿法冶炼是以赤铜矿(Cu2O)精矿为主要原料,通过浸出、置换、电解等流程制备高纯度铜的工艺。
已知:Cu2O晶胞为立方体形,边长为4.26×10−8 cm。
(1)根据图示,每个Cu2O晶胞中含O原子的数目为_______ 个。

(2)计算Cu2O晶体的密度ρ=_______ g/cm3.(结果保留两位小数)
(3)测定晶体结构最常用的仪器为
(4)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为_______ 。
已知:Cu2O晶胞为立方体形,边长为4.26×10−8 cm。
(1)根据图示,每个Cu2O晶胞中含O原子的数目为

(2)计算Cu2O晶体的密度ρ=
(3)测定晶体结构最常用的仪器为
| A.质谱仪 | B.核磁共振仪 | C.红外光谱仪 | D.X射线衍射仪 |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(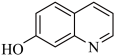 )、6−羟基喹啉(
)、6−羟基喹啉(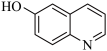 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
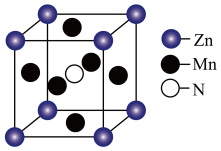
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。(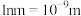 )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
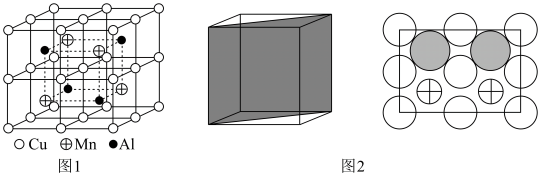
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。(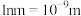 )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.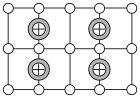 | B.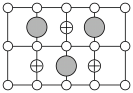 |
C. | D.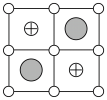 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
名校
解题方法
5 . 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的______ 区。
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有______ (填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为______ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有______ ,如表是2种二烃基锌的沸点数据,则烃基R1是______ ,推断的依据,是______ 。
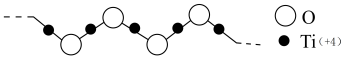
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为______ 。______ g•cm-3。用Al掺杂TiN后,其晶胞结构如图所示,距离Ti最近的Al有______ 个。(NA为阿伏加德罗常数的值)。
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
| A.①②③ | B.③①② | C.③②① | D.①③② |
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(℃) | 46 | 118 |
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为

您最近一年使用:0次
解题方法
6 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(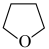 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: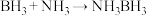 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
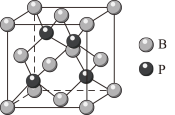
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: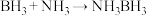 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
名校
解题方法
7 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以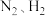 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同)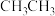 ,水溶性:
,水溶性:
_____ 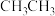 。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
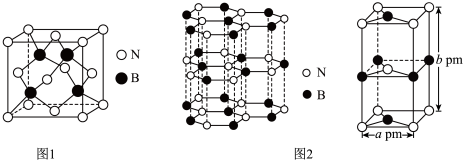
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为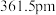 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为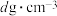 ,底面角分别为
,底面角分别为 和
和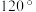 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以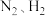 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

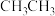 ,水溶性:
,水溶性:
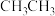 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为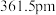 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为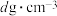 ,底面角分别为
,底面角分别为 和
和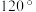 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
448次组卷
|
3卷引用:第三章晶体结构与性质(B卷)
23-24高二下·全国·单元测试
8 . 利用石油化工产品CH2=CHCH3合成高分子化合物D的流程如图。请回答下列问题:
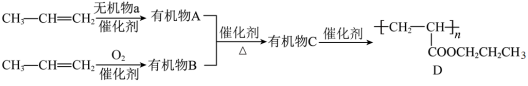
(1)CH2=CHCH3的名称为_____ 。
(2)A、B的结构简式分别为_____ 、_____ 。
(3)C中官能团的名称为_____ 。
(4)A+B→C的反应类型为_____ 。
(5)C→D的化学方程式为_____ 。

(1)CH2=CHCH3的名称为
(2)A、B的结构简式分别为
(3)C中官能团的名称为
(4)A+B→C的反应类型为
(5)C→D的化学方程式为
您最近一年使用:0次
23-24高一下·全国·课前预习
解题方法
9 . 葡萄糖、果糖
(1)二者分子式相同,但结构_____ ,互为同分异构体。均属于多羟基醛,官能团有_____ ,既有_____ 的性质,又有_____ 的性质。
(2)葡萄糖中醛基的检验
(1)二者分子式相同,但结构
(2)葡萄糖中醛基的检验
| 实验内容 | 实验操作 | 实验现象 | 解释或结论 |
| 用银氨溶液检验醛基 |  | ||
| 用新制氢氧化铜悬浊液检验醛基 | 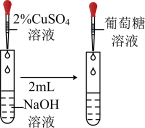 |
您最近一年使用:0次
名校
解题方法
10 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过如下实验流程制得:
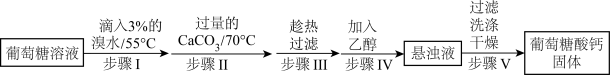
已知:a.反应原理: 。
。
b.相关物质的溶解性如下表:
c.相关物质的酸性:氢溴酸>葡萄糖酸>碳酸。
回答下列问题:
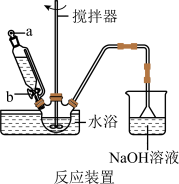
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是___________ ,恒压滴液漏斗使用时需要打开的活塞或玻璃塞是___________ (填“a”“b”或“a和b”)。烧杯中 溶液水浴的作用是
溶液水浴的作用是___________ 。
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
(3)步骤Ⅱ中加入过量的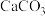 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为___________ 。加入过量的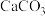 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是___________ 。
(4)洗涤操作中最合适的洗涤剂是___________ (填序号),理由是___________ 。
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:___________ (填序号,操作步骤不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入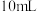 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入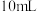 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液

已知:a.反应原理:
 。
。b.相关物质的溶解性如下表:
| 物质的名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
| 在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 极易溶 |
| 在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |
回答下列问题:
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是
 溶液水浴的作用是
溶液水浴的作用是
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
A.新制 悬浊液 悬浊液 | B.酸性 溶液 溶液 |
C. /葡萄糖氧化酶 /葡萄糖氧化酶 | D. 溶液 溶液 |
(3)步骤Ⅱ中加入过量的
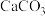 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为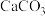 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是(4)洗涤操作中最合适的洗涤剂是
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入
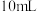 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入
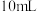 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
您最近一年使用:0次



