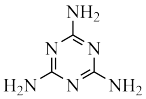
Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(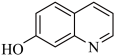 )、6−羟基喹啉(
)、6−羟基喹啉(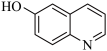 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
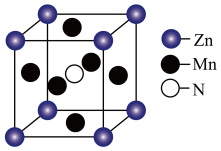
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
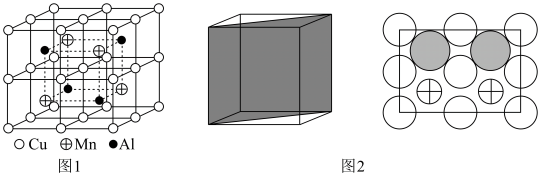
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.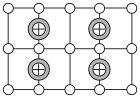 | B.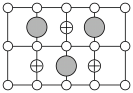 |
C. | D.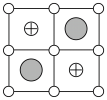 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

23-24高二上·河北秦皇岛·阶段练习 查看更多[2]
更新时间:2024-04-02 20:54:12
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】目前我国研制的稀土催化剂催化转化汽车尾气示意图如图:

(1)Zr原子序数为40,价电子排布式为___ 。图1中属于非极性的气体分子是___ 。
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF 中B—F的键长短,原因是
中B—F的键长短,原因是___ 。
②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。

B2H6的分子结构如图2所示,其中B原子的杂化方式为___ 。
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__ 。
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__ 。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是___ 。
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有___ 个。
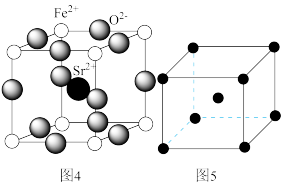
(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加 德罗常数为NA,试计算晶体铌的密度为___ g·cm-3(用来a、b、NA表示计算结果)。

(1)Zr原子序数为40,价电子排布式为
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF
 中B—F的键长短,原因是
中B—F的键长短,原因是②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。

B2H6的分子结构如图2所示,其中B原子的杂化方式为
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有

(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加 德罗常数为NA,试计算晶体铌的密度为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硫、锌分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
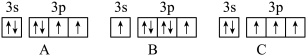
(1)基态硫原子的价电子排布式为___________ ,共有___________ 个未成对电子。下列状态的硫原子中,电离最外层1个电子所需能量最低的是___________ (填标号)。
(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因___________ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有___________ ,下表是2种二烃基锌的沸点数据,则烃基R1是___________ ,推断的依据,是___________ 。
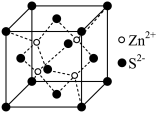
(4)闪锌矿硫化锌的晶胞结构如图所示。硫离子呈立方最密堆积,Zn2+填入S2-组成___________ 空隙中(填“正四面体”或“正八面体”);NA为阿伏加德罗常数,若晶体的密度为ρg/cm3,则S2-离子之间最短核间距离为___________ pm(用含ρ、NA的代数式表示)。
(1)基态硫原子的价电子排布式为

(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(°C) | 46 | 118 |

您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】W、R、X、Y、Z是原子序数依次增大的前四周期元素,其元素性质或原子结构如表:
回答下列问题:
(1)W的基态原子有_______ 种不同运动状态的电子,Z的价电子排布图为_______ 。
(2)W、R、X的简单氢化物中,三元素的原子的轨道杂化方式均为_______ ,键角由大到小的顺序是_______ (用对应的分子式表示),原因是_______ 。
(3)已知:羧酸的酸性可用pKa(pKa= -lg Ka)的大小来衡量,pKa越小,酸性越强。
由表可见,酸性:三氯乙酸_______ 三氟乙酸(填“大于”“小于”或“等于”),从键的极性角度解释原因:_______ 。
(4)联氨(N2H4)也叫肼,常用于火箭推进剂。N2H4_______ (填“难”或“易”)溶于水,原因_______ 。
| 元素 | 元素性质或原子结构 |
| W | 基态原子L能层所有能级上电子数相同 |
| R | 第二周期元素基态原子中未成对电子最多 |
| X | 基态原子核外s能级上电子总数与p能级上电子总数相等,且第一电离能低于同周期相邻元素 |
| Y | 最外层电子数是次外层电子数的一半 |
| Z | 最外层只有1个电子,其他内层各能级所有轨道电子均成对 |
(1)W的基态原子有
(2)W、R、X的简单氢化物中,三元素的原子的轨道杂化方式均为
(3)已知:羧酸的酸性可用pKa(pKa= -lg Ka)的大小来衡量,pKa越小,酸性越强。
| 羧酸 | pKa |
| 三氯乙酸(CCl3COOH) | 0.65 |
| 三氟乙酸(CF3COOH) | 0. 23 |
(4)联氨(N2H4)也叫肼,常用于火箭推进剂。N2H4
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属。回答下列问题:
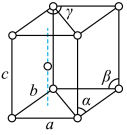
(1)基态钛原子的价电子排布式为_________________ 。金属钛晶胞如图所示,晶胞参数a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为______ 堆积(填堆积方式),其中钛原子的配位数为__ 。
(2)现有Ti3+的配合物[TiCl(H2O)5]Cl2·H2O。该配合物的配体是_________ ,配位数是_______ 。
(3)C、N、O等元素可与钛形成二元化合物。C、N、O元素的电负性由大到小的顺序是__________ 。已知:中心原子相同时,配位原子的电负性越大,键角越小;配位原子相同时,中心原子的电负性越大,键角越大,则NF3、PF3、NH3的键角由大到小的顺序为_____________ ,乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因______________ 。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为____________________ 。晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0, ,0);则Ca离子的原子坐标为
,0);则Ca离子的原子坐标为__________________ 。
(1)基态钛原子的价电子排布式为

(2)现有Ti3+的配合物[TiCl(H2O)5]Cl2·H2O。该配合物的配体是
(3)C、N、O等元素可与钛形成二元化合物。C、N、O元素的电负性由大到小的顺序是
(4)钙钛矿晶体的结构如图所示。晶体的化学式为
 ,0);则Ca离子的原子坐标为
,0);则Ca离子的原子坐标为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
(1)X基态原子的核外电子排布式为_______ ,Y的原子结构示意图_______ 。
(2)X是石油化工中重要的催化剂之一,如催化异丙苯( )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
① 1 mol苯分子中含有σ 键的数目为_______ mol。
② 异丙苯分子中碳原子轨道的杂化类型为_______ 。
(3)Y的氢化物沸点高于同族氢化物沸点的原因_______ 。
(4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XY3晶体属于_______ (填晶体类型)。
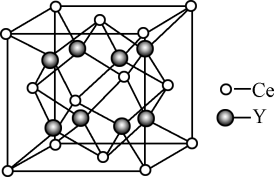
(5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为_______ 。
(1)X基态原子的核外电子排布式为
(2)X是石油化工中重要的催化剂之一,如催化异丙苯(
 )裂化生成苯和丙烯。
)裂化生成苯和丙烯。① 1 mol苯分子中含有σ 键的数目为
② 异丙苯分子中碳原子轨道的杂化类型为
(3)Y的氢化物沸点高于同族氢化物沸点的原因
(4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XY3晶体属于
(5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为_____________________ 。
(2)熔沸点:NH3_____ PH3(>、<、=),原因是_______________
(3)N、P、As三种元素电负性由小到大的顺序为___________ ,NCl3分子中中心原子的杂化方式为_________________ 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为___________ ,在这四种物质中含有极性键的非极分子内 键和
键和 键的比为
键的比为_______ 。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有________ ,配位体为__________ 。
A.氢键 B.离子键 C.共价键 D.配位键 E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为________________ 。
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为
(2)熔沸点:NH3
(3)N、P、As三种元素电负性由小到大的顺序为
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为
 键和
键和 键的比为
键的比为(5)K3[Fe(CN)6]配合物中微粒的相互作用力有
A.氢键 B.离子键 C.共价键 D.配位键 E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】M、Q、R、X、Y为原子序数依次增大的短周期主族元素。M原子核外电子有6种运动状态,R和X同主族。Z、W是第四周期的过渡元素,Z2+的核外d电子数是W+核外d电子数的一半,W+核外没有未成对电子。请回答下列问题:
(1)基态W原子的价层电子的轨道表示式为___________ 。
(2)M、Q和R的第一电离能由小到大的顺序是___________ (用元素符号表示)。
(3)比较简单离子半径:Xn___________ (填“>”“=”或“<”,下同)Ym-,Rn___________ P3-。
(4)在上述元素形成的微粒中,与MR2的空间结构相同的是___________ (写一种);QY3分子的空间结构是___________ 。
(5)W的单质晶体的晶胞结构如图所示。W的单质晶体中A、B、C、D围成1个正四面体空隙,该晶胞中正四面体空隙的数目为___________ 。某种Z的硫化物晶体中S2-以W的单质晶体中W原子的方式堆积,Z2+填充在正四面体空隙中,则Z2+的填充率(即填充Z2+的正四面体空隙数和正四面体空隙总数的比值)为___________ 。

(1)基态W原子的价层电子的轨道表示式为
(2)M、Q和R的第一电离能由小到大的顺序是
(3)比较简单离子半径:Xn
(4)在上述元素形成的微粒中,与MR2的空间结构相同的是
(5)W的单质晶体的晶胞结构如图所示。W的单质晶体中A、B、C、D围成1个正四面体空隙,该晶胞中正四面体空隙的数目为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】已知一些物质的熔点数据如表:
(1)SiO2的熔点明显高于AlCl3,原因是:________ ;SiO2晶体中硅填充在氧原子围成的________ 空隙中,氧原子的配位数为________ 。
(2)同为Al的卤素化合物,在熔融状态下,AlF3能导电,AlCl3和AlBr3则不能,据此判断AlF3属于________ (填“共价”或“离子”)化合物,试解释AlCl3和AlBr3两晶体熔点差别的原因:________ 。
(3)用VSEPR理论模型判断AlBr3的空间构型为________ ,AlF3的晶体结构如图所示,Al3+的配位数为________ 。

| 物质 | AlF3 | AlCl3 | AlBr3 | SiO2 |
| 熔点/℃ | 1090 | 190 | 90 | 1400 |
(1)SiO2的熔点明显高于AlCl3,原因是:
(2)同为Al的卤素化合物,在熔融状态下,AlF3能导电,AlCl3和AlBr3则不能,据此判断AlF3属于
(3)用VSEPR理论模型判断AlBr3的空间构型为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。
(1)基态钛原子核外共有_____ 种运动状态不相同的电子,价电子排布式____________________ ;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有__ 种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是___________________ 。
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是_______________ ,Ti原子采取____ 杂化方式;TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因:_______________________________ 。
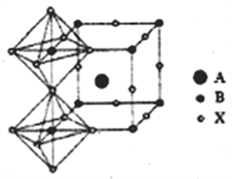
(4)钙钛矿材料是一类有着与钛酸钙(CaTiO3)相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。CaTiO3晶体结构如图所示。其中,A代表__________ (写离子符号),它的配位数是___________ 。
(1)基态钛原子核外共有
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是
(4)钙钛矿材料是一类有着与钛酸钙(CaTiO3)相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。CaTiO3晶体结构如图所示。其中,A代表

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】【化学——选修3:物质结构与性质】
氮元素的单质及其化合物在科研、生产领域有着十分广泛的用途。回答下列问题:
(1)GaN是研制微电子器件、光电子器件的新型半导体材料,基态氮原子的核外具有__________ 种不同能量的电子;基态镓原子的核外电子排布式为__________ 。
(2)在硫酸铜溶液中加入过量氨水,得到深蓝色透明溶液,该溶液中存在 ,其中提供孤电子对的原子是
,其中提供孤电子对的原子是__________ ,该配离子的结构可表示为__________ 。
(3) 是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。
是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。 分子中氮原子的杂化轨道类型为
分子中氮原子的杂化轨道类型为__________ ,氨气易液化的原因是____________________ 。
(4)氮化硼是一种有着广泛用途的新型材料,主要结构有立方氮化硼和六方氮化硼两种。
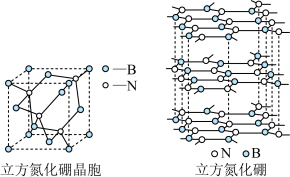
①立方氮化硼具有很高的硬度,仅次于金刚石,其晶体类型属于__________ 晶体,立方氮化硼中氮原子的配位数为__________ 。
②已知六方氮化硼同层中B与N原子核之间的距离为a cm,相邻层与层之间的距离为b cm,则该晶体的密度的计算式为__________  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
氮元素的单质及其化合物在科研、生产领域有着十分广泛的用途。回答下列问题:
(1)GaN是研制微电子器件、光电子器件的新型半导体材料,基态氮原子的核外具有
(2)在硫酸铜溶液中加入过量氨水,得到深蓝色透明溶液,该溶液中存在
 ,其中提供孤电子对的原子是
,其中提供孤电子对的原子是(3)
 是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。
是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。 分子中氮原子的杂化轨道类型为
分子中氮原子的杂化轨道类型为(4)氮化硼是一种有着广泛用途的新型材料,主要结构有立方氮化硼和六方氮化硼两种。

①立方氮化硼具有很高的硬度,仅次于金刚石,其晶体类型属于
②已知六方氮化硼同层中B与N原子核之间的距离为a cm,相邻层与层之间的距离为b cm,则该晶体的密度的计算式为
 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se元素基态原子的电子排布式为____ ;第四周期中第一电离能比Se元素大的共有____ 种(氪元素除外)。
(2)气态SeO3分子的价层电子对互斥模型为____ ;SeO42-离子中Se原子的杂化方式为 ___ 。
(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。
①图1中Se-O键键长较短的是___ (填“a"或“b"),其原因是______ 。
②SeO2熔点为350℃,固态SeO2属于___ 晶体,其熔点远高于SO2(-75.5℃)的原因是 ____ 。
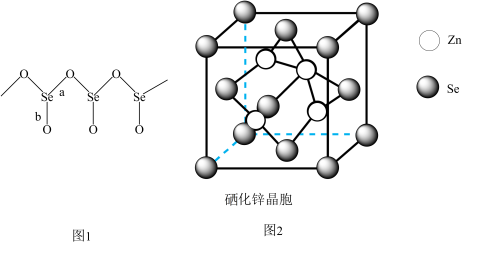
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)=____ nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为________ g.cm-3。
(1) Se元素基态原子的电子排布式为
(2)气态SeO3分子的价层电子对互斥模型为
(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。
①图1中Se-O键键长较短的是
②SeO2熔点为350℃,固态SeO2属于

(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)=
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】[化学——选修物质结构与性质]
A、B、C、D是原子序数依次递增的短周期元素,四种元素的质子数之和小于23。
A元素原子的电子总数等于其基态原子的电子层数。B元素原子的价电子结构为nsnnpn。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
其单质的熔点却低于同周期左右相邻元素的单质。D的电负性大于C。
(1)B、C、D分别是 、 、 ;
(2)C、D分别与A形成的最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会发生改变,其原因是 。
(3)BD2分子的晶体结构为密堆积,则每个BD2分子周围紧邻的分子有 个;
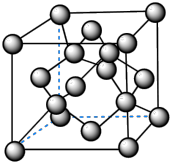
(4)上图为B元素的某种单质晶体X的晶胞,其中含有 个B原子,该晶体
(填“形成”或“没有形成”)最密堆积结构,原因是 。试分析比较晶体X与晶体BD2的熔点 。
A、B、C、D是原子序数依次递增的短周期元素,四种元素的质子数之和小于23。
A元素原子的电子总数等于其基态原子的电子层数。B元素原子的价电子结构为nsnnpn。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
其单质的熔点却低于同周期左右相邻元素的单质。D的电负性大于C。
(1)B、C、D分别是 、 、 ;
(2)C、D分别与A形成的最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会发生改变,其原因是 。
(3)BD2分子的晶体结构为密堆积,则每个BD2分子周围紧邻的分子有 个;

(4)上图为B元素的某种单质晶体X的晶胞,其中含有 个B原子,该晶体
(填“形成”或“没有形成”)最密堆积结构,原因是 。试分析比较晶体X与晶体BD2的熔点 。
您最近半年使用:0次



