名校
解题方法
1 . 过氧化钙晶体(CaO2·8H2O)在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用下图制取装置制备过氧化钙晶体:

①装置A中发生反应的化学方程式为______________________________ 。
②仪器X的名称为________ 。
③为提高CaO2·8H2O的产率,装置B的温度需控制在0 ℃,可采取的方法是__________________________________ 。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.500 0 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液的体积为20.00 mL。
求产品中CaO2·8H2O的质量分数____ 。(写出计算过程)
已知:CaO2·8H2O +2KI+2H2SO4=CaSO4+K2SO4+I2+10H2O;I2+2S2O =2I-+S4O
=2I-+S4O 。
。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用下图制取装置制备过氧化钙晶体:

①装置A中发生反应的化学方程式为
②仪器X的名称为
③为提高CaO2·8H2O的产率,装置B的温度需控制在0 ℃,可采取的方法是
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.500 0 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液的体积为20.00 mL。
求产品中CaO2·8H2O的质量分数
已知:CaO2·8H2O +2KI+2H2SO4=CaSO4+K2SO4+I2+10H2O;I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。
您最近一年使用:0次
名校
解题方法
2 . 草酸 是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性
是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性 溶液发生反应:
溶液发生反应: 。
。
(1)探究外界条件对反应速率的影响。
①完成此实验设计,其中:
___________ ,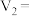
___________ 。
②对比实验1、2可探究___________ 对反应速率的影响。
(2)某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度。
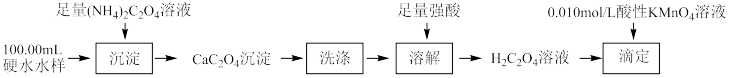
根据消耗酸性 标准溶液的体积即可测定硬水样品中
标准溶液的体积即可测定硬水样品中 的浓度。
的浓度。
①实验过程提及的下列仪器,在使用之前一定要润洗的是___________ (填字母)。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中___________ (填“需要”或“不需要”)另加指示剂,如何判断滴定终点___________ 。
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的 标准溶液为
标准溶液为___________  。该硬水样品中
。该硬水样品中 的浓度为
的浓度为___________  。
。

④下列不当操作会使测得的硬水样品 的浓度偏高的是
的浓度偏高的是___________ (填字母)
A.滴定管未用标准溶液润洗 B.草酸钙 沉淀洗涤不充分
沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
 是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性
是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性 溶液发生反应:
溶液发生反应: 。
。(1)探究外界条件对反应速率的影响。
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至 无色所需时间/min | |||
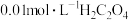 溶液 溶液 | 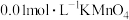 溶液 溶液 |  稀 稀 | 水 | 温度℃ | ||
| 1 | 12.0 | 2.0 | 3.0 | 3.0 | 20 |  |
| 2 | 6.0 | 2.0 | 3.0 |  | 20 |  |
| 3 |  | 2.0 | 3.0 | 9.0 | 30 |  |

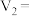
②对比实验1、2可探究
(2)某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度。

根据消耗酸性
 标准溶液的体积即可测定硬水样品中
标准溶液的体积即可测定硬水样品中 的浓度。
的浓度。①实验过程提及的下列仪器,在使用之前一定要润洗的是
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的
 标准溶液为
标准溶液为 。该硬水样品中
。该硬水样品中 的浓度为
的浓度为 。
。
④下列不当操作会使测得的硬水样品
 的浓度偏高的是
的浓度偏高的是A.滴定管未用标准溶液润洗 B.草酸钙
 沉淀洗涤不充分
沉淀洗涤不充分C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
您最近一年使用:0次
2023-12-17更新
|
124次组卷
|
2卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
名校
解题方法
3 . 羰基硫广泛应用在农药制备工业,是一种重要的有机合成中间体。利用 和
和 反应可以合成COS,回答下列问题:
反应可以合成COS,回答下列问题:
(1)由 和
和 合成
合成 的反应分两步进行,其能量变化如图所示。
的反应分两步进行,其能量变化如图所示。
①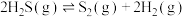
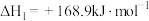
②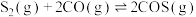
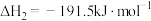
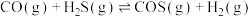 的
的
___________ 。决定COS生成速率的步骤是___________ (填“①”或“②”)。
(2)在恒压、CO和 的起始浓度一定的条件下,催化反应相同时间,测得各容器中CO的转化率与温度的关系如图所示:
的起始浓度一定的条件下,催化反应相同时间,测得各容器中CO的转化率与温度的关系如图所示: 段曲线变化的原因是
段曲线变化的原因是_______ ;能提高 平衡转化率的措施有
平衡转化率的措施有_______ (填序号)。
A.适当升温 B.及时分离COS C.降低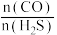 投料比 D.选择高效催化剂
投料比 D.选择高效催化剂
(3)在某温度下,向 的密闭容器中通入
的密闭容器中通入 和
和 各
各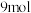 ,发生反应
,发生反应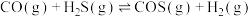 ,
, ,平衡时
,平衡时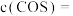
___________ 。若保持温度不变,再向容器中加入 和
和 ,平衡移动的方向为
,平衡移动的方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(4)实验测得该反应的速率方程为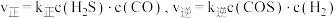 ,k为速率常数(受温度影响),则化学平衡常数
,k为速率常数(受温度影响),则化学平衡常数
___________ (用 、
、 表达),平衡后升高温度,
表达),平衡后升高温度, 增大的倍数
增大的倍数___________ (填“>”“<”或“=”) 增大的倍数。
增大的倍数。
 和
和 反应可以合成COS,回答下列问题:
反应可以合成COS,回答下列问题:(1)由
 和
和 合成
合成 的反应分两步进行,其能量变化如图所示。
的反应分两步进行,其能量变化如图所示。①
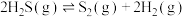
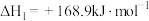
②
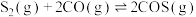
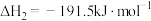
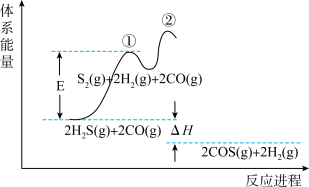
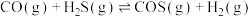 的
的
(2)在恒压、CO和
 的起始浓度一定的条件下,催化反应相同时间,测得各容器中CO的转化率与温度的关系如图所示:
的起始浓度一定的条件下,催化反应相同时间,测得各容器中CO的转化率与温度的关系如图所示: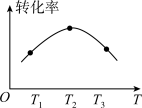
 段曲线变化的原因是
段曲线变化的原因是 平衡转化率的措施有
平衡转化率的措施有A.适当升温 B.及时分离COS C.降低
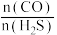 投料比 D.选择高效催化剂
投料比 D.选择高效催化剂(3)在某温度下,向
 的密闭容器中通入
的密闭容器中通入 和
和 各
各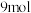 ,发生反应
,发生反应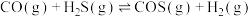 ,
, ,平衡时
,平衡时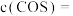
 和
和 ,平衡移动的方向为
,平衡移动的方向为(4)实验测得该反应的速率方程为
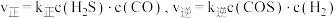 ,k为速率常数(受温度影响),则化学平衡常数
,k为速率常数(受温度影响),则化学平衡常数
 、
、 表达),平衡后升高温度,
表达),平衡后升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。
您最近一年使用:0次
2023-12-13更新
|
195次组卷
|
4卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
名校
4 . 已知25℃时 的电离常数
的电离常数 。常温下,往25mL氢氧化钠标准溶液中逐滴加入
。常温下,往25mL氢氧化钠标准溶液中逐滴加入 的
的 溶液,pH变化曲线如图所示:
溶液,pH变化曲线如图所示:_____ 。
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:_____ 。
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:_____ 。
(4)电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_____ (填字母序号)
(5)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。_____ 极(填“正”或“负”)。F电极上的电极反应式为_____ 。
(6)乙醛酸(HOOC−CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。已知乙二酸的结构简式为HOOC−COOH_____ 。
②若有 通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为_____ mol
 的电离常数
的电离常数 。常温下,往25mL氢氧化钠标准溶液中逐滴加入
。常温下,往25mL氢氧化钠标准溶液中逐滴加入 的
的 溶液,pH变化曲线如图所示:
溶液,pH变化曲线如图所示: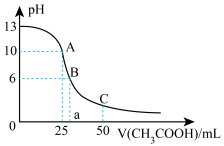
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:
(4)电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择

(5)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

(6)乙醛酸(HOOC−CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。已知乙二酸的结构简式为HOOC−COOH
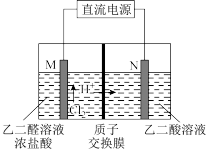
②若有
 通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
2023-11-20更新
|
165次组卷
|
3卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
名校
5 . 清洁能源的综合利用是实现“碳中和、碳达峰”的重要途径。
(1)以环已烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。芳构化反应: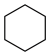 (g)→
(g)→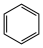 (g)+3H2(g) △H=
(g)+3H2(g) △H=___________ 。

(2)H2和CO2合成乙醇反应为:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
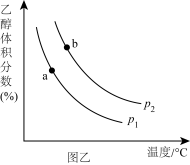
①压强p1___________ p2 (填“>”“=”或“<”,下同);a、b两点的平衡常数Ka___________ Kb。
②已知Arrhenius经验公式为Rlnk=-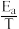 +C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=
+C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=___________ J/ mol。从图中信息获知催化效能较高的催化剂是___________ (填“m”或“n”)。

(3)H2和CO合成甲烷反应为:2CO(g)+2H2(g) CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为
CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为___________ ,该温度下反应的Kp=___________ (用组分的分压计算的平衡常数)。
(1)以环已烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。芳构化反应:
 (g)→
(g)→ (g)+3H2(g) △H=
(g)+3H2(g) △H=
(2)H2和CO2合成乙醇反应为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
①压强p1
②已知Arrhenius经验公式为Rlnk=-
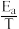 +C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=
+C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=
(3)H2和CO合成甲烷反应为:2CO(g)+2H2(g)
 CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为
CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为
您最近一年使用:0次
2023-10-04更新
|
542次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
6 . 滴定法在化学研究中有着重要意义。
I.第一化学学习小组同学利用滴定法测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取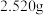 纯草酸晶体,将其制成
纯草酸晶体,将其制成 水溶液为待测液;
水溶液为待测液;
②取 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;
;
③用浓度为 的酸性
的酸性 标准溶液进行滴定。
标准溶液进行滴定。
(1)实验中不需要的仪器有___________ (填序号),还缺少的仪器有(填名称)___________ 、___________ 。
a.电子天平 b.滴定管 c.冷凝管 d.铁架台(附滴定管夹) e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)写出该反应的离子方程式___________ ,滴定时, 溶液应装在
溶液应装在___________ (“酸”或“碱”)式滴定管中,判定滴定终点方法为___________ 。
(3)通过下述数据,求得
___________ 。
表格中记录了实验数据:
(4)若滴定用的 溶液因久置部分变质,则实验结果所测定的x值将
溶液因久置部分变质,则实验结果所测定的x值将___________ (填“偏大”“偏小”或“无影响”后同)。若滴定终点读数时目光俯视,则计算的x值会___________ 。
II.第二化学学习小组用滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,用
,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。请回答下列问题:
。请回答下列问题:
(5) 水解生成
水解生成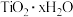 的化学方程式为
的化学方程式为___________ 。
(6)滴定选用的指示剂是___________ 。
(7)滴定分析时,称取 (摩尔质量为
(摩尔质量为 )试样
)试样 ,消耗
,消耗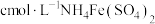 标准溶液
标准溶液 ,则
,则 质量分数表达式为
质量分数表达式为___________ 。
I.第一化学学习小组同学利用滴定法测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取
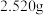 纯草酸晶体,将其制成
纯草酸晶体,将其制成 水溶液为待测液;
水溶液为待测液;②取
 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;
;③用浓度为
 的酸性
的酸性 标准溶液进行滴定。
标准溶液进行滴定。(1)实验中不需要的仪器有
a.电子天平 b.滴定管 c.冷凝管 d.铁架台(附滴定管夹) e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)写出该反应的离子方程式
 溶液应装在
溶液应装在(3)通过下述数据,求得

表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准 溶液(mL) 溶液(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.00 | 20.02 |
| 第二次 | 25.00 | 3.02 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.80 |
 溶液因久置部分变质,则实验结果所测定的x值将
溶液因久置部分变质,则实验结果所测定的x值将II.第二化学学习小组用滴定法测定
 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,用
,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。请回答下列问题:
。请回答下列问题:(5)
 水解生成
水解生成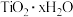 的化学方程式为
的化学方程式为(6)滴定选用的指示剂是
(7)滴定分析时,称取
 (摩尔质量为
(摩尔质量为 )试样
)试样 ,消耗
,消耗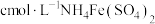 标准溶液
标准溶液 ,则
,则 质量分数表达式为
质量分数表达式为
您最近一年使用:0次
2023-08-28更新
|
220次组卷
|
2卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
7 . 碱式碳酸铜可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
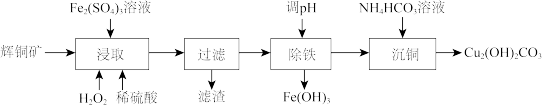
(1)滤渣可能含S、___________ (填化学式)。
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有___________ (填2条)。
②某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

由图一可知 适宜的浓度范围为
适宜的浓度范围为___________ ;由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为___________ ;图二中高于85℃时Cu浸取率下降的原因是___________ 。
(3)“除铁”步骤调pH可加入试剂___________ (填选项字母);
a.氨气 b.HCl c.CuO d.
常温下,“过滤”后的滤液中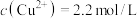 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于___________ [常温下,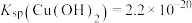 ]。
]。
 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)滤渣可能含S、
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有
②某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
由图一可知
 适宜的浓度范围为
适宜的浓度范围为 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为(3)“除铁”步骤调pH可加入试剂
a.氨气 b.HCl c.CuO d.

常温下,“过滤”后的滤液中
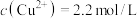 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于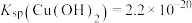 ]。
]。
您最近一年使用:0次
2023-05-19更新
|
244次组卷
|
3卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
8 . 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)(I)
(1)反应(I)中氧化剂是_____ 。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)=2NO2(g)(II)。当温度升高时,气体颜色变深,则反应(II)为_____ (填“吸热”或“放热”)反应。
(3)100℃时,将1molN2O4充入一恒压密闭容器中,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____ mol•L-1•s-1;反应的平衡常数K1的数值为_____ 。

(4)温度为T时反应达平衡后,将反应容器的容积减少一半,平衡向_____ (填“正反应”或“逆反应”)方向移动,判断理由是_____ 。
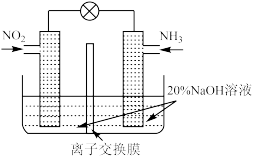
(5)利用反应6NO2+8NH3=7N2+12H2O构成电池,既减轻环境污染又充分利用了化学能。装置如图所示,电池的负极反应是_____ ;离子交换膜是_____ 交换膜(填“阳离子”或“阴离子”)。
(1)反应(I)中氧化剂是
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)=2NO2(g)(II)。当温度升高时,气体颜色变深,则反应(II)为
(3)100℃时,将1molN2O4充入一恒压密闭容器中,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为

(4)温度为T时反应达平衡后,将反应容器的容积减少一半,平衡向
(5)利用反应6NO2+8NH3=7N2+12H2O构成电池,既减轻环境污染又充分利用了化学能。装置如图所示,电池的负极反应是

您最近一年使用:0次
9 . 实验室利用红磷(P)与Cl2反应可制取少量PCl3或PCl5。
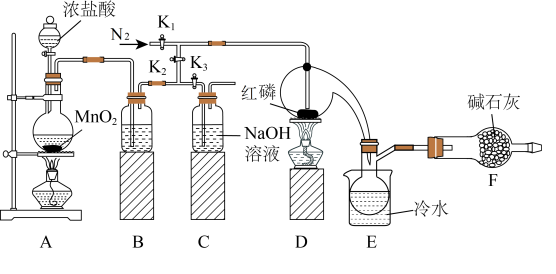
I.利用如图所示装置制取少量PCl3(部分夹持装置已略去)。
(1)组装好装置,在放入试剂前应先_____ 。
(2)A中发生反应的离子方程式为_____ 。
(3)B中所装试剂为_____ 。
(4)实验开始前,打开K1通入一段时间氮气来除去装置中的空气,除去空气的目的是_____ ;除去装置A、B中空气的具体方法是_____ 。
(5)除去产物中PCl5杂质的化学反应方程式是_____ 。
II.测定产品中PCl3的质量分数
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化学反应方程式是_____ 。
(7)逐滴滴加Na2S2O3溶液使用的仪器是_____ 。(已知:H2S2O3是弱酸)。
(8)根据上述数据测得该产品中PCl3的质量分数为_____ 。(已知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6)
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,与O2反应生成POCl3 |
| PCl5 | — | 约100℃升华 | 遇水生成H3PO4和HCl,与红磷反应生成PCl3 |

(1)组装好装置,在放入试剂前应先
(2)A中发生反应的离子方程式为
(3)B中所装试剂为
| A.饱和碳酸氢钠溶液 | B.饱和氯化钠溶液 |
| C.氢氧化钠溶液 | D.浓硫酸 |
(5)除去产物中PCl5杂质的化学反应方程式是
II.测定产品中PCl3的质量分数
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化学反应方程式是
(7)逐滴滴加Na2S2O3溶液使用的仪器是
(8)根据上述数据测得该产品中PCl3的质量分数为
您最近一年使用:0次
10 . 顺式聚异戊二烯是重要的有机化工原料,可由下列方法合成。
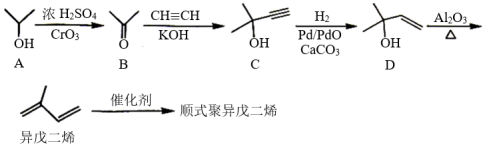
(1)用系统命名法给A命名_____ ;C含有的官能团是_____ 。
(2)C→D的反应类型是_____ 。
(3)化合物X与异戊二烯具有相同的分子式,与Br2的CCl4溶液反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_____ 。
(4)异戊二烯分子中最多有_____ 个原子共平面。
(5)顺式聚异戊二烯的结构简式为_____ 。
(6)设计合成路线:由异戊二烯合成3-甲基-1-丁醇( )
)_____ 。(注意:不能采用异戊二烯与水直接加成的反应)

(1)用系统命名法给A命名
(2)C→D的反应类型是
(3)化合物X与异戊二烯具有相同的分子式,与Br2的CCl4溶液反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为
(4)异戊二烯分子中最多有
(5)顺式聚异戊二烯的结构简式为
(6)设计合成路线:由异戊二烯合成3-甲基-1-丁醇(
 )
)
您最近一年使用:0次



