2024高二·全国·专题练习
解题方法
1 . KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:

(1)反应I中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为___________ 。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是___________ ;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是___________ 。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,___________ 。
(4)整个流程中,可循环利用的物质有___________ (填化学式)。
(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B(NOCl),该反应的化学方程式为___________ ;气体B与O2反应生成1体积气体A和2体积红棕色气体C,该反应的化学方程式为___________ 。

(1)反应I中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,
(4)整个流程中,可循环利用的物质有
(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B(NOCl),该反应的化学方程式为
您最近一年使用:0次
2024高二·全国·专题练习
2 . ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:
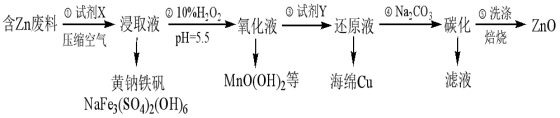
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
(1)试剂X为Na2SO4和___________ 的混合液,步骤①的浸取液里除含有Cu2+、Mn2+以外,还含有的金属离子有___________ ,写出Cu溶解变为Cu2+离子方程式___________ 。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式___________ 。
(3)步骤③加入试剂Y的目的是置换出Cu,则Y的化学式为___________ ,整个工艺流程中可以循环使用的试剂是___________ 。
(4)步骤⑤中检验沉淀是否洗涤干净的操作方法是___________ 。
(5)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是___________ 。

已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
(1)试剂X为Na2SO4和
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式
(3)步骤③加入试剂Y的目的是置换出Cu,则Y的化学式为
(4)步骤⑤中检验沉淀是否洗涤干净的操作方法是
(5)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是
您最近一年使用:0次
2024高二·全国·专题练习
解题方法
3 . 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为___________。
(2)操作Ⅱ中,通入硫化氢至饱和的目的是___________ ;在溶液中用硫酸酸化至pH=2的目的是___________ 。
(3)操作Ⅳ的顺序依次为___________ 、冷却结晶、___________ 。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________ 。
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为___________ (填仪器名称)。
②判断此滴定实验达到终点的方法是___________ 。
③计算上述样品中FeSO4·7H2O的质量分数为___________ 。

查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为___________。
| A.KSCN溶液 | B.NaOH溶液 |
| C.KMnO4溶液 | D.苯酚溶液 |
(2)操作Ⅱ中,通入硫化氢至饱和的目的是
(3)操作Ⅳ的顺序依次为
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为
②判断此滴定实验达到终点的方法是
③计算上述样品中FeSO4·7H2O的质量分数为
您最近一年使用:0次
2024高二·全国·专题练习
4 . 电镀含铬废水的处理方法较多。
I.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:
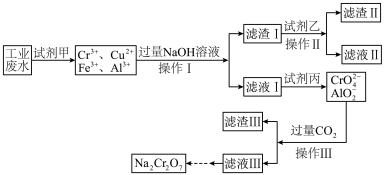
已知:
a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作I的名称为___________ ,上述操作I、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有___________ 。
(2)滤渣I的主要成分为___________ (写化学式),试剂乙的名称为___________ 。
(3)加入试剂甲的目的是___________ 。
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为___________ 。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O 的废水:
的废水:
①往废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准。
(5)电解时能否用Cu电极来代替Fe电极___________ (填“能”或“不能”),理由是___________ 。
(6)已知某含Cr2O 的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为
的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为___________ kg。
I.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:

已知:
a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作I的名称为
(2)滤渣I的主要成分为
(3)加入试剂甲的目的是
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为
Ⅱ.酸性条件下,六价铬主要以Cr2O
 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O 的废水:
的废水:①往废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准。
(5)电解时能否用Cu电极来代替Fe电极
(6)已知某含Cr2O
 的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为
的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为
您最近一年使用:0次
13-14高二·全国·单元测试
名校
解题方法
5 . 某校化学研究性学习小组欲设计实验验证Fe、Cu金属活动性的相对强弱,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)方案I:有人提出将大小相等的铁片和铜片分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________ 。
(2)方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们活动性的相对强弱。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式_________ 。
正极反应式:_________ ;负极反应式:_________ 。
(3)方案III:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性相对强弱的简单实验方案(与方案I、II不能雷同):_________ ,用离子方程式表示其反应原理:________ 。
(1)方案I:有人提出将大小相等的铁片和铜片分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为
(2)方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们活动性的相对强弱。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式
(3)方案III:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性相对强弱的简单实验方案(与方案I、II不能雷同):
您最近一年使用:0次
2023-08-27更新
|
109次组卷
|
15卷引用:2018年11月25日 《每日一题》人教选修4-每周一测
(已下线)2018年11月25日 《每日一题》人教选修4-每周一测(已下线)2019年11月24日《每日一题》高二化学人教版(选修4)—— 每周一测(已下线)2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷2016-2017学年河南省南阳市宛东五校高二上第一次联考化学试卷(已下线)专题05 化学能与电能(核心精讲)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)(已下线)专题05 化学能与电能(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)云南省瑞丽市第一民族中学2021-2022学年高二上学期期末考试化学试题作业(四) 原电池的工作原理2015-2016学年辽宁省沈阳铁路实验中学高一下期中化学试卷【全国市级联考】河南省南阳市2017-2018学年高一下学期期末考试化学试题苏教版高一化学必修2专题2《化学反应与能量转化》测试卷(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化上海市同济中学2021-2022学年高一下学期期末考试化学试卷 海南省琼海市嘉积中学2023-2024学年高三上学期期末考试化学试题A卷内蒙古通辽市科尔沁左翼中旗实验高级中学2023-2024学年高三下学期4月月考理综试题-高中化学
名校
解题方法
6 . 在一定温度下的稀溶液中,强酸与强碱发生中和反应生成1 mol H2O,这时的反应热就是中和反应的反应热。50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应的反应热。试回答下列问题:
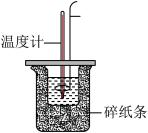
(1)大小烧杯间填满碎纸条的作用是_______ 。
(2)大烧杯上如不盖硬纸板,求得的中和反应的反应热数值将_______ (填“偏大”“偏小”或“无影响”)。结合日常生活的实际该实验在_______ 中进行效果更好。
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”或“不相等”),所求中和反应的反应热_______ (填“相等”或“不相等”),简述理由:_______ 。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热的数值会_______ ;用50 mL 0.5 mol·L-1 NaOH溶液进行上述实验,测得的中和反应的反应热的数值会_______ (填“偏大”“偏小”或“无影响”)。

(1)大小烧杯间填满碎纸条的作用是
(2)大烧杯上如不盖硬纸板,求得的中和反应的反应热数值将
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热的数值会
您最近一年使用:0次
2023-08-26更新
|
651次组卷
|
3卷引用:专题01 反应热、焓变与热化学方程式【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
(已下线)专题01 反应热、焓变与热化学方程式【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)第1课时 化学反应的反应热广西玉林市博白县中学2023-2024学年高二上学期第一次月考化学试题
2023高三·全国·专题练习
名校
解题方法
7 . 回答下列问题。
(1)已知下列反应:SO2(g)+2OH-(aq)=SO (aq)+H2O(l) ΔH1,ClO-(aq)+SO
(aq)+H2O(l) ΔH1,ClO-(aq)+SO (aq)=SO
(aq)=SO (aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO
(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO (aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1,②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇燃烧生成液态水的热化学方程式:
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇燃烧生成液态水的热化学方程式: ___________ 。
(3)下表是部分化学键的键能数据,已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___________ kJ·mol-1(用含有a、b、c、d的代数式表示)。
(4)①2O2(g)+N2(g)=N2O4(l) ΔH1,②N2(g)+2H2(g)=N2H4(l) ΔH2,③O2(g)+2H2(g)=2H2O(g) ΔH3,④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9 kJ·mol-1
上述反应热效应之间的关系式为ΔH4=___________ ,联氨和N2O4可作为火箭推进剂的主要原因为___________ 。
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1,②CO2(g)+3H2(g)
CH3OH(g) ΔH1,②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2,③CO2(g)+H2(g)
CH3OH(g)+H2O(g) ΔH2,③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,
CO(g)+H2O(g) ΔH3,
已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=___________ kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=___________ kJ·mol-1。
(6)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为 kJ。
(7)碘可用作心脏起搏器电源——锂碘电池的材料。该电池反应为:2Li(s)+I2(s)=2LiI(s) ΔH ,已知:4Li(s)+O2(g)=2Li2O(s) ΔH1,4LiI(s)+O2(g)=2I2(s)+2Li2O(s) ΔH2,则电池反应的ΔH=___________ 。
(1)已知下列反应:SO2(g)+2OH-(aq)=SO
 (aq)+H2O(l) ΔH1,ClO-(aq)+SO
(aq)+H2O(l) ΔH1,ClO-(aq)+SO (aq)=SO
(aq)=SO (aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO
(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO (aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1,②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇燃烧生成液态水的热化学方程式:
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇燃烧生成液态水的热化学方程式: (3)下表是部分化学键的键能数据,已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=

| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | c | x |
上述反应热效应之间的关系式为ΔH4=
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)
 CH3OH(g) ΔH1,②CO2(g)+3H2(g)
CH3OH(g) ΔH1,②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2,③CO2(g)+H2(g)
CH3OH(g)+H2O(g) ΔH2,③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,
CO(g)+H2O(g) ΔH3,已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
(6)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为 kJ。
(7)碘可用作心脏起搏器电源——锂碘电池的材料。该电池反应为:2Li(s)+I2(s)=2LiI(s) ΔH ,已知:4Li(s)+O2(g)=2Li2O(s) ΔH1,4LiI(s)+O2(g)=2I2(s)+2Li2O(s) ΔH2,则电池反应的ΔH=
您最近一年使用:0次
8 . 化学反应中的热效应又称反应热,包括燃烧热、中和热等,其数据广泛应用于科学研究和工业生产方面。
(1)若 石墨完全燃烧放出的热量为
石墨完全燃烧放出的热量为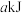 ,则石墨完全燃烧的热化学方程式为
,则石墨完全燃烧的热化学方程式为___________ 。
(2)利用如图所示装置测定中和反应的反应热的实验步骤如下:①用量筒量取 盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取
盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取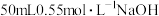 溶液,测出
溶液,测出 溶液温度;③将
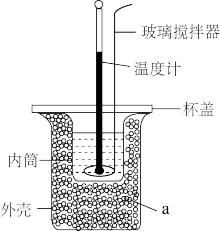
溶液温度;③将 溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是
溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是___________ ,上述实验步骤中一处不合理的操作应改成___________ 。假设盐酸和氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容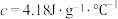 。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
___________  (保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热
(保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热
___________ (“偏大”“偏小”或“相等”)。
(3)键能指 气态分子解离为气态原子所需的能量。已知
气态分子解离为气态原子所需的能量。已知 ,其中H—H、O=O、O—H的键能依次为
,其中H—H、O=O、O—H的键能依次为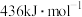 、
、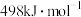 、
、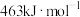 ,又知
,又知
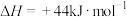 ,则氢气的燃烧热
,则氢气的燃烧热
___________ 。
(1)若
 石墨完全燃烧放出的热量为
石墨完全燃烧放出的热量为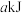 ,则石墨完全燃烧的热化学方程式为
,则石墨完全燃烧的热化学方程式为(2)利用如图所示装置测定中和反应的反应热的实验步骤如下:①用量筒量取
 盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取
盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取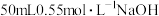 溶液,测出
溶液,测出 溶液温度;③将
溶液温度;③将 溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是
溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容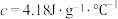 。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热
 (保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热
(保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热

(3)键能指
 气态分子解离为气态原子所需的能量。已知
气态分子解离为气态原子所需的能量。已知 ,其中H—H、O=O、O—H的键能依次为
,其中H—H、O=O、O—H的键能依次为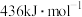 、
、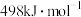 、
、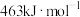 ,又知
,又知
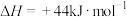 ,则氢气的燃烧热
,则氢气的燃烧热
您最近一年使用:0次
9 . 用图中装置测定中和反应热的测定步骤如下:
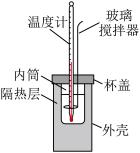
I.测量反应物的温度。
①用量筒量取50mL 盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL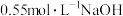 溶液,用温度计测量并记录NaOH溶液的温度。
溶液,用温度计测量并记录NaOH溶液的温度。
Ⅱ.测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度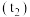 。
。
Ⅲ.重复测定2次,数据记录见下表。
注:稀盐酸和稀碱密度近似为 混合液的比热容为:4.18J/(g·℃)
混合液的比热容为:4.18J/(g·℃)
完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是___________ 。
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值___________ (填“偏大”“不变”或“偏小”,下同);反应后NaOH剩余,测得反应热的数值___________ 。
(3)计算此反应的反应热的数值Q=___________ KJ,写出中和热(生成1mol )的热化学反应方程式
)的热化学反应方程式___________ 。
(4)所有的操作和计算均无误,并忽略散发到量热计外的热量,按照此方法测得中和热的数值仍小于实际值,原因可能是___________ 。

I.测量反应物的温度。
①用量筒量取50mL
 盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL
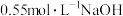 溶液,用温度计测量并记录NaOH溶液的温度。
溶液,用温度计测量并记录NaOH溶液的温度。Ⅱ.测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度
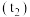 。
。Ⅲ.重复测定2次,数据记录见下表。
| 实验次数 | 反应物温度/℃ | 反应前体系温度 | 反应后体系温度 | 温度差 | |
| 盐酸 | NaOH溶液 |  /℃ /℃ |  /℃ /℃ |  /℃ /℃ | |
| 1 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 2 | 24.8 | 25.0 | 24.9 | 28.1 | 3.2 |
| 3 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
 混合液的比热容为:4.18J/(g·℃)
混合液的比热容为:4.18J/(g·℃)完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值
(3)计算此反应的反应热的数值Q=
 )的热化学反应方程式
)的热化学反应方程式(4)所有的操作和计算均无误,并忽略散发到量热计外的热量,按照此方法测得中和热的数值仍小于实际值,原因可能是
您最近一年使用:0次
名校
10 . 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将100 mL 0.50 mol·L-1盐酸与100 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:

(1)从实验装置上看,图中玻璃搅拌器的作用是___________ 。
(2)简易量热计如果不盖杯盖,生成1 mol H2O(l)时所测得中和反应的反应热(ΔH)将___________ (填“偏大”“偏小”或“不变”),判断的理由是___________ 。
(3)实验中改用80 mL 0.50 mol·L-1盐酸和80 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,二者所放出的热量___________ (填“相等”或“不相等”)。
(4)若用等体积等物质的量浓度的CH3COOH进行上述实验,生成1 mol H2O(l)时,所测得的中和反应的反应热的绝对值(|ΔH|)将___________ (填“偏大”“偏小”或“无影响”),判断的理由是___________ 。
(5)下列说法正确的是___________ (填字母)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1 mol H2O(l)时所测得的中和反应的反应热(ΔH)无影响

(1)从实验装置上看,图中玻璃搅拌器的作用是
(2)简易量热计如果不盖杯盖,生成1 mol H2O(l)时所测得中和反应的反应热(ΔH)将
(3)实验中改用80 mL 0.50 mol·L-1盐酸和80 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,二者所放出的热量
(4)若用等体积等物质的量浓度的CH3COOH进行上述实验,生成1 mol H2O(l)时,所测得的中和反应的反应热的绝对值(|ΔH|)将
(5)下列说法正确的是
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1 mol H2O(l)时所测得的中和反应的反应热(ΔH)无影响
您最近一年使用:0次



