真题
解题方法
1 . 白藜芦醇(化合物I)具有抗肿瘤、抗氧化、消炎等功效。以下是某课题组合成化合物I的路线。
(1)A中的官能团名称为_____ 。
(2)B的结构简式为_____ 。
(3)由C生成D的反应类型为_____ 。
(4)由E生成F的化学方程式为_____ 。
(5)已知G可以发生银镜反应,G的化学名称为_____ 。
(6)选用一种鉴别H和I的试剂并描述实验现象_____ 。
(7)I的同分异构体中,同时满足下列条件的共有_____ 种(不考虑立体异构)。
①含有手性碳(连有4个不同的原子或基团的碳为手性碳);
②含有两个苯环;③含有两个酚羟基;④可发生银镜反应。

(1)A中的官能团名称为
(2)B的结构简式为
(3)由C生成D的反应类型为
(4)由E生成F的化学方程式为
(5)已知G可以发生银镜反应,G的化学名称为
(6)选用一种鉴别H和I的试剂并描述实验现象
(7)I的同分异构体中,同时满足下列条件的共有
①含有手性碳(连有4个不同的原子或基团的碳为手性碳);
②含有两个苯环;③含有两个酚羟基;④可发生银镜反应。
您最近一年使用:0次
真题
解题方法
2 . 化合物1是一种药物中间体,可由下列路线合成( 代表苯基,部分反应条件略去):
代表苯基,部分反应条件略去):_______ 、_______ 。
(2)E在一定条件下还原得到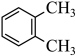 ,后者的化学名称为
,后者的化学名称为_______ 。
(3)H的结构简式为_______ 。
(4)E→F反应中、下列物质不能 用作反应溶剂的是_______ (填标号)。_______ 种(不考虑立体异构),写出其中一种同分异构体的结构简式_______ 。
①含有手性碳 ②含有2个碳碳三键 ③不含甲基
(6)参照上述合成路线,设计以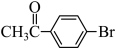 和不超过3个碳的有机物为原料,制备一种光刻胶单体
和不超过3个碳的有机物为原料,制备一种光刻胶单体 的合成路线
的合成路线_______ (其他试剂任选)。
 代表苯基,部分反应条件略去):
代表苯基,部分反应条件略去):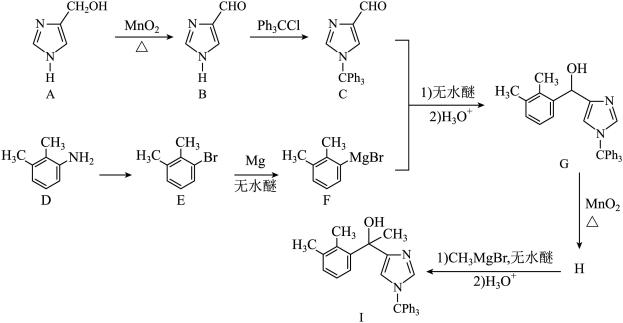
i) 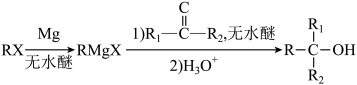
ii)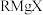 易与含活泼氢化合物(
易与含活泼氢化合物(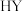 )反应:
)反应:
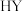 代表
代表 、
、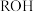 、
、 、
、 等。
等。
(2)E在一定条件下还原得到
 ,后者的化学名称为
,后者的化学名称为(3)H的结构简式为
(4)E→F反应中、下列物质
a. b.
b.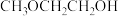 c.
c. 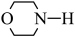 d.
d.
①含有手性碳 ②含有2个碳碳三键 ③不含甲基
(6)参照上述合成路线,设计以
 和不超过3个碳的有机物为原料,制备一种光刻胶单体
和不超过3个碳的有机物为原料,制备一种光刻胶单体 的合成路线
的合成路线
您最近一年使用:0次
真题
解题方法
3 . 铍用于宇航器件的构筑。一种从其铝硅酸盐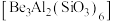 中提取铍的路径为:
中提取铍的路径为: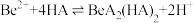
回答下列问题:
(1)基态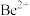 的轨道表示式为
的轨道表示式为_______ 。
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是_______ 。
(3)“萃取分液”的目的是分离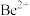 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是_______ 。
(4)写出反萃取生成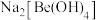 的化学方程式
的化学方程式_______ 。“滤液2”可以进入_______ 步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_______ 。
(6) 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为_______ 。
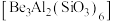 中提取铍的路径为:
中提取铍的路径为: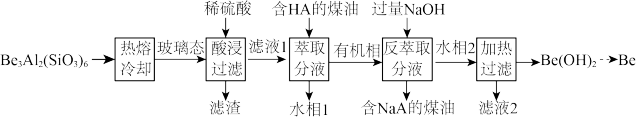
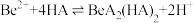
回答下列问题:
(1)基态
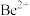 的轨道表示式为
的轨道表示式为(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3)“萃取分液”的目的是分离
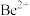 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是(4)写出反萃取生成
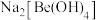 的化学方程式
的化学方程式(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6)
 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为
您最近一年使用:0次
4 . 钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。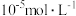 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。
已知:①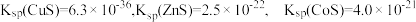 。
。
②以氢氧化物形式沉淀时,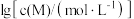 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是_____ 。
(2)“酸浸”步骤中, 发生反应的化学方程式是
发生反应的化学方程式是_____ 。
(3)假设“沉铜”后得到的滤液中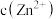 和
和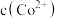 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中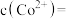
_____  ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离_____ (填“能”或“不能”)。
(4)“沉锰”步骤中,生成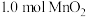 ,产生
,产生 的物质的量为
的物质的量为_____ 。
(5)“沉淀”步骤中,用 调
调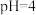 ,分离出的滤渣是
,分离出的滤渣是_____ 。
(6)“沉钴”步骤中,控制溶液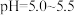 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为_____ 。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____ 。
 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
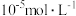 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。已知:①
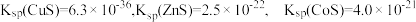 。
。②以氢氧化物形式沉淀时,
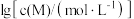 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是
(2)“酸浸”步骤中,
 发生反应的化学方程式是
发生反应的化学方程式是(3)假设“沉铜”后得到的滤液中
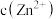 和
和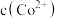 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中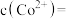
 ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离(4)“沉锰”步骤中,生成
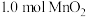 ,产生
,产生 的物质的量为
的物质的量为(5)“沉淀”步骤中,用
 调
调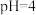 ,分离出的滤渣是
,分离出的滤渣是(6)“沉钴”步骤中,控制溶液
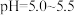 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是
您最近一年使用:0次
真题
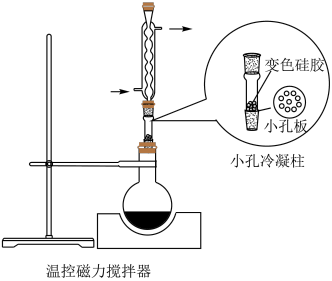
5 . 某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下: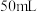 烧瓶中分别加入
烧瓶中分别加入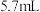 乙酸(
乙酸(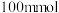 )、
)、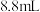 乙醇(
乙醇(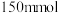 )、
)、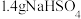 固体及4~6滴
固体及4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
II.加热回流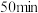 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
III.冷却后,向烧瓶中缓慢加入饱和 溶液至无
溶液至无 逸出,分离出有机相。
逸出,分离出有机相。
IV.洗涤有机相后,加入无水 ,过滤。
,过滤。
V.蒸馏滤液,收集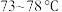 馏分,得无色液体
馏分,得无色液体 ,色谱检测纯度为
,色谱检测纯度为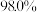 。
。
回答下列问题:
(1) 在反应中起
在反应中起_______ 作用,用其代替浓 的优点是
的优点是_______ (答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可_______ 。
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是_______ (填名称)。_______ (精确至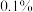 )。
)。
(6)若改用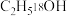 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为_______ (精确至1)。
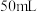 烧瓶中分别加入
烧瓶中分别加入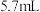 乙酸(
乙酸(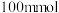 )、
)、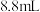 乙醇(
乙醇(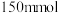 )、
)、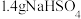 固体及4~6滴
固体及4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。II.加热回流
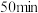 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。III.冷却后,向烧瓶中缓慢加入饱和
 溶液至无
溶液至无 逸出,分离出有机相。
逸出,分离出有机相。IV.洗涤有机相后,加入无水
 ,过滤。
,过滤。V.蒸馏滤液,收集
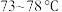 馏分,得无色液体
馏分,得无色液体 ,色谱检测纯度为
,色谱检测纯度为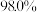 。
。回答下列问题:
(1)
 在反应中起
在反应中起 的优点是
的优点是(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
| A.无需分离 | B.增大该反应平衡常数 |
| C.起到沸石作用,防止暴沸 | D.不影响甲基紫指示反应进程 |
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是
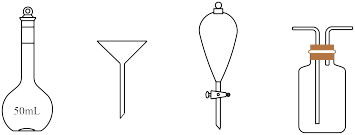
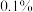 )。
)。(6)若改用
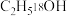 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
您最近一年使用:0次
7日内更新
|
1865次组卷
|
4卷引用:2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)
真题
解题方法
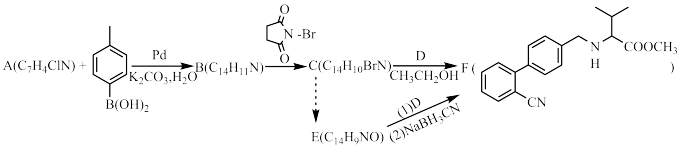
6 . 心血管药物缬沙坦中间体(F)的两条合成路线如下:
回答下列问题:
(1)A结构简式为_______ ;B→C反应类型为_______ 。
(2)C+D→F化学方程式为_______ 。
(3)E中含氧官能团名称为_______ ;F中手性碳原子有_______ 个。
(4)D的一种同分异构体含硝基和3种不同化学环境的氢原子(个数此为 ),其结构简式为
),其结构简式为_______ 。
(5)C→E的合成路线设计如下:
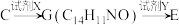
试剂X为_______ (填化学式);试剂Y不能选用 ,原因是
,原因是_______ 。
I.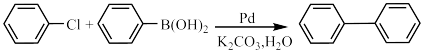

回答下列问题:
(1)A结构简式为
(2)C+D→F化学方程式为
(3)E中含氧官能团名称为
(4)D的一种同分异构体含硝基和3种不同化学环境的氢原子(个数此为
 ),其结构简式为
),其结构简式为(5)C→E的合成路线设计如下:
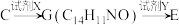
试剂X为
 ,原因是
,原因是
您最近一年使用:0次
真题
解题方法
7 . 以铅精矿(含 ,
, 等)为主要原料提取金属
等)为主要原料提取金属 和
和 的工艺流程如下:
的工艺流程如下:
(1)“热浸”时,难溶的 和
和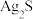 转化为
转化为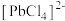 和
和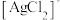 及单质硫。溶解等物质的量的
及单质硫。溶解等物质的量的 和
和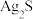 时,消耗
时,消耗 物质的量之比为
物质的量之比为_______ ;溶液中盐酸浓度不宜过大,除防止“热浸”时 挥发外,另一目的是防止产生
挥发外,另一目的是防止产生_______ (填化学式)。
(2)将“过滤Ⅱ”得到的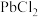 沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属
沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属 “电解I”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为
“电解I”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为_______ 。
(3)“还原”中加入铅精矿的目的是_______ 。
(4)“置换”中可选用的试剂X为_______ (填标号)。
A. B.
B. C.
C. D.
D.
“置换”反应的离子方程式为_______ 。
(5)“电解II”中将富银铅泥制成电极板,用作_______ (填“阴极”或“阳极”)。
 ,
,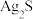 等)为主要原料提取金属
等)为主要原料提取金属 和
和 的工艺流程如下:
的工艺流程如下: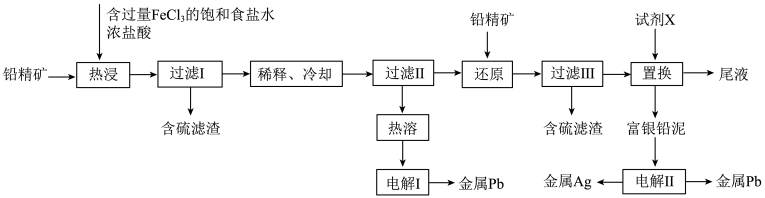
(1)“热浸”时,难溶的
 和
和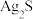 转化为
转化为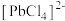 和
和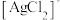 及单质硫。溶解等物质的量的
及单质硫。溶解等物质的量的 和
和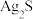 时,消耗
时,消耗 物质的量之比为
物质的量之比为 挥发外,另一目的是防止产生
挥发外,另一目的是防止产生(2)将“过滤Ⅱ”得到的
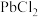 沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属
沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属 “电解I”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为
“电解I”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为(3)“还原”中加入铅精矿的目的是
(4)“置换”中可选用的试剂X为
A.
 B.
B. C.
C. D.
D.
“置换”反应的离子方程式为
(5)“电解II”中将富银铅泥制成电极板,用作
您最近一年使用:0次
真题
8 . 水煤气是 的主要来源,研究
的主要来源,研究 对
对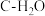 体系制
体系制 的影响,涉及主要反应如下:
的影响,涉及主要反应如下:
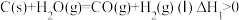

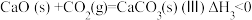
回答列问题:
(1)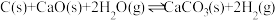 的焓变
的焓变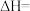
_______ (用代数式表示)。
(2)压力p下,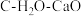 体系达平衡后,图示温度范围内
体系达平衡后,图示温度范围内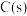 已完全反应,
已完全反应, 在
在 温度时完全分解。气相中
温度时完全分解。气相中 ,
, 和
和 摩尔分数随温度的变化关系如图所示,则a线对应物种为
摩尔分数随温度的变化关系如图所示,则a线对应物种为_______ (填化学式)。当温度高于 时,随温度升高c线对应物种摩尔分数逐渐降低的原因是
时,随温度升高c线对应物种摩尔分数逐渐降低的原因是_______ 。 时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应
时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应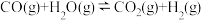 的平衡常数
的平衡常数
_______ ;此时气体总物质的量为 ,则
,则 的物质的量为
的物质的量为_______  ;若向平衡体系中通入少量
;若向平衡体系中通入少量 ,重新达平衡后,分压
,重新达平衡后,分压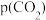 将
将_______ (填“增大”“减小”或“不变”),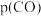 将
将_______ (填“增大”“减小”或“不变”)。
 的主要来源,研究
的主要来源,研究 对
对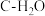 体系制
体系制 的影响,涉及主要反应如下:
的影响,涉及主要反应如下: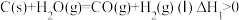

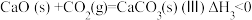
回答列问题:
(1)
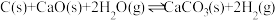 的焓变
的焓变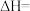
(2)压力p下,
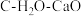 体系达平衡后,图示温度范围内
体系达平衡后,图示温度范围内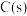 已完全反应,
已完全反应, 在
在 温度时完全分解。气相中
温度时完全分解。气相中 ,
, 和
和 摩尔分数随温度的变化关系如图所示,则a线对应物种为
摩尔分数随温度的变化关系如图所示,则a线对应物种为 时,随温度升高c线对应物种摩尔分数逐渐降低的原因是
时,随温度升高c线对应物种摩尔分数逐渐降低的原因是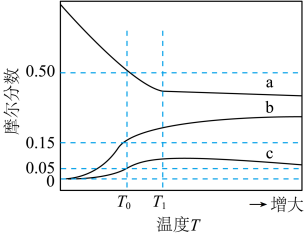
 时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应
时,图示三种气体的摩尔分数分别为0.50,0.15,0.05,则反应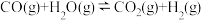 的平衡常数
的平衡常数
 ,则
,则 的物质的量为
的物质的量为 ;若向平衡体系中通入少量
;若向平衡体系中通入少量 ,重新达平衡后,分压
,重新达平衡后,分压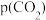 将
将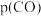 将
将
您最近一年使用:0次
真题
解题方法
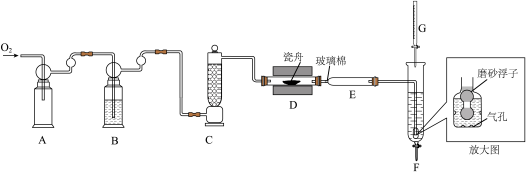
9 . 利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
①加样,将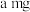 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装
样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装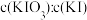 略小于
略小于 的
的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量
碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量 碱性标准溶液,发生反应:
碱性标准溶液,发生反应: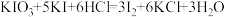 ,使溶液显浅蓝色。
,使溶液显浅蓝色。
②燃烧:按一定流速通入 ,一段时间后,加热并使样品燃烧。
,一段时间后,加热并使样品燃烧。
③滴定:当F内溶液浅蓝色消退时(发生反应: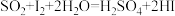 ),立即用
),立即用 碱性标准溶液滴定至浅蓝色复现。随
碱性标准溶液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
回答下列问题:
(1)取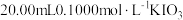 的碱性溶液和一定量的
的碱性溶液和一定量的 固体,配制
固体,配制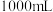
 碱性标准溶液,下列仪器必须用到的是_______(填标号)。
碱性标准溶液,下列仪器必须用到的是_______(填标号)。
(2)装置B和C的作用是充分干燥 ,B中的试剂为
,B中的试剂为_______ 。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子(见放大图),目的是_______ 。
(3)该滴定实验达终点的现象是_______ ;滴定消耗 碱性标准溶液
碱性标准溶液 ,样品中硫的质量分数是
,样品中硫的质量分数是_______ (用代数式表示)。
(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进 的生成,粉尘在该过程中的作用是
的生成,粉尘在该过程中的作用是_______ ;若装置E冷却气体不充分,可能导致测定结果偏大,原因是_______ ;若滴定过程中,有少量 不经
不经 直接将
直接将 氧化成
氧化成 ,测定结果会
,测定结果会_______ (填“偏大”“偏小”或“不变”)。
①加样,将
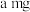 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装
样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装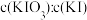 略小于
略小于 的
的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量
碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量 碱性标准溶液,发生反应:
碱性标准溶液,发生反应: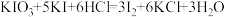 ,使溶液显浅蓝色。
,使溶液显浅蓝色。②燃烧:按一定流速通入
 ,一段时间后,加热并使样品燃烧。
,一段时间后,加热并使样品燃烧。③滴定:当F内溶液浅蓝色消退时(发生反应:
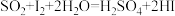 ),立即用
),立即用 碱性标准溶液滴定至浅蓝色复现。随
碱性标准溶液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。回答下列问题:
(1)取
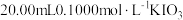 的碱性溶液和一定量的
的碱性溶液和一定量的 固体,配制
固体,配制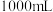
 碱性标准溶液,下列仪器必须用到的是_______(填标号)。
碱性标准溶液,下列仪器必须用到的是_______(填标号)。| A.玻璃棒 | B. 锥形瓶 锥形瓶 | C. 容量瓶 容量瓶 | D.胶头滴管 |
(2)装置B和C的作用是充分干燥
 ,B中的试剂为
,B中的试剂为(3)该滴定实验达终点的现象是
 碱性标准溶液
碱性标准溶液 ,样品中硫的质量分数是
,样品中硫的质量分数是(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进
 的生成,粉尘在该过程中的作用是
的生成,粉尘在该过程中的作用是 不经
不经 直接将
直接将 氧化成
氧化成 ,测定结果会
,测定结果会
您最近一年使用:0次
真题
解题方法
10 . 锰氧化物具有较大应用价值,回答下列问题:
(1) 在元素周期表中位于第
在元素周期表中位于第_______ 周期_______ 族;同周期中,基态原子未成对电子数比 多的元素是
多的元素是_______ (填元素符号)。
(2) 如某种氧化物
如某种氧化物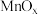 的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为
的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为_______ 。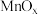 晶体有O原子脱出时,出现O空位,
晶体有O原子脱出时,出现O空位, 的化合价
的化合价_______ (填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是_______ (填标号)。
A. B.
B. C.
C. D.
D.
(3)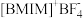 (见图)是
(见图)是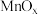 晶型转变的诱导剂。
晶型转变的诱导剂。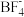 的空间构型为
的空间构型为_______ ;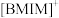 中咪唑环存在
中咪唑环存在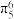 大
大 键,则N原子采取的轨道杂化方式为
键,则N原子采取的轨道杂化方式为_______ 。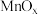 可作
可作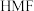 转化为
转化为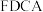 的催化剂(见下图)。
的催化剂(见下图)。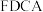 的熔点远大于
的熔点远大于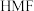 ,除相对分子质量存在差异外,另一重要原因是
,除相对分子质量存在差异外,另一重要原因是_______ 。
(1)
 在元素周期表中位于第
在元素周期表中位于第 多的元素是
多的元素是(2)
 如某种氧化物
如某种氧化物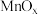 的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为
的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为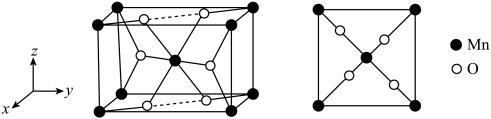
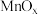 晶体有O原子脱出时,出现O空位,
晶体有O原子脱出时,出现O空位, 的化合价
的化合价A.
 B.
B. C.
C. D.
D.
(3)
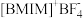 (见图)是
(见图)是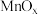 晶型转变的诱导剂。
晶型转变的诱导剂。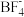 的空间构型为
的空间构型为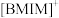 中咪唑环存在
中咪唑环存在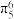 大
大 键,则N原子采取的轨道杂化方式为
键,则N原子采取的轨道杂化方式为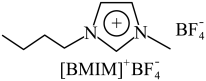
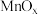 可作
可作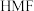 转化为
转化为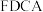 的催化剂(见下图)。
的催化剂(见下图)。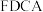 的熔点远大于
的熔点远大于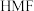 ,除相对分子质量存在差异外,另一重要原因是
,除相对分子质量存在差异外,另一重要原因是
您最近一年使用:0次



