2024高三·全国·专题练习
1 . 请回答下列问题:
(1)在化学分析中采用K2CrO4作指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO 生成砖红色沉淀指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为
生成砖红色沉淀指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为___________ mol·L-1,此时溶液中c(CrO )等于
)等于___________ mol·L-1(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(2)一定温度下,将0.1 mol AgCl固体加入1 L 0.1 mol·L-1 Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,沉淀转化反应2AgCl(s)+CO (aq)
(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为
Ag2CO3(s)+2Cl-(aq)的平衡常数为___________ 。
(3)在T ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知T ℃时AgCl的Ksp=4×10-10,在T ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数约为
AgBr(s)+Cl-(aq)的平衡常数约为___________ 。
(1)在化学分析中采用K2CrO4作指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO
 生成砖红色沉淀指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为
生成砖红色沉淀指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为 )等于
)等于(2)一定温度下,将0.1 mol AgCl固体加入1 L 0.1 mol·L-1 Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,沉淀转化反应2AgCl(s)+CO
 (aq)
(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为
Ag2CO3(s)+2Cl-(aq)的平衡常数为(3)在T ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知T ℃时AgCl的Ksp=4×10-10,在T ℃时,AgCl(s)+Br-(aq)
 AgBr(s)+Cl-(aq)的平衡常数约为
AgBr(s)+Cl-(aq)的平衡常数约为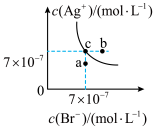
您最近一年使用:0次
2 . 在2 L恒容密闭容器中充入4 mol CO和4 mol NO,发生反应2NO(g)+2CO(g) N2(g)+2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
N2(g)+2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。___________ ;若C点在10 min达到平衡,则10 min内CO的平均反应速率为___________ 。
(2)若用物质的量分数代替平衡浓度,则C点时平衡常数Kx的计算式为___________ 。
(3)若起始容器内压强为p Pa,则C点时该反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 N2(g)+2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
N2(g)+2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。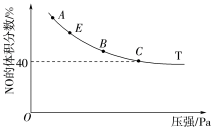
(2)若用物质的量分数代替平衡浓度,则C点时平衡常数Kx的计算式为
(3)若起始容器内压强为p Pa,则C点时该反应的平衡常数Kp=
您最近一年使用:0次
2024高三·江苏·专题练习
解题方法
3 . 计算
(1)已知:
反应Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49kJ/mol;
反应Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41kJ/mol;
则反应Ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=_______ kJ/mol。
(2)已知:
反应Ⅰ.CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.6kJ/mol
反应Ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2kJ/mol
则反应Ⅲ.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=_______ kJ/mol。
(3)已知:
C(s)的燃烧热为393.5kJ/mol,CO(g)的燃烧热为283kJ/mol。
反应Ⅰ.TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH1
反应Ⅱ.TiCl4(g)+O2(g)=TiO2(s)+2Cl2(g) ΔH2=-172kJ/mol
则反应Ⅰ的ΔH1=_______ kJ/mol。
(4)已知:
①C2H5OH(g)+H2S(g)=C2H5SH(g)+H2O(g) ΔH1=-32kJ/mol
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277kJ/mol
③2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH3=-1036kJ/mol
则④2C2H5SH(g)+9O2(g)=4CO2(g)+6H2O(g)+2SO2(g)的ΔH4=_______ kJ/mol。
(1)已知:
反应Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49kJ/mol;
反应Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41kJ/mol;
则反应Ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=
(2)已知:
反应Ⅰ.CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.6kJ/mol
反应Ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2kJ/mol
则反应Ⅲ.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=
(3)已知:
C(s)的燃烧热为393.5kJ/mol,CO(g)的燃烧热为283kJ/mol。
反应Ⅰ.TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH1
反应Ⅱ.TiCl4(g)+O2(g)=TiO2(s)+2Cl2(g) ΔH2=-172kJ/mol
则反应Ⅰ的ΔH1=
(4)已知:
①C2H5OH(g)+H2S(g)=C2H5SH(g)+H2O(g) ΔH1=-32kJ/mol
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277kJ/mol
③2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH3=-1036kJ/mol
则④2C2H5SH(g)+9O2(g)=4CO2(g)+6H2O(g)+2SO2(g)的ΔH4=
您最近一年使用:0次
2024高三·江苏·专题练习
4 . 磷酸锰铵是重要的复盐,在工农业生产中具有广泛应用。
为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.4480g,加水溶解后配成100.00mL溶液A;②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成NH30.06720L(标准状况);③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O40.2290g。通过计算确定该样品的化学式(写出计算过程)_____ 。
为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.4480g,加水溶解后配成100.00mL溶液A;②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成NH30.06720L(标准状况);③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O40.2290g。通过计算确定该样品的化学式(写出计算过程)
您最近一年使用:0次
2024高三·江苏·专题练习
5 . 碱式硫酸铝溶液[(1-x)Al2(SO4)3·xAl(OH)3]可用于烟气脱硫。通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300g。
②取碱式硫酸铝溶液2.50mL,稀释至25mL,加入0.1000mol·L-1EDTA标准溶液25.00mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000mol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)_____ 。
①取碱式硫酸铝溶液25.00mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300g。
②取碱式硫酸铝溶液2.50mL,稀释至25mL,加入0.1000mol·L-1EDTA标准溶液25.00mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000mol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)
您最近一年使用:0次
2024高三·江苏·专题练习
6 . 测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00mL碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000mol·L-1硫酸亚铁标准溶液30.00mL,充分反应后,用0.01000mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000mol·L-1硫酸亚铁标准溶液30.00mL,充分反应后,用0.01000mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00mL。计算样品中NaClO3的含量
被还原为Cr3+),消耗该溶液20.00mL。计算样品中NaClO3的含量_____ (以g·L-1表示,写出计算过程)。
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000mol·L-1硫酸亚铁标准溶液30.00mL,充分反应后,用0.01000mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000mol·L-1硫酸亚铁标准溶液30.00mL,充分反应后,用0.01000mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00mL。计算样品中NaClO3的含量
被还原为Cr3+),消耗该溶液20.00mL。计算样品中NaClO3的含量
您最近一年使用:0次
2024高三·江苏·专题练习
7 . 二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理如下:
C3N3O3Cl +H++2H2O=C3H3N3O3+2HClO
+H++2H2O=C3H3N3O3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O =
= +2I-
+2I-
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品_____ 。(写出计算过程,该样品的有效氯=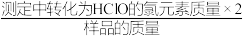 ×100%)
×100%)
C3N3O3Cl
 +H++2H2O=C3H3N3O3+2HClO
+H++2H2O=C3H3N3O3+2HClOHClO+2I-+H+=I2+Cl-+H2O
I2+2S2O
 =
= +2I-
+2I-准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品
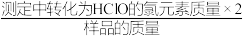 ×100%)
×100%)
您最近一年使用:0次
2024高三·江苏·专题练习
解题方法
8 . 以软锰矿浆(主要成分为MnO2,杂质为Fe、Al等元素的氧化物)和烟气(含有SO2、O2等)为原料可制备Mn2O3.实验过程如下:
①向一定量软锰矿浆中匀速通入烟气,向吸收后的混合溶液中滴加氨水,调节pH进行除杂,向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀。
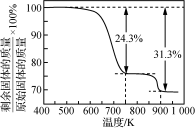
②在氧气气氛中加热分解MnCO3,测得加热升温过程中固体的质量变化如图所示。加热分解MnCO3制备Mn2O3,需要控制的温度为多少_____ 。(写出计算推理过程)
①向一定量软锰矿浆中匀速通入烟气,向吸收后的混合溶液中滴加氨水,调节pH进行除杂,向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀。
②在氧气气氛中加热分解MnCO3,测得加热升温过程中固体的质量变化如图所示。加热分解MnCO3制备Mn2O3,需要控制的温度为多少
您最近一年使用:0次
2024高三·江苏·专题练习
解题方法
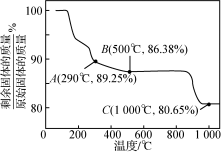
9 . Co(OH)2在空气中加热时,固体残留率随温度的变化如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水。计算并分析A、B、C点物质的化学式_____ 。
您最近一年使用:0次
2024高三·江苏·专题练习
解题方法
10 . 某硫酸厂用FeS2的质量分数为60%的黄铁矿4000t生产硫酸,若在沸腾炉内(反应:FeS2+O2 Fe2O3+SO2,反应未配平)损失5%的硫,SO2制SO3时的转化率为90%,则能生产98%的浓硫酸多少吨
Fe2O3+SO2,反应未配平)损失5%的硫,SO2制SO3时的转化率为90%,则能生产98%的浓硫酸多少吨_____ ?
 Fe2O3+SO2,反应未配平)损失5%的硫,SO2制SO3时的转化率为90%,则能生产98%的浓硫酸多少吨
Fe2O3+SO2,反应未配平)损失5%的硫,SO2制SO3时的转化率为90%,则能生产98%的浓硫酸多少吨
您最近一年使用:0次



