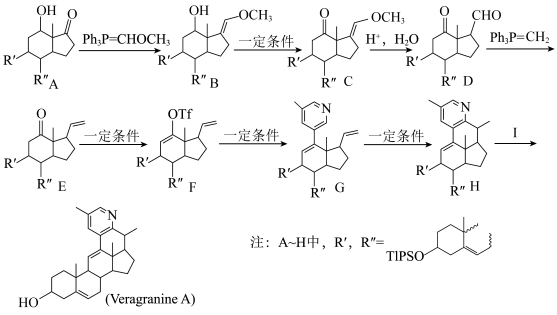
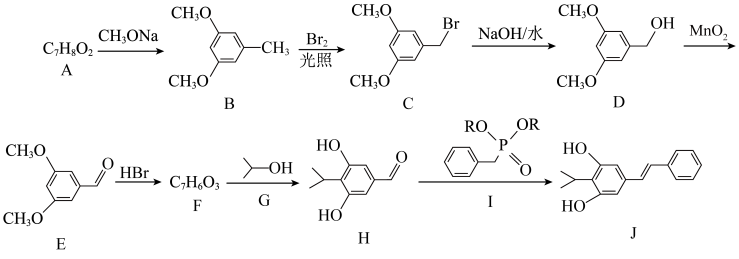
1 . Veragranine A是治疗骨关节疼痛的药物,一种合成路线如图(Ph为苯基,略去部分试剂和条件,忽略立体化学)。
(1)化合物B生成C的反应类型是_______ 。
(2)化合物C到D的反应中,另一产物的结构简式为_______ 。
(3)合成路线中化合物D发生反应的官能团名称为_______ 。可用于检验该官能团的试剂为_______ (填序号)。
①银氨溶液 ②氯化铁溶液 ③新制氢氧化铜溶液
(4)化合物G和H的质谱图中分子离子峰的质荷比数值相同,它们互为_______ 。
(5)化合物I是一种类似氯化铵的盐,分子式为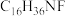 ,核磁共振氢谱有四组峰,峰面积比为
,核磁共振氢谱有四组峰,峰面积比为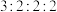 ,结构简式为
,结构简式为_______ 。
(6)Veragranine A中手性碳原子的个数为_______ 。
(7)结合上述合成路线和所学知识,设计以甲苯和 为原料合成
为原料合成 的路线
的路线_______ (无机试剂任选)。
(1)化合物B生成C的反应类型是
(2)化合物C到D的反应中,另一产物的结构简式为
(3)合成路线中化合物D发生反应的官能团名称为
①银氨溶液 ②氯化铁溶液 ③新制氢氧化铜溶液
(4)化合物G和H的质谱图中分子离子峰的质荷比数值相同,它们互为
(5)化合物I是一种类似氯化铵的盐,分子式为
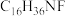 ,核磁共振氢谱有四组峰,峰面积比为
,核磁共振氢谱有四组峰,峰面积比为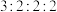 ,结构简式为
,结构简式为(6)Veragranine A中手性碳原子的个数为
(7)结合上述合成路线和所学知识,设计以甲苯和
 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
解题方法
2 . 以废铁屑(主要成分为Fe及少量 ,还有油污、磷、硫等杂质)为原料制备硫酸亚铁铵晶体,生成
,还有油污、磷、硫等杂质)为原料制备硫酸亚铁铵晶体,生成 的反应为
的反应为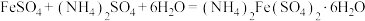 ,具体步骤如下:
,具体步骤如下:
Ⅰ.在废铁屑中加入 溶液,水浴加热。
溶液,水浴加热。
Ⅱ.洗涤废铁屑,加入过量稀 ,加热至充分反应(装置如图)。
,加热至充分反应(装置如图)。
Ⅳ.将饱和硫酸铵溶液加入上述滤液中,加热搅拌。
Ⅴ.将Ⅳ中所得溶液经一系列操作制得硫酸亚铁铵晶体。
回答下列问题:
(1)仪器a的名称为_______ 。
(2)步骤Ⅰ中 溶液的主要作用是
溶液的主要作用是_______ 。
(3)步骤Ⅱ中与Fe元素相关的反应,除 外,还有
外,还有_______ 、_______ (用离子方程式表示)。
(4)装置B的作用是_______ 。
(5)步骤Ⅴ中一系列操作指_______ 、_______ 、过滤、洗涤、干燥。
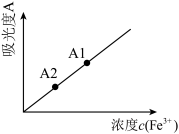
(6)图为硫酸亚铁铵晶体的局部结构示意图,所缺微粒Y的化学式为_______ 。 与
与 反应生成有色配合物来检验
反应生成有色配合物来检验 含量,配合物溶液颜色越深,吸光度越大。将质量相同的两份产品S1和S2配成体积相同的溶液,吸光度分别为A1和A2(如图),则产品的纯度:S1
含量,配合物溶液颜色越深,吸光度越大。将质量相同的两份产品S1和S2配成体积相同的溶液,吸光度分别为A1和A2(如图),则产品的纯度:S1_______ S2(填“ ”或“
”或“ ”)。
”)。 的含量,其离子方程式如下:
的含量,其离子方程式如下: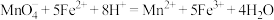 ,准确称取产品1.6000g,配成100.00mL溶液。移取该溶液25.00mL,用
,准确称取产品1.6000g,配成100.00mL溶液。移取该溶液25.00mL,用 酸性
酸性 溶液滴定,消耗
溶液滴定,消耗 溶液的体积为20.00mL,则产品中
溶液的体积为20.00mL,则产品中 的含量为
的含量为_______ %(已知: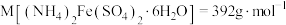 )。
)。
 ,还有油污、磷、硫等杂质)为原料制备硫酸亚铁铵晶体,生成
,还有油污、磷、硫等杂质)为原料制备硫酸亚铁铵晶体,生成 的反应为
的反应为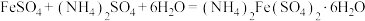 ,具体步骤如下:
,具体步骤如下:Ⅰ.在废铁屑中加入
 溶液,水浴加热。
溶液,水浴加热。Ⅱ.洗涤废铁屑,加入过量稀
 ,加热至充分反应(装置如图)。
,加热至充分反应(装置如图)。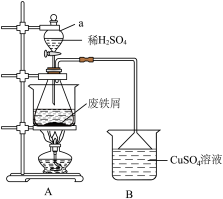
Ⅳ.将饱和硫酸铵溶液加入上述滤液中,加热搅拌。
Ⅴ.将Ⅳ中所得溶液经一系列操作制得硫酸亚铁铵晶体。
回答下列问题:
(1)仪器a的名称为
(2)步骤Ⅰ中
 溶液的主要作用是
溶液的主要作用是(3)步骤Ⅱ中与Fe元素相关的反应,除
 外,还有
外,还有(4)装置B的作用是
(5)步骤Ⅴ中一系列操作指
(6)图为硫酸亚铁铵晶体的局部结构示意图,所缺微粒Y的化学式为

 与
与 反应生成有色配合物来检验
反应生成有色配合物来检验 含量,配合物溶液颜色越深,吸光度越大。将质量相同的两份产品S1和S2配成体积相同的溶液,吸光度分别为A1和A2(如图),则产品的纯度:S1
含量,配合物溶液颜色越深,吸光度越大。将质量相同的两份产品S1和S2配成体积相同的溶液,吸光度分别为A1和A2(如图),则产品的纯度:S1 ”或“
”或“ ”)。
”)。
 的含量,其离子方程式如下:
的含量,其离子方程式如下: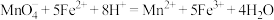 ,准确称取产品1.6000g,配成100.00mL溶液。移取该溶液25.00mL,用
,准确称取产品1.6000g,配成100.00mL溶液。移取该溶液25.00mL,用 酸性
酸性 溶液滴定,消耗
溶液滴定,消耗 溶液的体积为20.00mL,则产品中
溶液的体积为20.00mL,则产品中 的含量为
的含量为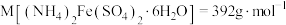 )。
)。
您最近一年使用:0次
3 . 铜冶炼是“有色金属王国”云南省的重要产业。铜电解精炼产生的阳极泥是提取Cu、Ag、Au等金属的原料之一,阳极泥中的As主要以 形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图:
形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图:
(1)As与N同族,其基态原子的价层电子排布式为_______ 。
(2)“操作X”为_______ 。
(3)“加热氧化”中,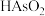 转化为
转化为 (结构如图),As的杂化类型由
(结构如图),As的杂化类型由_______ 转变为_______ 。
①发生的化学反应为__________ 。
_______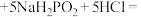 _______
_______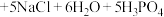
②As产率随还原温度变化如图,当温度达到_______ ℃时,As产率最高。_______ g 。[已知:
。[已知: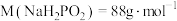 ]
]
(5)工艺中可循环利用的物质为_______ (写出一种即可)。
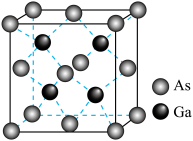
(6)砷化镓是一种半导体材料,晶胞结构示意图如图。_______ 。
②砷化镓晶胞体积为 ,晶体密度
,晶体密度
_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图:
形式存在,对金属提取和废水达标排放都会产生影响,需预先分离脱除。一种从铜阳极泥中分离As的工艺流程如图: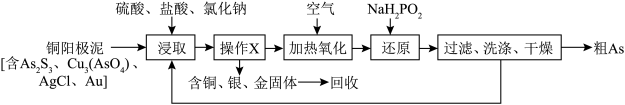
(1)As与N同族,其基态原子的价层电子排布式为
(2)“操作X”为
(3)“加热氧化”中,
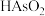 转化为
转化为 (结构如图),As的杂化类型由
(结构如图),As的杂化类型由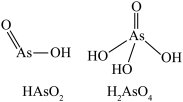
①发生的化学反应为
_______
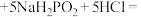 _______
_______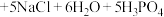
②As产率随还原温度变化如图,当温度达到

 。[已知:
。[已知: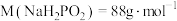 ]
](5)工艺中可循环利用的物质为
(6)砷化镓是一种半导体材料,晶胞结构示意图如图。
②砷化镓晶胞体积为
 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
4 . Ⅰ.请根据题意选择下列物质,并用其字母代号填空:
A.明矾[KAl(SO4)2] B.Ca(OH)2 C.NaHCO3 D.水玻璃
(1)要使焙制的糕点,松软可以添加________ 。
(2)要使含泥沙的水变澄清,可使用________ 。
(3)要中和钢铁厂,电镀厂产生的酸性废水可使用__________ 。
(4)可用作防火材料的是________ 。
Ⅱ.以化合价为纵坐标,物质类别为横坐标的图像称为“价—类”二维图。如图是氯元素的部分“价—类”二维图。
(5)工业上干燥的Cl2贮存在________ 中。
(6)Y的化学式为________ 。
(7)Cl2转化成Z和HCl的离子方程式为________________ 。
(8)将Cl2与SO2按1∶1通入紫色石蕊溶液中,现象为_________________ 。
A.明矾[KAl(SO4)2] B.Ca(OH)2 C.NaHCO3 D.水玻璃
(1)要使焙制的糕点,松软可以添加
(2)要使含泥沙的水变澄清,可使用
(3)要中和钢铁厂,电镀厂产生的酸性废水可使用
(4)可用作防火材料的是
Ⅱ.以化合价为纵坐标,物质类别为横坐标的图像称为“价—类”二维图。如图是氯元素的部分“价—类”二维图。
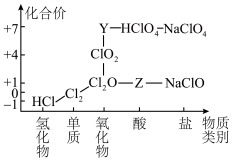
(5)工业上干燥的Cl2贮存在
(6)Y的化学式为
(7)Cl2转化成Z和HCl的离子方程式为
(8)将Cl2与SO2按1∶1通入紫色石蕊溶液中,现象为
您最近一年使用:0次
解题方法
5 . 学习小组在实验室中利用下图装置制备SO2并进行相关性质的探究。
(1)仪器Q的名称为_________ 。
(2)装置B是为了观察气体的流速,则试剂M为_________(填字母)。
(3)装置C中出现的现象说明SO2具有_________ 性。
(4)装置E中__________________ (填现象)可说明SO2具有还原性,发生反应的离子方程式为__________________ 。
(5)装置F的作用是_________ 。
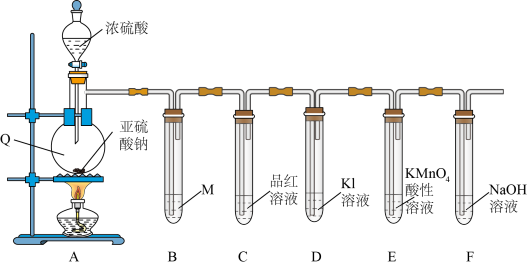
(1)仪器Q的名称为
(2)装置B是为了观察气体的流速,则试剂M为_________(填字母)。
| A.NaOH溶液 | B.饱和NaHSO3溶液 | C.Na2S溶液 | D.Na2SO3溶液 |
(3)装置C中出现的现象说明SO2具有
(4)装置E中
(5)装置F的作用是
您最近一年使用:0次
解题方法
6 . 如图是元素周期表中的一部分。
(1)化学性质最不活泼的元素是_________ ,氧化性最强的单质是__________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是_________ ,呈两性的是_________ 。
(3)在B、C、D、G、I中,原子半径最大的是_________ ,它们的离子半径最大是_________ (填离子符号)。
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为___________________ 。
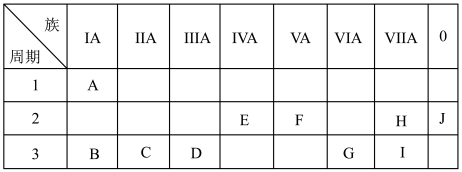
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)在B、C、D、G、I中,原子半径最大的是
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 固体粉末 中含有
中含有 等物质,现取
等物质,现取 进行连续实验,实验过程及产物如图:
进行连续实验,实验过程及产物如图:
(1)①气体C的主要成分是___________ (填“ ”或“
”或“ ”)。
”)。
②溶液B中一定存在的金属阳离子是 、
、___________ (填“ ”或“
”或“ ”)。
”)。
③实验室收集 时用排
时用排___________ (填“饱和食盐水”或“饱和碳酸氢钠溶液”)法。
(2)回收利用 是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气
是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气 ,其原理是
,其原理是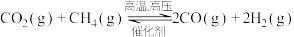 。
。
①恒温条件下,分别向甲、乙两个恒容容器中各加入 与
与 的混合气体,开始时容器压强:甲
的混合气体,开始时容器压强:甲 乙。则反应速率关系是容器甲
乙。则反应速率关系是容器甲___________ (填“ ”或“
”或“ ”)容器乙。
”)容器乙。
②上述反应达到最大限度时,则___________ (填字母)。
A.正、逆反应速率相等 B. 的转化率为
的转化率为 C.反应停止
C.反应停止
 中含有
中含有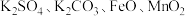 等物质,现取
等物质,现取 进行连续实验,实验过程及产物如图:
进行连续实验,实验过程及产物如图: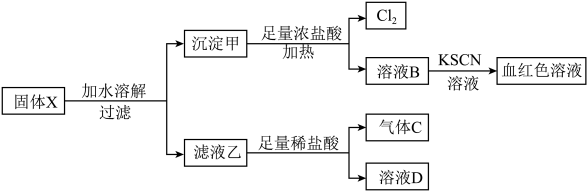
(1)①气体C的主要成分是
 ”或“
”或“ ”)。
”)。②溶液B中一定存在的金属阳离子是
 、
、 ”或“
”或“ ”)。
”)。③实验室收集
 时用排
时用排(2)回收利用
 是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气
是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气 ,其原理是
,其原理是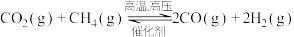 。
。①恒温条件下,分别向甲、乙两个恒容容器中各加入
 与
与 的混合气体,开始时容器压强:甲
的混合气体,开始时容器压强:甲 乙。则反应速率关系是容器甲
乙。则反应速率关系是容器甲 ”或“
”或“ ”)容器乙。
”)容器乙。②上述反应达到最大限度时,则
A.正、逆反应速率相等 B.
 的转化率为
的转化率为 C.反应停止
C.反应停止
您最近一年使用:0次
解题方法
8 . 已知非金属单质硫 是淡黄色固体粉末,难溶于水。为了验证氯元素与硫元素的非金属性强弱,某化学实验小组设计了如图实验。回答下列问题:
是淡黄色固体粉末,难溶于水。为了验证氯元素与硫元素的非金属性强弱,某化学实验小组设计了如图实验。回答下列问题:___________ 。
(2)装置A用于制取___________ (填“ ”或“
”或“ ”)。
”)。
(3)装置B中的实验现象为___________ 。
(4)装置C用于尾气处理,盛放的 溶液的溶质为
溶液的溶质为___________ (填“ ”或“
”或“ ”)。
”)。
(5)实验验证了非金属性:氯元素___________ (填“强于”或“弱于”)硫元素。
 是淡黄色固体粉末,难溶于水。为了验证氯元素与硫元素的非金属性强弱,某化学实验小组设计了如图实验。回答下列问题:
是淡黄色固体粉末,难溶于水。为了验证氯元素与硫元素的非金属性强弱,某化学实验小组设计了如图实验。回答下列问题:
(2)装置A用于制取
 ”或“
”或“ ”)。
”)。(3)装置B中的实验现象为
(4)装置C用于尾气处理,盛放的
 溶液的溶质为
溶液的溶质为 ”或“
”或“ ”)。
”)。(5)实验验证了非金属性:氯元素
您最近一年使用:0次
名校
9 . 有机物J具有良好的杀菌消炎功效,其一种合成路线如下(R为烷烃基):
(1)A中官能团的名称为___________ ,B中碳原子的杂化方式有___________ 种。
(2) 的化学方程式为
的化学方程式为___________ ,反应类型是___________ 。
(3) 的结构简式为
的结构简式为___________ ,G的化学名称为___________ 。
(4) 的同分异构体有很多种,其中符合下列条件的有
的同分异构体有很多种,其中符合下列条件的有___________ 种(不包括立体异构)。
①苯环上共有3个取代基;
②能发生银镜反应,遇 溶液呈紫色;
溶液呈紫色;
③能发生水解反应, 有机物可消耗
有机物可消耗 。
。
(5) 的合成路线如下(部分反应条件已略去)。
的合成路线如下(部分反应条件已略去)。 的合成路线,一定条件
的合成路线,一定条件 为
为___________ 。
② 的结构简式为
的结构简式为___________ 。
(1)A中官能团的名称为
(2)
 的化学方程式为
的化学方程式为(3)
 的结构简式为
的结构简式为(4)
 的同分异构体有很多种,其中符合下列条件的有
的同分异构体有很多种,其中符合下列条件的有①苯环上共有3个取代基;
②能发生银镜反应,遇
 溶液呈紫色;
溶液呈紫色;③能发生水解反应,
 有机物可消耗
有机物可消耗 。
。(5)
 的合成路线如下(部分反应条件已略去)。
的合成路线如下(部分反应条件已略去)。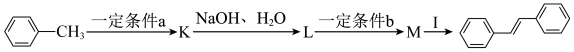
 的合成路线,一定条件
的合成路线,一定条件 为
为②
 的结构简式为
的结构简式为
您最近一年使用:0次
2024-04-19更新
|
214次组卷
|
3卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)甘肃省2024届高三普通高中三模化学试卷(已下线)暑假作业20 有机物结构和性质的综合考查-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)
10 . 随着“碳达峰”、“碳中和”战略的提出,大气中 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:
(1) 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。___________ (用文字叙述)。
(2) 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
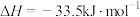 ,
,
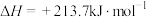 。
。
①
___________  。
。
②利于该反应自发进行的条件为___________ (填“高温”“低温”或“任意条件”)。
(3) 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
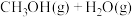
 ],其转化过程如图1所示。
],其转化过程如图1所示。___________ 。
②一定温度下,向体积为 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时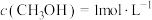 。前
。前 内,
内,
___________  ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (用分数表示)。
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是___________ (填字母)。
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C. 和
和 物质的量之比不变
物质的量之比不变
D.单位时间内,每有 键断裂,同时有
键断裂,同时有 键形成
键形成
(4) 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液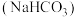 ,通过电解转化为
,通过电解转化为 及
及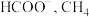 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。 转化为
转化为 的电极反应式为
的电极反应式为___________ 。
②工业生产上常采用较高电压,其目的为___________ 。
 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:(1)
 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。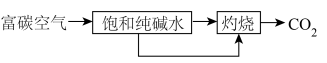
(2)
 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
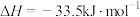 ,
,
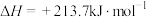 。
。①

 。
。②利于该反应自发进行的条件为
(3)
 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
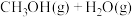
 ],其转化过程如图1所示。
],其转化过程如图1所示。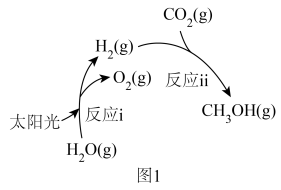
②一定温度下,向体积为
 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时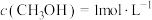 。前
。前 内,
内,
 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C.
 和
和 物质的量之比不变
物质的量之比不变D.单位时间内,每有
 键断裂,同时有
键断裂,同时有 键形成
键形成(4)
 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液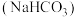 ,通过电解转化为
,通过电解转化为 及
及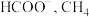 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。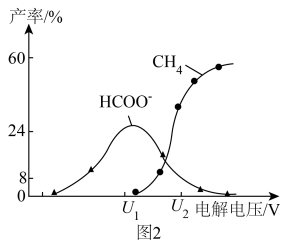
 转化为
转化为 的电极反应式为
的电极反应式为②工业生产上常采用较高电压,其目的为
您最近一年使用:0次
2024-04-19更新
|
192次组卷
|
4卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)甘肃省2024届高三普通高中三模化学试卷(已下线)高二化学下学期期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)(已下线)暑假作业15 突破化学反应原理综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)



