1 . 根据以下合成路线回答:
(2)下列说法正确的是_______。
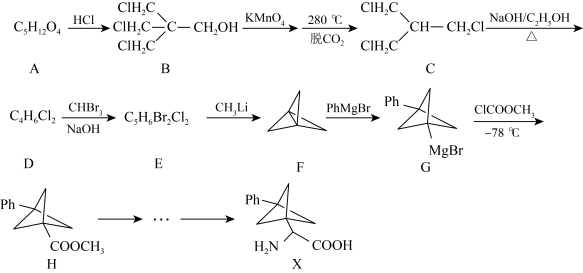
| A.化合物A含有4个羟基,是饱和经 |
| B.C生成D反应是消除反应,是E2反应历程 |
| C.F和H都有3个不饱和度 |
| D.化合物E中有一个三元环 |
(2)下列说法正确的是_______。
| A.化合物D生成E的中间体是卡宾 |
| B.化合物E生成F反应经过4步亲核取代反应 |
| C.化合物F生成G要在无水条件下进行 |
| D.H到X先水解,再用胺基取代即可 |
您最近一年使用:0次
2 . 我国在商代或更早就掌握了冶炼铜的技术。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为 。
。
(1)基态 的电子排布式为
的电子排布式为___________ ,从原子结构角度上解释,高温下 能转化为
能转化为 的原因是
的原因是___________ 。铜、铁两类原子核外电子运动状态相差___________ 种。
(2) 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________
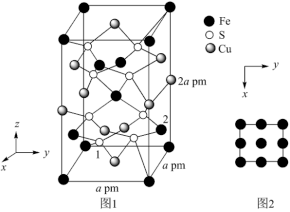
(3) 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为___________ ;
 。
。(1)基态
 的电子排布式为
的电子排布式为 能转化为
能转化为 的原因是
的原因是(2)
 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(3)
 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为
您最近一年使用:0次
解题方法
3 . 除了上面的金属钠之外,白风还发现了以前一位学弟留下的实验报告。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为___________ 。
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为___________ 。
(3)若mn = 5,则反应中转移的电子数量最小为___________ 。
(4)若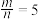 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为___________ 。
(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中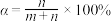 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
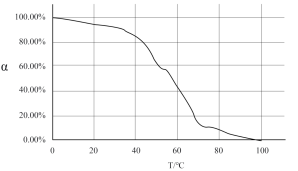
Ⅰ.由图像我们可以得出的结论是:______________________ 。
Ⅱ.试推测为什么图像会有这种趋势:______________________ 。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为
(3)若mn = 5,则反应中转移的电子数量最小为
(4)若
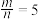 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中
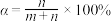 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
Ⅰ.由图像我们可以得出的结论是:
Ⅱ.试推测为什么图像会有这种趋势:
您最近一年使用:0次
4 . 看你有些听累了,白风这才拍了拍脑袋:“要不你先去休息下?我还有命题任务呢xwx”
“当然啦,毕竟是我约你出来玩的,如果乐意的话你也可以和我一起哦~”
面对白风的邀请,你怎么可能拒绝呢?
只不过,当你看到白风的命题群里正在讨论的问题是,一股不好的感觉忽然涌上心头……
白风:你们说,如果向等体积等浓度的两瓶溶液:【成分分别是Na2CO3和NaHCO3】中倒入过量但不等量的稀硫酸,有没有一种方法能区分出来他们两个原来的化学成分呢?
(1)看着大家都在想办法,白风转头朝你眨了眨眼:“你能给出一种可行的方案吗?_________________________ 。
看你想出来了白风很满意:“不愧是你,想到的这么快~”
“不过,这些仪器你认识嘛~”
(2)写出下列装置的完整名称:
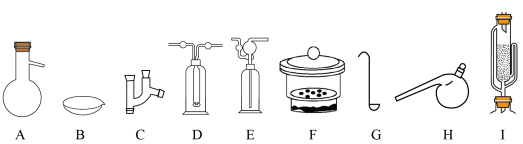
A___________ ,B___________ ,C___________ ,D___________ ,E___________ ,
F___________ ,G___________ ,H___________ ,I___________ 。
“当然啦,毕竟是我约你出来玩的,如果乐意的话你也可以和我一起哦~”
面对白风的邀请,你怎么可能拒绝呢?
只不过,当你看到白风的命题群里正在讨论的问题是,一股不好的感觉忽然涌上心头……
白风:你们说,如果向等体积等浓度的两瓶溶液:【成分分别是Na2CO3和NaHCO3】中倒入过量但不等量的稀硫酸,有没有一种方法能区分出来他们两个原来的化学成分呢?
(1)看着大家都在想办法,白风转头朝你眨了眨眼:“你能给出一种可行的方案吗?
看你想出来了白风很满意:“不愧是你,想到的这么快~”
“不过,这些仪器你认识嘛~”
(2)写出下列装置的完整名称:

A
F
您最近一年使用:0次
5 . “说起来,你知道传统文化里有多少化学知识喵~”
(1)《天工开物》中曾经记载过灰吹法冶炼白银的方法:灰吹法(cuppelation)是一种古代金银共生分离和银铅分离出银的方法。 银多与其它有色金属共生,而且银的含量行为往往偏少,故需要加以分离和提纯。灰吹法主要利用银铅互熔,使矿石中的银溶于铅中,通入空气,使铅氧化沉积,成为密陀僧(Lithargyrum),使银铅得以分离,且银得到提纯。
Ⅰ.密陀僧的主要成分的化学式为___________ 。
Ⅱ.铅在步骤中被采用的原因是:___________ ;___________ 。
Ⅲ.该过程中涉及到以下哪些步骤?___________
A.萃取 B.蒸馏 C.分液 D.溶解 E.以上都没有
(2)徽墨制作技艺,安徽省绩溪县、歙县、黄山市屯溪区地方传统手工技艺,国家级非物质文化遗产之一、徽墨是中国特有传统制墨技艺中的珍品,也是闻名中外的“文房四宝”之一、2006年5月,徽墨制作技艺经国务院批准列入第一批国家级非物质文化遗产名录。
【本题以桐烟徽墨为例】
Ⅰ.“一盏油灯燃烧一天一夜,才能收集大约10克烟灰。”这里烟灰俗名为___________ 。
Ⅱ.中国古代没有墨水只有墨锭,每当用时再加水研磨。如何让烟灰既能均匀分布在水中,又能坚固成型?古人最终决定将徽墨制作成___________ (填一种分散系),这是利用了这种分散系的___________ 和___________ 这两个性质。
(3)“纸香弥漫处,徽墨已半干。提笔风流起,落笔淡雅生。” 富阳土纸是古代劳动人民采用当年生的嫩毛竹作原料,靠手工操造而成的毛笔书写用纸。土纸是浙江省富阳市的特产。富阳土纸薄如蝉衣,韧力似纺绸,品多质优,张面光洁,色泽白净,不受虫蛀,不会变色。写字作画滋润而悦目。在制浆过程中,用石灰乳,草木灰水作蒸煮剂浸透,目的在于脱去原料中的色素,除去污质、蜡质、松解原料中残留的胶质及其它填充物。其中石灰乳和草木灰的化学式分别是:___________ ;___________ 。
(1)《天工开物》中曾经记载过灰吹法冶炼白银的方法:灰吹法(cuppelation)是一种古代金银共生分离和银铅分离出银的方法。 银多与其它有色金属共生,而且银的含量行为往往偏少,故需要加以分离和提纯。灰吹法主要利用银铅互熔,使矿石中的银溶于铅中,通入空气,使铅氧化沉积,成为密陀僧(Lithargyrum),使银铅得以分离,且银得到提纯。
Ⅰ.密陀僧的主要成分的化学式为
Ⅱ.铅在步骤中被采用的原因是:
Ⅲ.该过程中涉及到以下哪些步骤?
A.萃取 B.蒸馏 C.分液 D.溶解 E.以上都没有
(2)徽墨制作技艺,安徽省绩溪县、歙县、黄山市屯溪区地方传统手工技艺,国家级非物质文化遗产之一、徽墨是中国特有传统制墨技艺中的珍品,也是闻名中外的“文房四宝”之一、2006年5月,徽墨制作技艺经国务院批准列入第一批国家级非物质文化遗产名录。
【本题以桐烟徽墨为例】
Ⅰ.“一盏油灯燃烧一天一夜,才能收集大约10克烟灰。”这里烟灰俗名为
Ⅱ.中国古代没有墨水只有墨锭,每当用时再加水研磨。如何让烟灰既能均匀分布在水中,又能坚固成型?古人最终决定将徽墨制作成
(3)“纸香弥漫处,徽墨已半干。提笔风流起,落笔淡雅生。” 富阳土纸是古代劳动人民采用当年生的嫩毛竹作原料,靠手工操造而成的毛笔书写用纸。土纸是浙江省富阳市的特产。富阳土纸薄如蝉衣,韧力似纺绸,品多质优,张面光洁,色泽白净,不受虫蛀,不会变色。写字作画滋润而悦目。在制浆过程中,用石灰乳,草木灰水作蒸煮剂浸透,目的在于脱去原料中的色素,除去污质、蜡质、松解原料中残留的胶质及其它填充物。其中石灰乳和草木灰的化学式分别是:
您最近一年使用:0次
解题方法
6 . 磷酸亚铁锂( )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: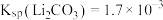
②LiOH、 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:
(1)过程I“碱浸”的目的是___________ 。
(2)若浸出液中存在大量 离子,则反应的离子方程式为
离子,则反应的离子方程式为___________ 。
(3)①过程III得到“沉淀Y”的离子方程式为___________ 。
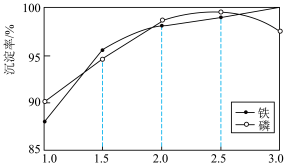
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为___________ 。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为___________ 。___________ 。
A.NaOH20-40℃ B.NaOH80-100℃
C. 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃
②常温下,测得滤液1中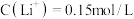 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
___________  。
。
 )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: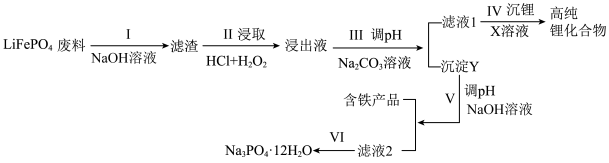
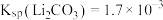
②LiOH、
 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | LiOH | 11.9 | 12.4 | 13.2 | 14.6 | 16.6 | 19.1 |
 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 | |
(1)过程I“碱浸”的目的是
(2)若浸出液中存在大量
 离子,则反应的离子方程式为
离子,则反应的离子方程式为(3)①过程III得到“沉淀Y”的离子方程式为
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为
A.NaOH20-40℃ B.NaOH80-100℃
C.
 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃②常温下,测得滤液1中
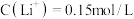 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
 。
。
您最近一年使用:0次
2023-12-05更新
|
400次组卷
|
3卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题山西运城新康国际中学2023-2024学年高三上学期一轮复习检测化学试卷(已下线)大题01 化工流程综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
7 . 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
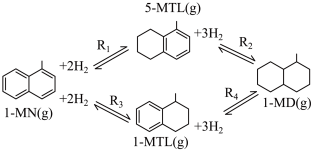
回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为___________ 。
(2)已知一定条件下反应 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为___________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)四个平衡体系的平衡常数与温度的关系如图甲所示。
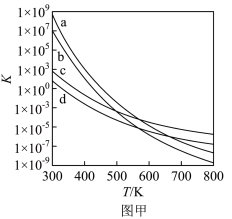
①c、d分别为反应 和
和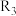 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为___________ 。
②已知反应 的速率方程
的速率方程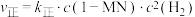 ,
,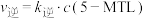 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时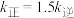 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法不正确的是___________ (填标号)。
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应 速率最快
速率最快
(4)1-MN在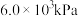 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性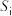 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数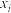 (
(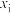 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
___________  (列出计算式)。
(列出计算式)。

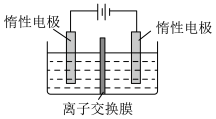
(5)利用膜电解技术(装置如图所示),以 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: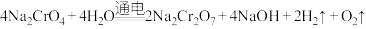 。则
。则 在
在___________ (填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___________ 。

回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为
(2)已知一定条件下反应
 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(3)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
 和
和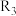 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程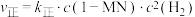 ,
,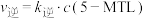 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时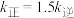 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法不正确的是
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应
 速率最快
速率最快(4)1-MN在
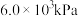 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性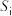 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数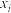 (
( 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
 (列出计算式)。
(列出计算式)。
(5)利用膜电解技术(装置如图所示),以
 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: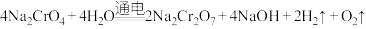 。则
。则 在
在
您最近一年使用:0次
8 . 生命体中,各种物质的结构和功能都与基础化学密切相关。磷脂和蛋白质就是其中的重要代表。
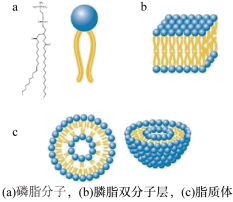
(1)磷脂双层膜是由两亲性的磷脂分子以“尾部朝里,头朝外”的方式组成的双层膜结构,它起到对细胞进行包裹保护以及对物质进行选择性传递的作用。构成该双层膜结构的磷脂分子和磷脂双层膜结构的示意图以及其相关的脂质体如图所示。
①依据磷脂双层膜结构的特征,解释为什么水溶液中的离子无法自由通过磷脂双层膜_____ 。
②细胞膜是由磷脂双层膜组成,由于细胞内外离子浓度分布的不均匀性,造成了膜两边形成了一定的电势差,被称为膜电位。由离子An+浓差形成的膜电位(定义细胞外的电势为零)可以通过如下方程计算:
神经元细胞内和细胞外的钠离子和钾离子浓度分别为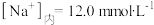 ,
,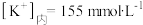 ,。
,。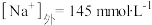 ,
, ,计算37.0°C下此种细胞的膜电位(注明正负)
,计算37.0°C下此种细胞的膜电位(注明正负)_____ 。
③在水溶液中,磷脂双层膜会自发卷曲成球形,该结构被称为脂质体,其结构如7-1中之图所示。通过测量脂质体在不同粘度溶液中自由扩散运动的扩散系数(D),可以计算得到其粒径。自由扩散运动符合布朗运动规律,遵循Stokes-Einstein方程,有d=kB77(3πηD),其中d为脂质体直径,η是溶液粘度(单位为cp, )。20.0℃下测得某脂质体在不同粘度溶液中的扩散系数如表所示,计算其直径(忽咯磷脂双层膜厚度)
)。20.0℃下测得某脂质体在不同粘度溶液中的扩散系数如表所示,计算其直径(忽咯磷脂双层膜厚度)_____ 。
某脂质体在不同粘度溶液中的扩散速率
④称取725.6mg磷脂分子(式盘786.1),制备成1.000mL脂质体水溶液。取10.00μL该溶液,测得其中含有1.12×10l4个脂质体颗粒。直径为100nm。假设所有磷脂分子都形成了脂质体,计算脂质体外表面磷脂分子的排布密度(单位:个·m-2)_____ 。
(2)某蛋白质可发生可逆的二聚化反应,2M(单体)=D(二聚体)。pH=7.5时,测得该二聚化反应在15°C,30°C,40°C下的平衡常数均为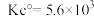 。假设二聚反应的焓变与熵变均与温度无关。
。假设二聚反应的焓变与熵变均与温度无关。
①计算在pH=7.5和体温37.0°C下二聚反应的标准摩尔焓变(单位:kJ·mo1-1)与熵变(单位:K·mol-1)_____ 。
②指明反应是焓驱动反应还是熵驱动反应,解释上述二聚反应熵变化的原因_____ 。
有机部分缩写:
Ac:乙酰基r。Bn:苄基(苯甲基):Bu:丁基;Cy:环已基;equiv:当量;Et:乙基;Me:甲基;OTf:三氟甲磺酰基;Ph:苯基;。R:烷基;TBS:tBuMeySi-;THF:四氢呋喃;TMS:三甲基硅基;Ts:对甲苯磺酰基。
(1)磷脂双层膜是由两亲性的磷脂分子以“尾部朝里,头朝外”的方式组成的双层膜结构,它起到对细胞进行包裹保护以及对物质进行选择性传递的作用。构成该双层膜结构的磷脂分子和磷脂双层膜结构的示意图以及其相关的脂质体如图所示。

①依据磷脂双层膜结构的特征,解释为什么水溶液中的离子无法自由通过磷脂双层膜
②细胞膜是由磷脂双层膜组成,由于细胞内外离子浓度分布的不均匀性,造成了膜两边形成了一定的电势差,被称为膜电位。由离子An+浓差形成的膜电位(定义细胞外的电势为零)可以通过如下方程计算:

神经元细胞内和细胞外的钠离子和钾离子浓度分别为
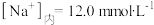 ,
,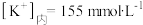 ,。
,。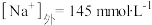 ,
, ,计算37.0°C下此种细胞的膜电位(注明正负)
,计算37.0°C下此种细胞的膜电位(注明正负)③在水溶液中,磷脂双层膜会自发卷曲成球形,该结构被称为脂质体,其结构如7-1中之图所示。通过测量脂质体在不同粘度溶液中自由扩散运动的扩散系数(D),可以计算得到其粒径。自由扩散运动符合布朗运动规律,遵循Stokes-Einstein方程,有d=kB77(3πηD),其中d为脂质体直径,η是溶液粘度(单位为cp,
 )。20.0℃下测得某脂质体在不同粘度溶液中的扩散系数如表所示,计算其直径(忽咯磷脂双层膜厚度)
)。20.0℃下测得某脂质体在不同粘度溶液中的扩散系数如表所示,计算其直径(忽咯磷脂双层膜厚度)某脂质体在不同粘度溶液中的扩散速率
| D(μm2·s-1) | η(cp) |
| 0.389 | 7.18 |
| 0.281 | 9.85 |
| 0.188 | 14.1 |
| 0.146 | 20.8 |
| 0.091 | 33.5 |
(2)某蛋白质可发生可逆的二聚化反应,2M(单体)=D(二聚体)。pH=7.5时,测得该二聚化反应在15°C,30°C,40°C下的平衡常数均为
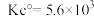 。假设二聚反应的焓变与熵变均与温度无关。
。假设二聚反应的焓变与熵变均与温度无关。①计算在pH=7.5和体温37.0°C下二聚反应的标准摩尔焓变(单位:kJ·mo1-1)与熵变(单位:K·mol-1)
②指明反应是焓驱动反应还是熵驱动反应,解释上述二聚反应熵变化的原因
有机部分缩写:
Ac:乙酰基r。Bn:苄基(苯甲基):Bu:丁基;Cy:环已基;equiv:当量;Et:乙基;Me:甲基;OTf:三氟甲磺酰基;Ph:苯基;。R:烷基;TBS:tBuMeySi-;THF:四氢呋喃;TMS:三甲基硅基;Ts:对甲苯磺酰基。
您最近一年使用:0次
解题方法
9 . 对题目(1)至(5)所提问题进行判断并提供合理解释。对题目(6)和(7)则按所给条件和要求解答。
(1)丙酮和六氟丙酮中哪个分子偶极矩更大_____ 。
(2)2,4-戊二酮的烯醇含量在水中还是在正己烷中高?将溶剂水换成二甲亚砜,2,4-戊酮的pKa是降低还是升高_____ 。
(3)(2E,4Z,6E)-辛-2,4,6-三烯在光照下关环后两个甲基是顺式的还是反式的?_____ 。
(4)乙酸乙酯、乙酰氯、N,N-二甲基乙酰胶中哪个化合物a-氢酸性最强?_____ 。
(5)吡啶和六氢吡啶中哪个分子偶极矩更大?_____ 。
(6)2-氟-5-三氟甲基吡啶与乙醇钠/乙醇的反应速率要比2,5-二氟吡啶快得多。为什么?_____ 。
(7)下表中列出酰肢化反应中常用的一些活化试剂。画出RCOOH被以下等量试剂活化后的中间体结构式(接下来与胺反应形成酰胺)_____ 。
(1)丙酮和六氟丙酮中哪个分子偶极矩更大
(2)2,4-戊二酮的烯醇含量在水中还是在正己烷中高?将溶剂水换成二甲亚砜,2,4-戊酮的pKa是降低还是升高
(3)(2E,4Z,6E)-辛-2,4,6-三烯在光照下关环后两个甲基是顺式的还是反式的?
(4)乙酸乙酯、乙酰氯、N,N-二甲基乙酰胶中哪个化合物a-氢酸性最强?
(5)吡啶和六氢吡啶中哪个分子偶极矩更大?
(6)2-氟-5-三氟甲基吡啶与乙醇钠/乙醇的反应速率要比2,5-二氟吡啶快得多。为什么?
(7)下表中列出酰肢化反应中常用的一些活化试剂。画出RCOOH被以下等量试剂活化后的中间体结构式(接下来与胺反应形成酰胺)
| 8-7-1PPh3,CBrCl3 | 8-7-2CyN=C=NCy | 8-7-3(CH3CO)2O |
8-7-4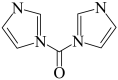 | 8-7-5 | 8-7-6 |
您最近一年使用:0次
10 . 甘氨酸亚铁晶体是一种新型的固体整合补铁剂。其实验室合成路线为:铁片 FeSO4
FeSO4 FeCO3
FeCO3 甘氨酸亚铁晶体粗品
甘氨酸亚铁晶体粗品 甘氨酸亚铁晶体纯品。
甘氨酸亚铁晶体纯品。
已知:相关物质的信息如表所示:
(一)FeCO3固体的制备
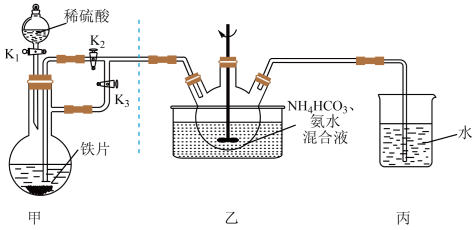
(1)实验开始时应先开K1和________ ,关________ (填“K2”或“K3”)一段时间后,改变开关状态,生成FeCO3。
(2)三颈瓶中生成FeCO3的离子方程式为________ 。
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是_________ 。
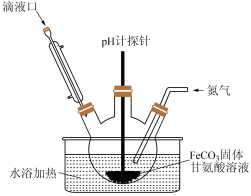
(4)当FeCO3固体完全溶解后,再通过滴液口加入乙醇,其作用是________ 。
(5)反应结束后,过滤出产品粗品,依次用________ 、_______ (填序号)洗涤,再经过一系列操作得纯品。
a.热水 b.冰水 c.乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol/LH2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol/L(NH4)2Ce(SO4)3,标准液滴定至终点,用去标准液20.20mL(反应为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
回答下列问题:
(6)甘氨酸亚铁晶体中Fe的质量分数为_________  (保留小数点后一位)。
(保留小数点后一位)。
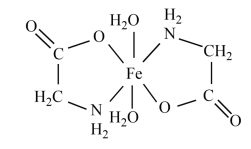
(7)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+且存在五元整合环,甘氨酸亚铁晶体的结构简式如图所示,则Fe2+的配位数为________ 。
 FeSO4
FeSO4 FeCO3
FeCO3 甘氨酸亚铁晶体粗品
甘氨酸亚铁晶体粗品 甘氨酸亚铁晶体纯品。
甘氨酸亚铁晶体纯品。已知:相关物质的信息如表所示:
| 物质 | 化学式 | 摩尔质量 | 性质 |
| 甘氨酸 | H2NCH2COOH | 75g/mol | 两性物质,易溶于水,微溶于乙醇 |
| 甘氨酸亚铁晶体 | 易溶于水,溶解度随温度升高而增大;难溶于乙醇,在潮湿的空气中易被氯化 |

(1)实验开始时应先开K1和
(2)三颈瓶中生成FeCO3的离子方程式为
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是

(4)当FeCO3固体完全溶解后,再通过滴液口加入乙醇,其作用是
(5)反应结束后,过滤出产品粗品,依次用
a.热水 b.冰水 c.乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol/LH2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol/L(NH4)2Ce(SO4)3,标准液滴定至终点,用去标准液20.20mL(反应为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
回答下列问题:
(6)甘氨酸亚铁晶体中Fe的质量分数为
 (保留小数点后一位)。
(保留小数点后一位)。(7)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+且存在五元整合环,甘氨酸亚铁晶体的结构简式如图所示,则Fe2+的配位数为

您最近一年使用:0次
2023-10-04更新
|
108次组卷
|
2卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题



