解题方法
1 . 不能用P2O5干燥氯化氢气体的原因是:1.0 g P2O5能和237 mL(标准状况)氯化氢气体反应生成两种产物,其中 一种是HPO3(偏磷酸)。请写出反应方程式_______ 。(要求写出计算过程)
您最近一年使用:0次
2 . 某铁的氧化物中含氧化亚铁14.37%,三氧化二铁47.91%及四氧化三铁; 37.72%。称取此混合物10.0 g,加入100.0 mLx mol·L-1HCl溶液,立即通入N2 ,溶解完成后,加入7.2493 g铁粉(假定铁粉与HCl不反应)。待溶液变澄清后,滴入5.00 mol·L-1NaOH溶液200.0 mL。此时恰好完全生成白色沉淀,试求x值。___________________________
您最近一年使用:0次
3 . 自然界存在的某天然碱(纯净物)的化学组成可表示为aNa2CO3、bNaHCO3、cH2O(a、b、c为正整数)。现称取不同质量的天然碱样品,溶于水后,分别逐滴加入相同浓度的盐酸溶液,30mL,产生CO2的体积(标准状况)如图所示。
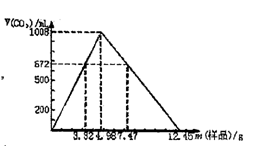
(1)若用2.49g样品进行同样的实验时,产生CO2的体积为_______ mL(标准状况)。
(2)另取3.32天然碱样品于200°C加热至完全分解(200°C时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,试通过计算确定该天然碱的化学式_______ 。
(3)实验中所用盐酸的物质的量浓度为_______ 。

(1)若用2.49g样品进行同样的实验时,产生CO2的体积为
(2)另取3.32天然碱样品于200°C加热至完全分解(200°C时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,试通过计算确定该天然碱的化学式
(3)实验中所用盐酸的物质的量浓度为
您最近一年使用:0次
解题方法
4 . 工业以黄铁矿为原料生产硫酸,吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
计算:该铵盐中氮元素的质量分数_______ (计算结果保留两位小数)
| 铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量(g) | m | m | 1.29 | 0 |
计算:该铵盐中氮元素的质量分数
您最近一年使用:0次
解题方法
5 . 为了减少煤燃烧产生的二氧化硫的排放,可以采取各种方法,其中一种方法是使用微生物脱硫技术。煤炭中以FeS2形式存在的硫,在有水和空气存在的条件下,用脱硫微生物起氧化还原作用:在细菌作用下FeS2 中的硫元素首先被氧化最高价态,然后亚铁离子继续被氧化成高价铁离子。
(1)请分别写出上述过程总离子反应方程式___________ 。
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸___________ 吨;硫酸铁___________ 吨。
(1)请分别写出上述过程总离子反应方程式
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸
您最近一年使用:0次
解题方法
6 . 氙和氟气反应,生成含有XeF2和XeF4的固体混合物,现用两份等质量的此种固体混合物,分别做下面的化学分析:
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数___________ 。(提示:XeF2与H2O仅发生氧化还原反应;XeF4与H2O反应时,有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应。)
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数
您最近一年使用:0次
解题方法
7 . 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8:7;将mgX粉末全部溶于200mL的浓HNO3,反应后的溶液加水稀释至2.12L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:

(1)请通过计算确定m的值______ ;
(2)X的摩尔质量为368g/mol,请确定X的化学式_________ 。

(1)请通过计算确定m的值
(2)X的摩尔质量为368g/mol,请确定X的化学式
您最近一年使用:0次
8 . 在恒温、恒容的密闭容器中,混合气体A、B、C的物质的量浓度(c)与时间(t)的关系如下表所示:
请填空:
(1)前2min内,v(B)=___________ 。
(2)6min- 8min若只改变了反应体系中某一种物质的浓度,则应为___________ (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为___________ mol·L-1
(3)如果在相同条件下,要使该反应从逆反应方向开始进行,且达平衡时与第4min时各物质的物质的量浓度完全相同,则加入B的物质的量浓度的取值范围为___________ 。
| tc | 初始 | 2min | 4min | 6min | 8min |
| c(A)(mol·L-1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
| c(B)(mol·L-1) | 1.56 | 2.16 | 2.56 | 2.56. | 2.16 |
| c(C)(mol·L-1) | 0.39 | 0.54 | 0.64. | 0.64 | 1.54 |
(1)前2min内,v(B)=
(2)6min- 8min若只改变了反应体系中某一种物质的浓度,则应为
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为
(3)如果在相同条件下,要使该反应从逆反应方向开始进行,且达平衡时与第4min时各物质的物质的量浓度完全相同,则加入B的物质的量浓度的取值范围为
您最近一年使用:0次
解题方法
9 . 苯甲酸作为食品如香肠、蕃茄酱、芥末、其他调味剂,和黄油及其许多其他产品的防腐剂被广泛使用。苯甲酸能抑制霉菌、酵母和其他一些细菌的繁殖。苯甲酸对人体无害,其通过代谢为马尿酸被排出体外,因而不会在体内积累。越橘、野生黄莓等含有较多的苯甲酸。当pH低于5时,苯甲酸具有防腐效果。
(1)写出苯甲酸在水中的质子转移反应方程式_______ 。
(2)已知苯甲酸的Ka= 6.31 ×10-5。当苯甲酸的浓度c为0.012 mol·L-1时,计算该溶液的pH=_______ 。
(3)分别确定pH=4.00和pH=6.00的水果汁中苯甲酸离子与苯甲酸浓度的比值_______ 、_______ 。
(4)当pH=_______ 时苯甲酸溶液具有最佳的缓冲能力。
(5)将25 mL、浓度为0.0150 mol·L-1的苯甲酸溶液加到浓度为0.0120 mol·L-1的17 mL氢氧化钠溶液中,计算该混合溶液的pH=_______ 。
(1)写出苯甲酸在水中的质子转移反应方程式
(2)已知苯甲酸的Ka= 6.31 ×10-5。当苯甲酸的浓度c为0.012 mol·L-1时,计算该溶液的pH=
(3)分别确定pH=4.00和pH=6.00的水果汁中苯甲酸离子与苯甲酸浓度的比值
(4)当pH=
(5)将25 mL、浓度为0.0150 mol·L-1的苯甲酸溶液加到浓度为0.0120 mol·L-1的17 mL氢氧化钠溶液中,计算该混合溶液的pH=
您最近一年使用:0次
10 . 现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4. 48L NO(标准状况)。向所得溶液中加入一定体积1. 0mol/LNaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32. 0g固体。试计算:
(1)原混合物中CuO的质量_______ ;
(2)加入NaOH溶液的体积_______ 。
(1)原混合物中CuO的质量
(2)加入NaOH溶液的体积
您最近一年使用:0次



