名校
解题方法
1 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数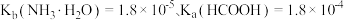 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数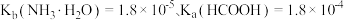 )
)
您最近一年使用:0次
解题方法
2 . 常温下,将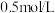 盐酸溶液和未知浓度的
盐酸溶液和未知浓度的 溶液以
溶液以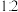 的体积比混合(忽略溶液体积变化),所得溶液的
的体积比混合(忽略溶液体积变化),所得溶液的 。用上述
。用上述 溶液与
溶液与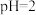 的某一元弱酸溶液
的某一元弱酸溶液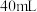 恰好完全反应,消耗了
恰好完全反应,消耗了 溶液
溶液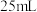 ,试求:
,试求:
(1) 溶液的物质的量浓度为
溶液的物质的量浓度为______  。
。
(2)该一元弱酸的物质的量浓度为______  。
。
(3)此条件下该一元弱酸的电离度为______ 。
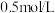 盐酸溶液和未知浓度的
盐酸溶液和未知浓度的 溶液以
溶液以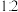 的体积比混合(忽略溶液体积变化),所得溶液的
的体积比混合(忽略溶液体积变化),所得溶液的 。用上述
。用上述 溶液与
溶液与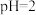 的某一元弱酸溶液
的某一元弱酸溶液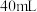 恰好完全反应,消耗了
恰好完全反应,消耗了 溶液
溶液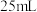 ,试求:
,试求:(1)
 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(2)该一元弱酸的物质的量浓度为
 。
。(3)此条件下该一元弱酸的电离度为
您最近一年使用:0次
名校
3 . 在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
已知2 min内v(Q)=0.075 mol·L-1·min-1, =0.5
=0.5
(1)试确定以下物质的相关量:起始时n(Y)=___________ ,n(Q)=___________ ;
(2)方程式中m=___________ ,n=___________ ,p=___________ ,q=___________ ;
(3)用Z表示2 min内的反应速率___________ 。
 pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | 0.8 |
 =0.5
=0.5(1)试确定以下物质的相关量:起始时n(Y)=
(2)方程式中m=
(3)用Z表示2 min内的反应速率
您最近一年使用:0次
名校
解题方法
4 . 电化学广泛应用于工业生产和环境保护上。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
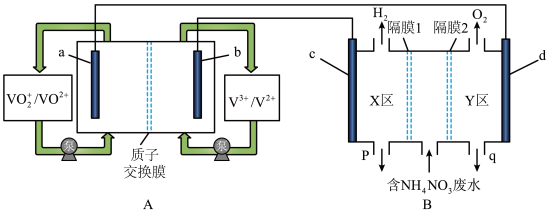
①全钒液流电池放电时,a电极反应式为___________ ,电子的流向由___________ (填“a→导线→d”或“d→导线→a”)。
②隔膜1为___________ 离子交换膜(填“阴”或“阳”),装置B中q口流出液中主要的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
③当装置A中有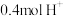 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为___________ L(标准状况下),处理___________ 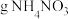 。
。
(2)用电解法可除去硝酸工业产生的尾气NO,并得到 ,工作原理如下图。
,工作原理如下图。
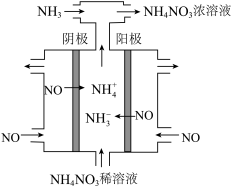
理论上通入 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为___________ 。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含
 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
①全钒液流电池放电时,a电极反应式为
②隔膜1为
③当装置A中有
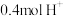 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为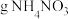 。
。(2)用电解法可除去硝酸工业产生的尾气NO,并得到
 ,工作原理如下图。
,工作原理如下图。
理论上通入
 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为
您最近一年使用:0次
解题方法
5 . 已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g),在610K时,将0.10molCO2与0.40molH2S充入1L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g),在610K时,将0.10molCO2与0.40molH2S充入1L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)计算H2S的平衡转化率a=_____ (写出计算过程)。
(2)计算浓度平衡常数K=_____ 。(写出计算过程)。
 COS(g)+H2O(g),在610K时,将0.10molCO2与0.40molH2S充入1L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g),在610K时,将0.10molCO2与0.40molH2S充入1L的空钢瓶中,反应平衡后水的物质的量分数为0.02。(1)计算H2S的平衡转化率a=
(2)计算浓度平衡常数K=
您最近一年使用:0次
解题方法
6 . 用 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
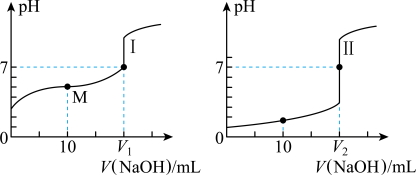
(1)用 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为______ (选填“酚酞”、“甲基橙”或“石蕊”),符合其滴定曲线的是______ (选填“Ⅰ”或“Ⅱ”)。
(2) 盐酸中,由水电离出的
盐酸中,由水电离出的
______  。
。
(3)图中 和
和 大小的比较:
大小的比较:
______ (选填“<”或“=”或“>”) 。
。
(4)在 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和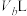 该
该 溶液。
溶液。
①若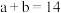 ,则
,则
______ (填数字)。
②若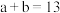 ,则
,则
______ (填数字)。
 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
(1)用
 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为(2)
 盐酸中,由水电离出的
盐酸中,由水电离出的
 。
。(3)图中
 和
和 大小的比较:
大小的比较:
 。
。(4)在
 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和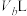 该
该 溶液。
溶液。①若
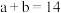 ,则
,则
②若
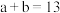 ,则
,则
您最近一年使用:0次
7 . 正常体温下,人体动脉血液的 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下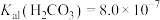 ,
,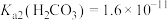 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。
(1)正常体温下,若某人动脉血 为
为 ,则属于
,则属于______ 中毒(选填“酸”或“碱”),他的血液中
______ 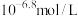 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(2)已知: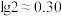 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中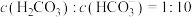 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。_____________________
 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下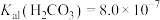 ,
,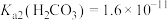 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。(1)正常体温下,若某人动脉血
 为
为 ,则属于
,则属于
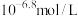 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(2)已知:
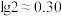 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中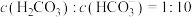 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。
您最近一年使用:0次
名校
解题方法
8 . 完成下列问题。
(1)常温下,0.05mol/L硫酸溶液中,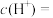
___________ mol/L,水电离的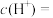
___________ mol/L。将1mL该溶液加水稀释到100mL,稀释后的溶液中
___________ 。
(2)T1℃时,纯水中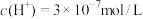 ,则纯水中
,则纯水中
___________ mol/L,此时温度___________ (填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后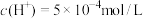 ,则溶液中
,则溶液中
___________ mol/L,由水电离的
___________ mol/L。
(3)T2℃时,测得 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数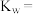
___________ 。该温度___________ (填“高于”“低于”或“等于”)25℃。
(4)常温下,设pH=5的 溶液中由水电离出的
溶液中由水电离出的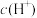 为c1;pH=5的
为c1;pH=5的 溶液中由水电离出的
溶液中由水电离出的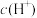 为
为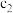 ,则
,则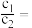
___________ 。
(5)常温下,pH=13的 溶液aL与pH=3的
溶液aL与pH=3的 溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=
溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=___________ 。
(6)已知t℃时,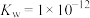 ,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=
,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=___________ 。
(1)常温下,0.05mol/L硫酸溶液中,
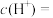
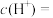

(2)T1℃时,纯水中
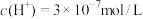 ,则纯水中
,则纯水中
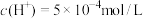 ,则溶液中
,则溶液中

(3)T2℃时,测得
 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数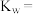
(4)常温下,设pH=5的
 溶液中由水电离出的
溶液中由水电离出的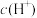 为c1;pH=5的
为c1;pH=5的 溶液中由水电离出的
溶液中由水电离出的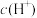 为
为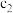 ,则
,则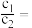
(5)常温下,pH=13的
 溶液aL与pH=3的
溶液aL与pH=3的 溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=
溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=(6)已知t℃时,
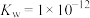 ,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=
,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=
您最近一年使用:0次
9 . 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。
(1)为研究A的组成与结构,进行如下实验:
(2)综上所述,A的结构简式为___________ 。
(3)两分子A可反应生成一个六元环状化合物,写出该反应的化学方程式___________ 。
(1)为研究A的组成与结构,进行如下实验:
| 实验步骤: | 实验结论 |
| ①称取9.0 g A,升温使其汽化,测其密度是相同条件下H2的45倍 | A的相对分子质量为 |
| ②将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | A的分子式为 |
| ③另取9.0 g A,与足量的NaHCO3粉末反应,生成2.24 LCO2(标准状况);若与足量金属钠反应则生成2.24 LH2 (标准状况) | 用结构简式表示A中含有的官能团 |
④A的核磁共振氢谱如图: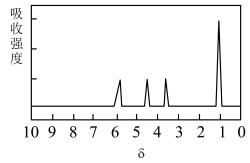 | A中含有 |
(3)两分子A可反应生成一个六元环状化合物,写出该反应的化学方程式
您最近一年使用:0次
2023-07-31更新
|
132次组卷
|
2卷引用:陕西省延安市宜川中学2020-2021学年高二上学期期末考试化学试题
10 . 回答下列问题:
(1)已知:①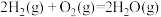 ∆H1=-483.6kJ/mol
∆H1=-483.6kJ/mol
②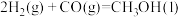 ∆H2=-128.3kJ/mol
∆H2=-128.3kJ/mol
③ ∆H3=+206.1kJ/mol
∆H3=+206.1kJ/mol
属于吸热反应的是__________ (填序号)。
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________ 。
(2)通过化学键的键能计算。已知:
则合成氨反应N2(g)+3H2(g) 2NH3(g) △H=a kJ/mol,a为
2NH3(g) △H=a kJ/mol,a为______ 。
(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。写出H2O(g)转化为1 mol H2O(l)热化学方程式:_______________ 。H2O(l)的稳定性_________ 填(“大于”“小于”)H2O(g)
(1)已知:①
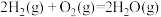 ∆H1=-483.6kJ/mol
∆H1=-483.6kJ/mol ②
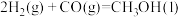 ∆H2=-128.3kJ/mol
∆H2=-128.3kJ/mol ③
 ∆H3=+206.1kJ/mol
∆H3=+206.1kJ/mol 属于吸热反应的是
写出由甲烷和氧气合成液态甲醇的热化学方程式:
(2)通过化学键的键能计算。已知:
化学键 | H—H | N—H | N≡N |
键能(kJ/mol ) | 436 | 391 | 945 |
 2NH3(g) △H=a kJ/mol,a为
2NH3(g) △H=a kJ/mol,a为(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。写出H2O(g)转化为1 mol H2O(l)热化学方程式:
您最近一年使用:0次



