正常体温下,人体动脉血液的 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下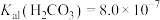 ,
,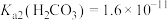 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。
(1)正常体温下,若某人动脉血 为
为 ,则属于
,则属于______ 中毒(选填“酸”或“碱”),他的血液中
______ 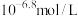 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(2)已知: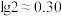 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中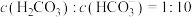 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。_____________________
 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下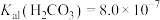 ,
,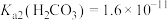 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。(1)正常体温下,若某人动脉血
 为
为 ,则属于
,则属于
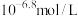 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(2)已知:
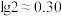 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中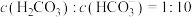 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。
更新时间:2024-01-30 14:49:44
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】水的电离平衡曲线如图所示。
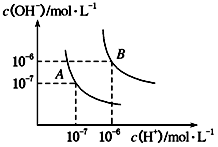
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从____________ 增加到____________ 。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为______________ 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为_________________ 。(原子量Ca:40,O:16,H:1)

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】下图为某市售盐酸试剂瓶标签上的部分数据。问:

(1)该盐酸的物质的量浓度为多少?
(2)取该盐酸25.4 mL与2.00 mol·L-1的氢氧化钠
溶液100 mL混合,再将混合液稀释到1.00 L,
此时溶液的pH约为多少?

(1)该盐酸的物质的量浓度为多少?
(2)取该盐酸25.4 mL与2.00 mol·L-1的氢氧化钠
溶液100 mL混合,再将混合液稀释到1.00 L,
此时溶液的pH约为多少?
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】按要求填写下列相关内容:
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=_______ 。某温度时,水的离子积常数 Kw=1×10-13.在此温度下,将 pH=a 的硫酸溶液 VaL与 pH=b的 NaOH 溶液 VbL 混合,若所得混合液为中性,如果 a+b=12,则 Va:Vb=_______ 。
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为______________ (用“V1、V2、V3”和“>、<、=”表示)。
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)______ 0.2mol/LMOH 溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_______ mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为______ mol/L。
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
一种脱除和利用水煤气中 方法的示意图如下:
方法的示意图如下:

某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
___________ (该温度下 的
的 )。
)。
一种脱除和利用水煤气中
 方法的示意图如下:
方法的示意图如下:
某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的 )。
)。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】某温度(t°C)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的Kw=_______ ;在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合.
(1)若所得混合液为中性,且a=2,b=12,则Va∶Vb=_______ ;
(2)若所得混合液的pH=10,且a=2,b=12,则Va∶Vb=_______ 。
(1)若所得混合液为中性,且a=2,b=12,则Va∶Vb=
(2)若所得混合液的pH=10,且a=2,b=12,则Va∶Vb=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】下表是不同温度下水的离子积常数:
试回答以下问题:
(1)若25<t1<t2,则Kw________ 1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________ 。
(2)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________ 。此溶液中各种离子的浓度由大到小的顺序是________ 。
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则Kw
(2)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为________ ?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为________ ?
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol Na2SO4的浓溶液,待反应完全后,上层清液中Ba2+浓度变为________ ?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
(1)此时水的离子积常数Kw为
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol Na2SO4的浓溶液,待反应完全后,上层清液中Ba2+浓度变为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】pH=12的氢氧化钠溶液稀释100倍后,pH=____________
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】常温下,向amol·L-1CH3COONa溶液中滴加等体积的bmol·L-1盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),则醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2 是一种一元中强酸,写出其电离方程式:_____ 。
(2)H3PO2 及 NaH2PO2 均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:____ (填化学式)
②NaH2PO2 是____ (填“正盐”或“酸式盐”),其溶液显_____ (填“弱酸性”、“中性”或者“弱碱性”),其溶液中离子浓度由大到小的顺序为_____
(3)H3PO2 的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成 PH3 气体和 Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:_____ 。
(4)常温下将amol·L−1的醋酸与 b mol·L−1的Ba(OH)2溶液等体积混合,充分反应后溶液恰好呈中性,醋酸的电离常数Ka =______ (用含 a 和 b 的代数式表示)。
(1)H3PO2 是一种一元中强酸,写出其电离方程式:
(2)H3PO2 及 NaH2PO2 均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
②NaH2PO2 是
(3)H3PO2 的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成 PH3 气体和 Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)常温下将amol·L−1的醋酸与 b mol·L−1的Ba(OH)2溶液等体积混合,充分反应后溶液恰好呈中性,醋酸的电离常数Ka =
您最近一年使用:0次

 的
的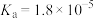 ,含浓度均为
,含浓度均为 的醋酸溶液电离度是
的醋酸溶液电离度是 ,保留3位有效数字)。
,保留3位有效数字)。 的能力的相对强弱:
的能力的相对强弱: (填“>”、“<”或“=”);用一个离子方程式说明
(填“>”、“<”或“=”);用一个离子方程式说明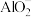 和
和 结合
结合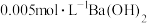 溶液的
溶液的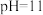 ,将
,将 溶液
溶液 与
与 的
的 溶液
溶液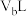 混合,混合液呈中性,则
混合,混合液呈中性,则


