1 . 利用 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:
反应1: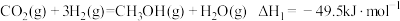
反应2:
反应3: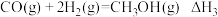
(1)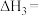
_______ 
(2)恒容条件下,下列有利于提高 平衡产率的条件是_______。
平衡产率的条件是_______。
(3)控制一定压强,通入 和
和 ,反应
,反应 后,
后, 转化率
转化率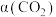 、
、 产率
产率 及
及 产率
产率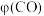 随温度变化曲线如图。
随温度变化曲线如图。
①温度升高, 先升高后降低的原因是
先升高后降低的原因是_______ 。
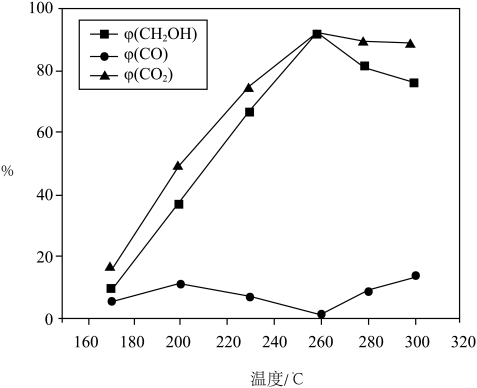
②260℃时,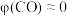 (认为此时只发生反应1),
(认为此时只发生反应1),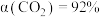 ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数
_______ (列出代数式即可),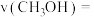
_______ (列出代数式即可)。
③280℃时, ,
, ,则反应2的平衡常数
,则反应2的平衡常数
_______ (列出代数式即可)。
(4)学界关于反应2产生的 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用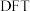 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。
路径1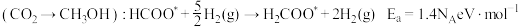
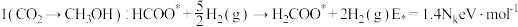 路径2
路径2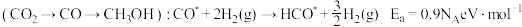
由此分析,200~260℃时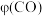 降低的原因是
降低的原因是_______ 。
 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:反应1:
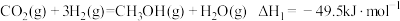
反应2:

反应3:
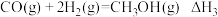
(1)
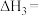

(2)恒容条件下,下列有利于提高
 平衡产率的条件是_______。
平衡产率的条件是_______。| A.使用催化剂 | B.调整 和 和 的投料比由1∶1至1∶3 的投料比由1∶1至1∶3 |
| C.增大反应物总压 | D.通入稀有气体 |
 和
和 ,反应
,反应 后,
后, 转化率
转化率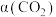 、
、 产率
产率 及
及 产率
产率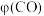 随温度变化曲线如图。
随温度变化曲线如图。
①温度升高,
 先升高后降低的原因是
先升高后降低的原因是②260℃时,
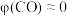 (认为此时只发生反应1),
(认为此时只发生反应1),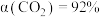 ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数
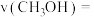
③280℃时,
 ,
, ,则反应2的平衡常数
,则反应2的平衡常数
(4)学界关于反应2产生的
 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用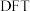 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。路径1
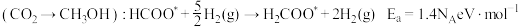
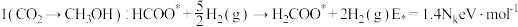 路径2
路径2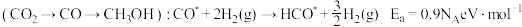
由此分析,200~260℃时
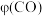 降低的原因是
降低的原因是
您最近一年使用:0次
2 . 钒是我国丰产元素,储量占全球11%,居第四位。在光纤通讯系统中,光纤将信息导入离光源lkm外的用户就需用5片钒酸钇晶体(钇是第39号元素)。我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元(1999年)。钒酸钇是四方晶体,晶胞参数a=712pm, c= 629pm,密度d=4.22g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。给出计算过程。钒酸钛的化学式:_____ 一个晶胞中的原子数:_____ 计算过程:_____ 。
您最近一年使用:0次
名校
解题方法
3 . 钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末;
②取一定量的粉末,放入28.00 mL 1 mol·L-1的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
完成下列各题:
(1)将反应后的溶液稀释至100 mL,则溶液中c(Fe2+)=________ mol·L-1。
(2)样品中n(Fe):n(Fe3O4)=__________ 。
①把一定量烤蓝铁片加工成均匀粉末;
②取一定量的粉末,放入28.00 mL 1 mol·L-1的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
完成下列各题:
(1)将反应后的溶液稀释至100 mL,则溶液中c(Fe2+)=
(2)样品中n(Fe):n(Fe3O4)=
您最近一年使用:0次
2020-11-27更新
|
979次组卷
|
5卷引用:浙江省诸暨市2018-2019学年高二上学期期末考试化学试题
浙江省诸暨市2018-2019学年高二上学期期末考试化学试题浙江省2018版考前特训(2017年10月)压轴特训:4 第29题 化学计算题专练2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算【精编20题】浙江省宁波市北仑中学2020-2021学年高一上学期期中考试化学试题(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
19-20高二·浙江·期末
解题方法
4 . 甲溶液是Na2CO3和NaOH的混合溶液,乙溶液是NH4Cl和HCl的混合溶液,已知乙溶液中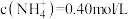 。取五份体积均为100mL的甲溶液,向其中缓慢加入不同体积的乙溶液,微热充分反应,测得各组产生的气体体积(假定气体全部逸出,标准状况下测定)如下表所示:
。取五份体积均为100mL的甲溶液,向其中缓慢加入不同体积的乙溶液,微热充分反应,测得各组产生的气体体积(假定气体全部逸出,标准状况下测定)如下表所示:
(1)甲溶液中Na2CO3的物质的量浓度是__________ 。
(2)乙溶液中HCl的物质的量浓度是__________ 。
(3)表中x的值为__________ 。
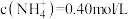 。取五份体积均为100mL的甲溶液,向其中缓慢加入不同体积的乙溶液,微热充分反应,测得各组产生的气体体积(假定气体全部逸出,标准状况下测定)如下表所示:
。取五份体积均为100mL的甲溶液,向其中缓慢加入不同体积的乙溶液,微热充分反应,测得各组产生的气体体积(假定气体全部逸出,标准状况下测定)如下表所示:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 乙溶液体积(mL) | 50 | 100 | 150 | 200 | 250 |
| 气体体积(mL) | 224 | x | 448 | 1120 | 1120 |
(1)甲溶液中Na2CO3的物质的量浓度是
(2)乙溶液中HCl的物质的量浓度是
(3)表中x的值为
您最近一年使用:0次
2019高三下·全国·专题练习
5 . 有两份溶液,其中所含溶质相同,设其摩尔质量为M g/mol。根据下表信息,回答有关问题:
(1)第一份溶液中,溶质的物质的量浓度为_______ 。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3=_____ 。
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小____ ;___ 。
| 项目 | 溶质的质量分数 | 溶液的密度/(g·cm-3) |
| 第一份溶液 | ω1 | ρ1 |
| 第二份溶液 | ω2 | ρ2 |
(1)第一份溶液中,溶质的物质的量浓度为
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3=
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小
您最近一年使用:0次
名校
6 . 硝酸在化学工业中有着极其广泛的应用。
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________ 。
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力。50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比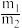 =
=______________ 。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35mol NaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x =___________ 。
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力。50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比
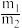 =
=(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35mol NaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x =
您最近一年使用:0次
2016-12-09更新
|
1308次组卷
|
3卷引用:2015-2016学年河北省定州中学高二6月月考化学试卷
7 . 某饱和有机物A由碳、氢、氧三种元素组成,现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢元素和碳元素的物质的量各是多少________ ?
(2)通过计算确定该有机物的分子式________ 。
(3)若核磁共振氢谱中出现三个信号峰,且强度之比为3:3:2,请写出该有机物的结构简式________ 。
(1)3gA中所含氢元素和碳元素的物质的量各是多少
(2)通过计算确定该有机物的分子式
(3)若核磁共振氢谱中出现三个信号峰,且强度之比为3:3:2,请写出该有机物的结构简式
您最近一年使用:0次
2016-12-09更新
|
737次组卷
|
2卷引用:2014-2015浙江省余姚中学高二4月月考化学试卷
8 . 为了测定一种气态烃 A 的化学式,取一定量的 A 置于一密闭容器中燃 烧,定性实验表明产物是 CO2、CO 和水蒸气。学生甲、乙设计了两个方案,均认为 根据自己的方案能求出 A 的最简式,他们测得的在一定条件下的有关数据如下(图 中的箭头表示气流的方向,实验前系统内的空气已排尽):
甲:燃烧产物先通过浓硫酸,浓硫酸增重2.52克,再通过碱石灰,碱石灰增重1.32克,最后将剩余的气体点燃又生成二氧化碳1.76克
乙:燃烧产物先通过碱石灰,碱石灰增重5.60克,再通过灼热的氧化铜,氧化铜减轻0.64克,最后将通过灼热的氧化铜后出来的气体通入过量的石灰水,石灰水增重4克。
(1)甲、乙两方案中,你认为哪种方案能求出A的最简式?
(2)请根据你选择的方案,通过计算求出 A 的最简式。(要求写出计算过程)
(3)若要确定A的分子式,是否需要测定其它数据?并说明原因。
甲:燃烧产物先通过浓硫酸,浓硫酸增重2.52克,再通过碱石灰,碱石灰增重1.32克,最后将剩余的气体点燃又生成二氧化碳1.76克
乙:燃烧产物先通过碱石灰,碱石灰增重5.60克,再通过灼热的氧化铜,氧化铜减轻0.64克,最后将通过灼热的氧化铜后出来的气体通入过量的石灰水,石灰水增重4克。
(1)甲、乙两方案中,你认为哪种方案能求出A的最简式?
(2)请根据你选择的方案,通过计算求出 A 的最简式。(要求写出计算过程)
(3)若要确定A的分子式,是否需要测定其它数据?并说明原因。
您最近一年使用:0次
9 . 实验室用铅蓄电池作电源电解500ml饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:Pb+PbO2+H2SO4=2PbSO4+2H2O
①.写出铅蓄电池放电时的电极方程式?
②.今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是多少?电解后所得溶液的物质的量浓度为?
③.若用此电池以铂为电极电解500ml,1mol/L的硫酸铜溶液.电解一段时间后,测得阴极增重16g。则此时在阳极上一共产生了多少体积气体(标准状况)?电解后的电解质溶液的pH是多少(室温下)?
①.写出铅蓄电池放电时的电极方程式?
②.今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是多少?电解后所得溶液的物质的量浓度为?
③.若用此电池以铂为电极电解500ml,1mol/L的硫酸铜溶液.电解一段时间后,测得阴极增重16g。则此时在阳极上一共产生了多少体积气体(标准状况)?电解后的电解质溶液的pH是多少(室温下)?
您最近一年使用:0次
10 . 用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
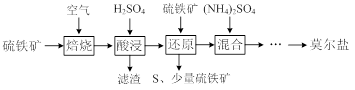
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
| 离子 | 离子浓度(mol·L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。
您最近一年使用:0次
2016-01-11更新
|
286次组卷
|
3卷引用:2015-2016学年河北省定州中学高二6月月考化学试卷



