名校
解题方法
1 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数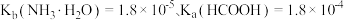 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数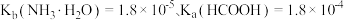 )
)
您最近一年使用:0次
名校
2 . 某有机物X(分子组成可表示为CxHyOz)是生物体的一种代谢产物,在不同的生命体中发挥不同的功能。现对X进行相关实验:
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为___________ ;X分解产物的化学式为___________ 。
(2)通过计算推导出X的分子式(写出计算过程)___________ 。
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为___________ 。
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为
(2)通过计算推导出X的分子式(写出计算过程)
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO
 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
您最近一年使用:0次
2024-02-24更新
|
151次组卷
|
2卷引用:浙江省宁波市北仑中学2023-2024学年高二下学期期中考试化学试题
3 . 如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
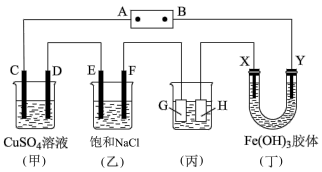
(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则B电极上的反应式为:___________ 。
(2)若装有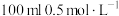 的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为
的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为___________ L,此时形成溶液的
___________ ,欲使溶液恢复到起始状态,可向溶液中加入___________ 。(电解过程忽略体积变化)
A.CuO B. C.
C. D.
D. E.CuO和
E.CuO和
(3)给 的硫酸铜溶液滴加NaOH溶液,开始沉淀时
的硫酸铜溶液滴加NaOH溶液,开始沉淀时
___________ ,沉淀完全时的
___________ 。(已知 的
的 ,当离子浓度≤10-5时认为沉淀完全)
,当离子浓度≤10-5时认为沉淀完全)

(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则B电极上的反应式为:
(2)若装有
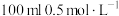 的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为
的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为
A.CuO B.
 C.
C. D.
D. E.CuO和
E.CuO和
(3)给
 的硫酸铜溶液滴加NaOH溶液,开始沉淀时
的硫酸铜溶液滴加NaOH溶液,开始沉淀时

 的
的 ,当离子浓度≤10-5时认为沉淀完全)
,当离子浓度≤10-5时认为沉淀完全)
您最近一年使用:0次
名校
解题方法
4 . 有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
名校
解题方法
5 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:


该反应一般认为通过如下步骤来实现:
反应①

反应②
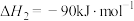
回答下列问题:
(1)
___________ 
(2)有利于提高 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有___________ (填编号)。
A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大 和
和 的初始投料比
的初始投料比
(3)二氧化碳加氢制甲醇的总反应按 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强 变化如图所示。
变化如图所示。
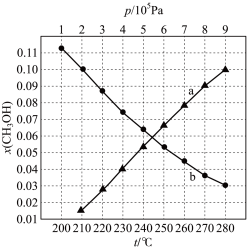
①图中对应在 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是___________ (填“ ”或“
”或“ ”)。判断理由是
”)。判断理由是___________ 。
② 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
③ 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程___________ 。


该反应一般认为通过如下步骤来实现:
反应①


反应②

回答下列问题:
(1)


(2)有利于提高
 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大
 和
和 的初始投料比
的初始投料比(3)二氧化碳加氢制甲醇的总反应按
 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强 变化如图所示。
变化如图所示。
①图中对应在
 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是 ”或“
”或“ ”)。判断理由是
”)。判断理由是②
 时,反应条件可能为
时,反应条件可能为③
 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程
您最近一年使用:0次
名校
6 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: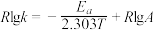 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
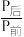 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: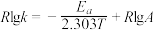 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
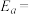

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
475次组卷
|
2卷引用:山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷
名校
解题方法
7 . 常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)已知 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤ 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是___________ (填序号)。
(2)Na2CO3溶液显碱性的原因___________ 。(用离子方程式表示)
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是_____ (填序号)。
(4)某温度下纯水的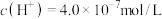 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使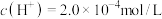 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的
_______ 。
(5)25℃时, 的
的 的
的 溶液与
溶液与 的
的 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系_______ 。
(6)向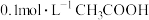 溶液中滴加
溶液中滴加 溶液至
溶液至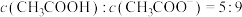 ,此时溶液
,此时溶液
_______ 。
(7)已知 的
的 ,
, 的
的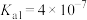 ,
,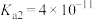 ,则反应
,则反应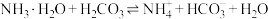 的平衡常数
的平衡常数
_______ 。
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
| 弱酸 |  |  |  |
| 电离平衡常数 |  |  | 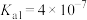 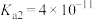 |
 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤ 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是(2)Na2CO3溶液显碱性的原因
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是
(4)某温度下纯水的
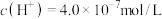 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使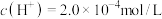 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的
(5)25℃时,
 的
的 的
的 溶液与
溶液与 的
的 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系(6)向
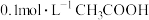 溶液中滴加
溶液中滴加 溶液至
溶液至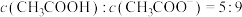 ,此时溶液
,此时溶液
(7)已知
 的
的 ,
, 的
的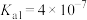 ,
,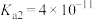 ,则反应
,则反应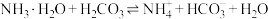 的平衡常数
的平衡常数
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
A. | B. | C.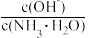 | D.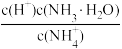 |
您最近一年使用:0次
名校
8 . 完成下列问题
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为_______ 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=_______ ,若温度不变,0.005 mol·L-1的H2SO4溶液中,由水电离出的c(H+)=_______ 。
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=_______ ;此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为_______ 。
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO )约为
)约为_______ 。
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO
 )约为
)约为
您最近一年使用:0次
2023-03-04更新
|
600次组卷
|
2卷引用:广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题
名校
9 . 工业废水中常含有一定量的 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。
(1) 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的酸式电离方程式:
的酸式电离方程式:_____ 。
(2) 在强碱中可被双氧水氧化为
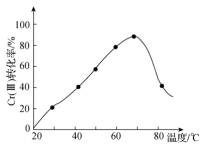
在强碱中可被双氧水氧化为 ,控制其他条件不变,反应温度对
,控制其他条件不变,反应温度对 转化率的影响如图所示。请分析温度超过70℃时,
转化率的影响如图所示。请分析温度超过70℃时, 转化率下降的原因是
转化率下降的原因是_______ 。
(3)溶液中的 与强碱性溶液反应,使
与强碱性溶液反应,使 完全沉淀的
完全沉淀的 为
为_______ {通常认为溶液中离子浓度小于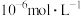 为沉淀完全;
为沉淀完全; 的
的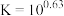 ,
,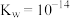 ,
, }。
}。
(4)25℃时,将 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为_______ 。
(5)标准状况下,将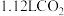 通入
通入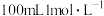 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: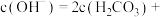
_______ 。
 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。(1)
 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的酸式电离方程式:
的酸式电离方程式:(2)
 在强碱中可被双氧水氧化为
在强碱中可被双氧水氧化为 ,控制其他条件不变,反应温度对
,控制其他条件不变,反应温度对 转化率的影响如图所示。请分析温度超过70℃时,
转化率的影响如图所示。请分析温度超过70℃时, 转化率下降的原因是
转化率下降的原因是
(3)溶液中的
 与强碱性溶液反应,使
与强碱性溶液反应,使 完全沉淀的
完全沉淀的 为
为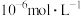 为沉淀完全;
为沉淀完全; 的
的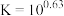 ,
,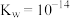 ,
, }。
}。(4)25℃时,将
 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为(5)标准状况下,将
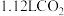 通入
通入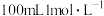 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: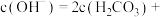
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题
(1)在25℃,101kpa下,1g甲醇( )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸气反应的热化学方程式:___________ 。
(3)已知:
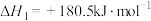

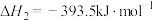
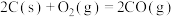
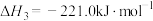
若某反应的平衡常数表达式为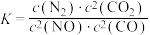 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
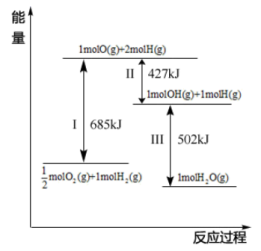
(4)根据图示信息写出热化学方程式:___________ 。
(5)已知:C(s)、CO(g)和 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为

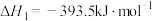


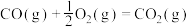
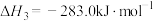
请你根据以上数据,写出C(s)与水蒸气反应生成CO和 的热化学方程式:
的热化学方程式:___________ 。
(1)在25℃,101kpa下,1g甲醇(
 )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)已知几种化学键的键能数据如表所示:
| 化学键 | N—H |  | Br—Br | H—Br |
键能/ | 391 | 946 | 194 | 366 |
(3)已知:

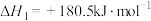

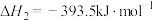
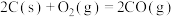
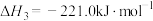
若某反应的平衡常数表达式为
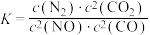 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)根据图示信息写出热化学方程式:

(5)已知:C(s)、CO(g)和
 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为
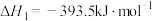


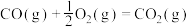
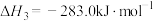
请你根据以上数据,写出C(s)与水蒸气反应生成CO和
 的热化学方程式:
的热化学方程式:
您最近一年使用:0次



