1 . 如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
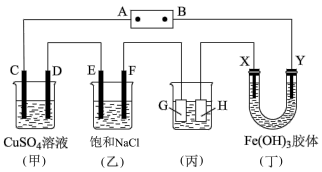
(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则B电极上的反应式为:___________ 。
(2)若装有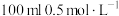 的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为
的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为___________ L,此时形成溶液的
___________ ,欲使溶液恢复到起始状态,可向溶液中加入___________ 。(电解过程忽略体积变化)
A.CuO B. C.
C. D.
D. E.CuO和
E.CuO和
(3)给 的硫酸铜溶液滴加NaOH溶液,开始沉淀时
的硫酸铜溶液滴加NaOH溶液,开始沉淀时
___________ ,沉淀完全时的
___________ 。(已知 的
的 ,当离子浓度≤10-5时认为沉淀完全)
,当离子浓度≤10-5时认为沉淀完全)

(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则B电极上的反应式为:
(2)若装有
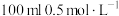 的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为
的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同。甲中D极产生的气体在标准状况下的体积为
A.CuO B.
 C.
C. D.
D. E.CuO和
E.CuO和
(3)给
 的硫酸铜溶液滴加NaOH溶液,开始沉淀时
的硫酸铜溶液滴加NaOH溶液,开始沉淀时

 的
的 ,当离子浓度≤10-5时认为沉淀完全)
,当离子浓度≤10-5时认为沉淀完全)
您最近一年使用:0次
名校
解题方法
2 . 有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
23-24高二·全国·假期作业
3 . 已知由C、H、O元素组成的某化合物9.2 g完全燃烧后可以得到17.6 g CO2和10.8 g H2O,通过计算确定该化合物的实验式_______ 。(写出解题过程)
您最近一年使用:0次
4 . 计算题。
(1)常温下,某溶液中由水电离出的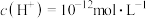 ,则该溶液的
,则该溶液的 为
为________ 。
(2)某温度下,纯水中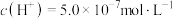 ,则该温度下的
,则该温度下的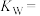
________ ,若温度不变,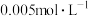 的
的 溶液中,
溶液中,
________ ,由水电离出的
________ 。
(3)将 的盐酸稀释1000倍后,
的盐酸稀释1000倍后, 为
为________ 。
(4)25℃时,将 溶液与
溶液与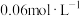 的
的 溶液等体积混合,(忽略混合后体积的变化),求所得溶液的
溶液等体积混合,(忽略混合后体积的变化),求所得溶液的 为
为________ 。
(1)常温下,某溶液中由水电离出的
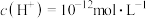 ,则该溶液的
,则该溶液的 为
为(2)某温度下,纯水中
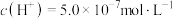 ,则该温度下的
,则该温度下的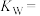
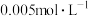 的
的 溶液中,
溶液中,

(3)将
 的盐酸稀释1000倍后,
的盐酸稀释1000倍后, 为
为(4)25℃时,将
 溶液与
溶液与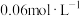 的
的 溶液等体积混合,(忽略混合后体积的变化),求所得溶液的
溶液等体积混合,(忽略混合后体积的变化),求所得溶液的 为
为
您最近一年使用:0次
名校
解题方法
5 . 已知酸度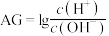
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
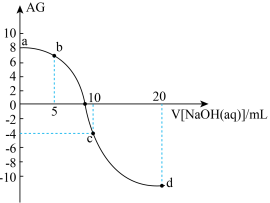
(1)a 点溶液的pH为___________ ,常温下 Kₐ(HA)=___________ 。
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将___________ (填“变大”、“变小”或“不变”)。
(3)c 点加入 NaOH 溶液的体积___________ (填“>”、“<”或“=”)10mL。
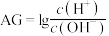
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
(1)a 点溶液的pH为
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将
(3)c 点加入 NaOH 溶液的体积
您最近一年使用:0次
名校
解题方法
6 . 利用所学化学反应原理知识进行计算:
(1)某温度下,纯水中的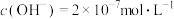 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使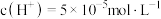 ,则由水电离出的
,则由水电离出的
___________ 。
(2)将99mLpH=2盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
___________ 。
(3)0.2mol/L的 和0.1mol/L NaOH溶液等体积混合后的溶液中:
和0.1mol/L NaOH溶液等体积混合后的溶液中: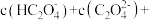
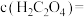
___________ mol/L。
(4)常温下,向100mL0.2mol/L的 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时, ,混合后溶液中
,混合后溶液中
___________ mol/L。
(1)某温度下,纯水中的
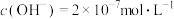 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使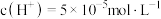 ,则由水电离出的
,则由水电离出的
(2)将99mLpH=2盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的

(3)0.2mol/L的
 和0.1mol/L NaOH溶液等体积混合后的溶液中:
和0.1mol/L NaOH溶液等体积混合后的溶液中: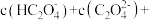
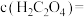
(4)常温下,向100mL0.2mol/L的
 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时, ,混合后溶液中
,混合后溶液中
您最近一年使用:0次
名校
解题方法
7 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:


该反应一般认为通过如下步骤来实现:
反应①

反应②
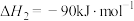
回答下列问题:
(1)
___________ 
(2)有利于提高 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有___________ (填编号)。
A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大 和
和 的初始投料比
的初始投料比
(3)二氧化碳加氢制甲醇的总反应按 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强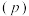 变化如图所示。
变化如图所示。
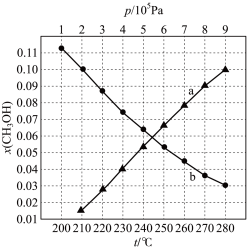
①图中对应在 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是___________ (填“ ”或“
”或“ ”)。判断理由是
”)。判断理由是___________ 。
② 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
③ 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程___________ 。


该反应一般认为通过如下步骤来实现:
反应①


反应②

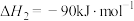
回答下列问题:
(1)


(2)有利于提高
 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大
 和
和 的初始投料比
的初始投料比(3)二氧化碳加氢制甲醇的总反应按
 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强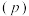 变化如图所示。
变化如图所示。
①图中对应在
 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是 ”或“
”或“ ”)。判断理由是
”)。判断理由是②
 时,反应条件可能为
时,反应条件可能为③
 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程
您最近一年使用:0次
8 . 已知: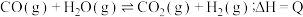 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。
(1)上述反应的化学平衡常数表达式为
___________ 。
(2) 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率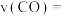
___________ 。
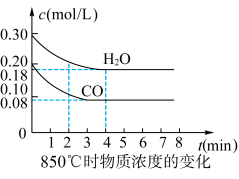
(3)若在 时进行,且
时进行,且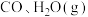 的起始浓度均为
的起始浓度均为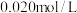 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为___________
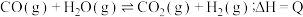 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。温度 | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为

(2)
 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率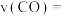

(3)若在
 时进行,且
时进行,且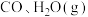 的起始浓度均为
的起始浓度均为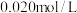 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为
您最近一年使用:0次
名校
解题方法
9 . 某稀硫酸和稀硝酸混合溶液100 mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示,求原混合溶液 和
和 的浓度
的浓度___________ 。(需在答题纸上写出计算过程)

 和
和 的浓度
的浓度
您最近一年使用:0次
10 . 根据已知,回答下列问题。
(1)在 、
、 下,
下, 甲烷燃烧生成
甲烷燃烧生成 和液态水时放热
和液态水时放热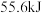 。则表示甲烷燃烧热的热化学方程式为
。则表示甲烷燃烧热的热化学方程式为______ 。
(2)常温常压下,断裂 (理想)气体分子化学键所吸收的能量或形成
(理想)气体分子化学键所吸收的能量或形成 (理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数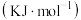
根据键能数据计算以下反应的反应热: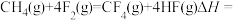
______ 。
(3)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.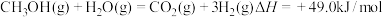
B.
由上述方程式可知, 的燃烧热
的燃烧热______ (填“大于”、“等于”或“小于”)
(4)火箭的常规燃料是液态四氧化二氮和液态肼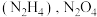 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:


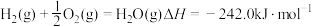
请写出肼和氟气反应的热化学方程式:______ 。
(1)在
 、
、 下,
下, 甲烷燃烧生成
甲烷燃烧生成 和液态水时放热
和液态水时放热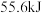 。则表示甲烷燃烧热的热化学方程式为
。则表示甲烷燃烧热的热化学方程式为(2)常温常压下,断裂
 (理想)气体分子化学键所吸收的能量或形成
(理想)气体分子化学键所吸收的能量或形成 (理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数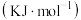
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C-H | 414 | C-F | 489 | H-F | 565 |
| 436 |
| 391 |
| 158 |
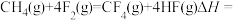
(3)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.
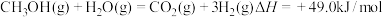
B.

由上述方程式可知,
 的燃烧热
的燃烧热
(4)火箭的常规燃料是液态四氧化二氮和液态肼
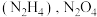 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。已知:


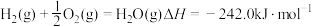
请写出肼和氟气反应的热化学方程式:
您最近一年使用:0次






