1 . 酸碱盐等电解质溶液中存在的电离平衡、水解平衡和沉淀溶解平衡都与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答下列问题:
(1) 水溶液显
水溶液显_______ 性(填“酸”、“碱”或“中”),原因是_______ (用离子方程式表示)。
(2)用离子方程式表示泡沫灭火器的工作原理_______ 。
(3)物质的量浓度相同的下列溶液:① ②
② ③
③ ④
④ ,其中
,其中 由大到小的顺序是
由大到小的顺序是_______ (填序号)。
(4)25℃时, 的盐酸和
的盐酸和 的NaOH溶液混合后溶液
的NaOH溶液混合后溶液 (忽略溶液混合时体积的变化),则
(忽略溶液混合时体积的变化),则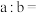
_______ 。
(5)25℃时,某溶液中 白的浓度为
白的浓度为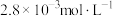 ,使
,使 开始沉淀的
开始沉淀的
_______ 。(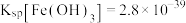 )
)
(6)25℃时,将: 溶液与
溶液与 溶液等体积混合,反应后的溶液中
溶液等体积混合,反应后的溶液中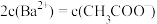 ,用含a和b的代数式表示醋酸的电离常数
,用含a和b的代数式表示醋酸的电离常数
_______ 。
(1)
 水溶液显
水溶液显(2)用离子方程式表示泡沫灭火器的工作原理
(3)物质的量浓度相同的下列溶液:①
 ②
② ③
③ ④
④ ,其中
,其中 由大到小的顺序是
由大到小的顺序是(4)25℃时,
 的盐酸和
的盐酸和 的NaOH溶液混合后溶液
的NaOH溶液混合后溶液 (忽略溶液混合时体积的变化),则
(忽略溶液混合时体积的变化),则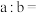
(5)25℃时,某溶液中
 白的浓度为
白的浓度为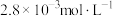 ,使
,使 开始沉淀的
开始沉淀的
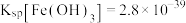 )
)(6)25℃时,将:
 溶液与
溶液与 溶液等体积混合,反应后的溶液中
溶液等体积混合,反应后的溶液中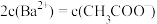 ,用含a和b的代数式表示醋酸的电离常数
,用含a和b的代数式表示醋酸的电离常数
您最近一年使用:0次
名校
2 . 太空很神秘,水的世界也深不可测,从水作溶剂、水分子运动到水的电离、水与活泼金属反应等等。结合书本知识,回答下列问题:
(1)标准状况下, 的
的 溶液的
溶液的
_______ (填“>”“<”或“=”,下同)12,该温度下,水的离子积常数
_______ 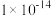 。
。
(2)某温度下,纯水中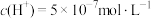 ,则此时纯水中的
,则此时纯水中的
_______  ;若温度不变,滴入稀硫酸使
;若温度不变,滴入稀硫酸使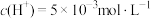 ,则
,则
_______  。
。
(3)T℃下,水的离子积曲线如图所示。_______ (填字母)。
a.T℃小于
b.A点溶液
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将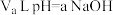 溶液与
溶液与 硫酸混合。
硫酸混合。
若所得混合溶液呈中性,且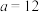 ,
, ,则
,则
_______ ;若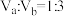 ,且
,且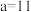 ,
,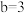 ,则所得混合溶液的
,则所得混合溶液的
_______ 。
(1)标准状况下,
 的
的 溶液的
溶液的

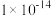 。
。(2)某温度下,纯水中
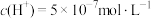 ,则此时纯水中的
,则此时纯水中的
 ;若温度不变,滴入稀硫酸使
;若温度不变,滴入稀硫酸使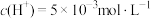 ,则
,则
 。
。(3)T℃下,水的离子积曲线如图所示。

a.T℃小于

b.A点溶液

c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将
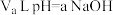 溶液与
溶液与 硫酸混合。
硫酸混合。若所得混合溶液呈中性,且
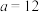 ,
, ,则
,则
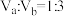 ,且
,且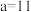 ,
,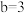 ,则所得混合溶液的
,则所得混合溶液的
您最近一年使用:0次
2022-12-16更新
|
318次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2022-2023学年高二上学期期中考试化学试题
解题方法
3 . 我们的生活离不开化学,化学物质在不同的领域发挥着重要的作用。根据要求回答下列问题:
(1)25℃时,求下列溶液的pH。
①0.05mol/L的H2SO4溶液,其pH为_______ 。
②pH=11的NaOH溶液加水稀释10倍,其pH为_______ 。
③pH=4的醋酸溶液和pH=10的NaOH溶液等体积混合,混合后的pH_______ 7(填“>”“<”“=”)。
(2)常温下,0.1mol/L的盐酸溶液中,由水电离出来氢离子浓度为_______ 。
(3)常温下,0.1mol•L-1CH3COONa溶液的pH=9,计算CH3COOH的电离平衡常数Ka=_______ 。
(1)25℃时,求下列溶液的pH。
①0.05mol/L的H2SO4溶液,其pH为
②pH=11的NaOH溶液加水稀释10倍,其pH为
③pH=4的醋酸溶液和pH=10的NaOH溶液等体积混合,混合后的pH
(2)常温下,0.1mol/L的盐酸溶液中,由水电离出来氢离子浓度为
(3)常温下,0.1mol•L-1CH3COONa溶液的pH=9,计算CH3COOH的电离平衡常数Ka=
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题
(1)Zn(s)+ O2(g)= ZnO(s) ΔH1= -351.1kJ/mol
O2(g)= ZnO(s) ΔH1= -351.1kJ/mol
Hg(l)+ O2(g)= HgO(s) ΔH 2=-90.7kJ/mol
O2(g)= HgO(s) ΔH 2=-90.7kJ/mol
则反应Zn(s)+HgO(s)= ZnO(s)+Hg(l)的焓变为 ΔH =_______ 。
(2)已知下列热化学方程式:
a.2H2(g)+O2(g)=2H2O(l) ΔH =-570kJ/mol ,
b.H2(g)+ O2(g)=H2O(l) ΔH =-285kJ/mol ,
O2(g)=H2O(l) ΔH =-285kJ/mol ,
c.C(s)+ O2(g)=CO (g) ΔH = -55.5kJ/mol ,
O2(g)=CO (g) ΔH = -55.5kJ/mol ,
d.C(s)+O2(g)=CO2(g) ΔH =-196.5kJ/mol
回答下列各问:
①上述反应中属于放热反应的是_______ (填序号)
②H2的燃烧热ΔH =_______
③写出CO燃烧热的热化学方程式_______
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) ΔH 1=+33.5 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH 2=-267 kJ/mol
则2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH =_______ 。
(1)Zn(s)+
 O2(g)= ZnO(s) ΔH1= -351.1kJ/mol
O2(g)= ZnO(s) ΔH1= -351.1kJ/molHg(l)+
 O2(g)= HgO(s) ΔH 2=-90.7kJ/mol
O2(g)= HgO(s) ΔH 2=-90.7kJ/mol则反应Zn(s)+HgO(s)= ZnO(s)+Hg(l)的焓变为 ΔH =
(2)已知下列热化学方程式:
a.2H2(g)+O2(g)=2H2O(l) ΔH =-570kJ/mol ,
b.H2(g)+
 O2(g)=H2O(l) ΔH =-285kJ/mol ,
O2(g)=H2O(l) ΔH =-285kJ/mol , c.C(s)+
 O2(g)=CO (g) ΔH = -55.5kJ/mol ,
O2(g)=CO (g) ΔH = -55.5kJ/mol ,d.C(s)+O2(g)=CO2(g) ΔH =-196.5kJ/mol
回答下列各问:
①上述反应中属于放热反应的是
②H2的燃烧热ΔH =
③写出CO燃烧热的热化学方程式
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) ΔH 1=+33.5 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH 2=-267 kJ/mol
则2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH =
您最近一年使用:0次
5 . 830 K时,在1 L密闭容器中发生下列可逆反应:
 。回答下列问题:
。回答下列问题:
(1)若起始时, ,
, ,4 s后达到平衡,此时CO的转化率为60%
,4 s后达到平衡,此时CO的转化率为60%
①在相同温度下,该反应的平衡常数K=_______ 。
②从反应开始到达到平衡,用 表示的化学反应速率为
表示的化学反应速率为_______ 。
③达到平衡时,反应放出的热量为_______ kJ。
(2)在相同温度下,若起始时 ,
,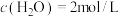 ,反应进行一段时间后,测得
,反应进行一段时间后,测得 的浓度为0.5 mol/L,则此时反应是否达到平衡状态:
的浓度为0.5 mol/L,则此时反应是否达到平衡状态:_______ (填“是”或“否”),此时v(正)_______ v(逆)(填“大于”“小于”或“等于”)。
(3)若升高温度,该反应的平衡常数_______ (填“增大”“减小”或“不变”)。

 。回答下列问题:
。回答下列问题:(1)若起始时,
 ,
, ,4 s后达到平衡,此时CO的转化率为60%
,4 s后达到平衡,此时CO的转化率为60%①在相同温度下,该反应的平衡常数K=
②从反应开始到达到平衡,用
 表示的化学反应速率为
表示的化学反应速率为③达到平衡时,反应放出的热量为
(2)在相同温度下,若起始时
 ,
, ,反应进行一段时间后,测得
,反应进行一段时间后,测得 的浓度为0.5 mol/L,则此时反应是否达到平衡状态:
的浓度为0.5 mol/L,则此时反应是否达到平衡状态:(3)若升高温度,该反应的平衡常数
您最近一年使用:0次
2022-11-17更新
|
237次组卷
|
3卷引用:黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题
名校
6 . 计算25 ℃时下列溶液的pH:
(1)1 mL pH=2的 溶液加水稀释至100 mL,pH=
溶液加水稀释至100 mL,pH=_______ ;
(2)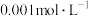 的盐酸,pH=
的盐酸,pH=_______ ;
(3) 的NaOH溶液,pH=
的NaOH溶液,pH=_______ ;
(1)1 mL pH=2的
 溶液加水稀释至100 mL,pH=
溶液加水稀释至100 mL,pH=(2)
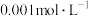 的盐酸,pH=
的盐酸,pH=(3)
 的NaOH溶液,pH=
的NaOH溶液,pH=
您最近一年使用:0次
2022-10-06更新
|
386次组卷
|
2卷引用:黑龙江省佳木斯市第八中学2021-2022学年高二下学期开学考试化学试题
解题方法
7 . 回答下列问题:
(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4 g H2O和8.8g CO2,消耗氧气6.72 L(标准状况下)。则该物质中各元素的原子个数比是________ 。
(2)质谱仪测定有机化合物A的相对分子质量为46,则该物质的分子式是________ 。
(3)根据价键理论,预测A的可能结构并写出结构简式:________ 、________ 。
【结构式的确定】
(4)经测定,有机物A的核磁共振氢谱如图所示,则A的结构简式为________ 。官能团名称是________ 。

(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4 g H2O和8.8g CO2,消耗氧气6.72 L(标准状况下)。则该物质中各元素的原子个数比是
(2)质谱仪测定有机化合物A的相对分子质量为46,则该物质的分子式是
(3)根据价键理论,预测A的可能结构并写出结构简式:
【结构式的确定】
(4)经测定,有机物A的核磁共振氢谱如图所示,则A的结构简式为

您最近一年使用:0次
解题方法
8 . 反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,氨气减少了0.12mol。求:
4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,氨气减少了0.12mol。求:
(1)1min内,以氨气表示的化学反应速率_______ 。
(2)1min内,以氧气表示的化学反应速率_______ 。
(3)1min内,用水表示的化学反应速率_______ 。
(4)分别用NH3、O2、NO、H2O表示的化学反应速率之比为_______ 。
 4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,氨气减少了0.12mol。求:
4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,氨气减少了0.12mol。求:(1)1min内,以氨气表示的化学反应速率
(2)1min内,以氧气表示的化学反应速率
(3)1min内,用水表示的化学反应速率
(4)分别用NH3、O2、NO、H2O表示的化学反应速率之比为
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)温室气体的利用是当前环境和能源领域的研究热点,CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1
反应②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1
反应③CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
已知: O2(g)+H2(g)
O2(g)+H2(g) H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=
H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=_______ kJ·mol-1。
(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa,32.0gN2H4在氧气中完全燃烧生成水蒸气和氮气,放出热量624kJ(25°C),N2H4完全燃烧反应的热化学方程式是_______ 。
(1)温室气体的利用是当前环境和能源领域的研究热点,CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1反应②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1反应③CH4(g)+
 O2(g)
O2(g) CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1已知:
 O2(g)+H2(g)
O2(g)+H2(g) H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=
H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa,32.0gN2H4在氧气中完全燃烧生成水蒸气和氮气,放出热量624kJ(25°C),N2H4完全燃烧反应的热化学方程式是
您最近一年使用:0次
名校
解题方法
10 . 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和Imol空气,此时活塞的位置如图所示。
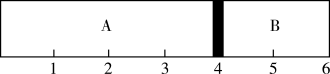
(1)A室混合气体的物质的量为_______ ,所含分子总数为_______ 。
(2)实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压条件下氦气密度的_______ 倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在_______ 刻度,容器内气体压强与反应前气体压强之比为_______ 。

(1)A室混合气体的物质的量为
(2)实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压条件下氦气密度的
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在
您最近一年使用:0次



