名校
解题方法
1 . 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
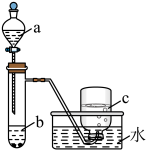
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。_______ 。硝酸所表现出的化学性质主要有_______
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是_______ g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则
①反应结束后的溶液中 、
、 的物质的量之比
的物质的量之比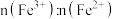 为
为_______ 。
②标准状况下,计算生成NO气体的体积_______ 。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol
 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则①反应结束后的溶液中
 、
、 的物质的量之比
的物质的量之比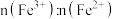 为
为②标准状况下,计算生成NO气体的体积
您最近一年使用:0次
2023-04-19更新
|
172次组卷
|
2卷引用:湖南省岳阳市岳汨联考2023-2024学年高二下学期5月月考化学试题
名校
2 . 按要求填空。
(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为___________ ,微粒之间的作用力为___________ 。
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 (如图1)的结构相似,该晶体储氢后的化学式应为
(如图1)的结构相似,该晶体储氢后的化学式应为___________ 。
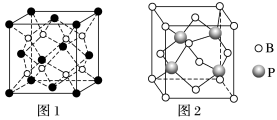
(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为___________ 。
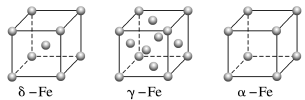
(4)铁有δ、γ、α三种同素异形体,δ−Fe晶胞参数为acm,则铁原子半径为___________ (假设原子为刚性球体);δ、α两种晶胞中铁原子的配位数之比为___________ 。
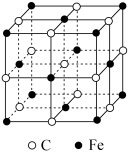
(5)奥氏体是碳溶解在γ−Fe中形成的一种间隙固溶体,无磁性,其晶胞如图所示,若晶体密度为ρg∙cm−3,则晶胞中最近的两个碳原子的距离为___________ pm(阿伏加德罗常数的值用 表示,写出计算式即可)。
表示,写出计算式即可)。
(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与
 (如图1)的结构相似,该晶体储氢后的化学式应为
(如图1)的结构相似,该晶体储氢后的化学式应为
(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为
(4)铁有δ、γ、α三种同素异形体,δ−Fe晶胞参数为acm,则铁原子半径为

(5)奥氏体是碳溶解在γ−Fe中形成的一种间隙固溶体,无磁性,其晶胞如图所示,若晶体密度为ρg∙cm−3,则晶胞中最近的两个碳原子的距离为
 表示,写出计算式即可)。
表示,写出计算式即可)。
您最近一年使用:0次
2023-04-18更新
|
334次组卷
|
2卷引用:湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题
名校
解题方法
3 . 根据要求,回答下列问题:
(1)某温度下,纯水中的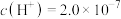 mol·L
mol·L ,则该温度时的水的离子积
,则该温度时的水的离子积
_______ ;保持温度不变,滴入稀盐酸使溶液中的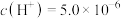 mol·L
mol·L ,则溶液中的
,则溶液中的 为
为_______ mol·L ;
;
(2)将浓度均为0.1 mo/L的 和
和 等体积混合,溶液
等体积混合,溶液 。分析该溶液中离子浓度从大到小依次是:
。分析该溶液中离子浓度从大到小依次是:_______ ;
(3)将 溶液蒸干、灼烧,最后所得的固体的主要成份是
溶液蒸干、灼烧,最后所得的固体的主要成份是_______ ;
(4)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是_______ ;
(5)已知:a. ,
, ,
,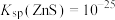 ,
,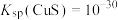
b.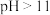 时,
时, 会转化为
会转化为
c.离子浓度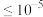 mol/L,即认为其完全沉淀
mol/L,即认为其完全沉淀
①若加入 来沉淀
来沉淀 和
和 ,当溶液中ZnS和CuS共存时,
,当溶液中ZnS和CuS共存时,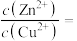
_______ 。
②若加入NaOH溶液来调节pH,使 和
和 完全沉淀,pH应满足的条件为
完全沉淀,pH应满足的条件为_______ 。
(1)某温度下,纯水中的
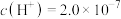 mol·L
mol·L ,则该温度时的水的离子积
,则该温度时的水的离子积
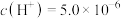 mol·L
mol·L ,则溶液中的
,则溶液中的 为
为 ;
;(2)将浓度均为0.1 mo/L的
 和
和 等体积混合,溶液
等体积混合,溶液 。分析该溶液中离子浓度从大到小依次是:
。分析该溶液中离子浓度从大到小依次是:(3)将
 溶液蒸干、灼烧,最后所得的固体的主要成份是
溶液蒸干、灼烧,最后所得的固体的主要成份是(4)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
(5)已知:a.
 ,
, ,
,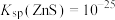 ,
,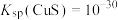
b.
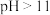 时,
时, 会转化为
会转化为
c.离子浓度
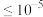 mol/L,即认为其完全沉淀
mol/L,即认为其完全沉淀①若加入
 来沉淀
来沉淀 和
和 ,当溶液中ZnS和CuS共存时,
,当溶液中ZnS和CuS共存时,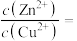
②若加入NaOH溶液来调节pH,使
 和
和 完全沉淀,pH应满足的条件为
完全沉淀,pH应满足的条件为
您最近一年使用:0次
名校
解题方法
4 .  超干重整
超干重整 技术可得到富含CO的化工原料。
技术可得到富含CO的化工原料。
(1)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应 进行相同时间后,
进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。

a点所代表的状态_______ (填“是”或“不是”)平衡状态;b点 的转化率高于c点,原因是
的转化率高于c点,原因是_______ 。
(2)恒温恒容刚性密闭容器中, 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。
。
①研究表明CO的生成速率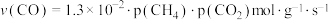 ,某时刻测得
,某时刻测得 ,则
,则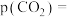
_______ kPa,
_______  。
。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式 为
_______  。(用各物质的分压代替物质的量浓度计算)
。(用各物质的分压代替物质的量浓度计算)
 超干重整
超干重整 技术可得到富含CO的化工原料。
技术可得到富含CO的化工原料。(1)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应
 进行相同时间后,
进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。
a点所代表的状态
 的转化率高于c点,原因是
的转化率高于c点,原因是(2)恒温恒容刚性密闭容器中,
 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。
。①研究表明CO的生成速率
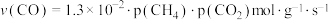 ,某时刻测得
,某时刻测得 ,则
,则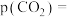

 。
。②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的

 。(用各物质的分压代替物质的量浓度计算)
。(用各物质的分压代替物质的量浓度计算)
您最近一年使用:0次
2022-10-09更新
|
323次组卷
|
2卷引用:湖南省常德市临澧县第一中学2022-2023学年高二上学期第一次阶段性考试化学试题
解题方法
5 . 如下图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
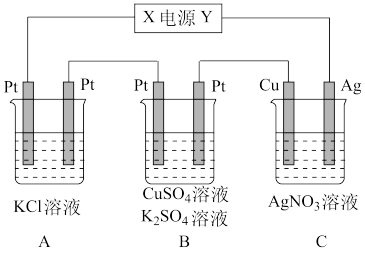
(1)电源电极X的名称为___________ 。
(2)pH变化:A___________ (填“增大”、“减小”或“不变),B___________ ,C___________ 。
(3)通电5min后,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为___________ (设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200mL,电解后,溶液中OH-的物质的量浓度为___________ (设电解前后溶液体积无变化)。

(1)电源电极X的名称为
(2)pH变化:A
(3)通电5min后,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为
(4)若A中KCl溶液的体积也是200mL,电解后,溶液中OH-的物质的量浓度为
您最近一年使用:0次
解题方法
6 . 氙和氟气反应,生成含有XeF2和XeF4的固体混合物,现用两份等质量的此种固体混合物,分别做下面的化学分析:
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数___________ 。(提示:XeF2与H2O仅发生氧化还原反应;XeF4与H2O反应时,有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应。)
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数
您最近一年使用:0次
7 . 在恒温、恒容的密闭容器中,混合气体A、B、C的物质的量浓度(c)与时间(t)的关系如下表所示:
请填空:
(1)前2min内,v(B)=___________ 。
(2)6min- 8min若只改变了反应体系中某一种物质的浓度,则应为___________ (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为___________ mol·L-1
(3)如果在相同条件下,要使该反应从逆反应方向开始进行,且达平衡时与第4min时各物质的物质的量浓度完全相同,则加入B的物质的量浓度的取值范围为___________ 。
| tc | 初始 | 2min | 4min | 6min | 8min |
| c(A)(mol·L-1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
| c(B)(mol·L-1) | 1.56 | 2.16 | 2.56 | 2.56. | 2.16 |
| c(C)(mol·L-1) | 0.39 | 0.54 | 0.64. | 0.64 | 1.54 |
(1)前2min内,v(B)=
(2)6min- 8min若只改变了反应体系中某一种物质的浓度,则应为
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为
(3)如果在相同条件下,要使该反应从逆反应方向开始进行,且达平衡时与第4min时各物质的物质的量浓度完全相同,则加入B的物质的量浓度的取值范围为
您最近一年使用:0次
8 . 现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4. 48L NO(标准状况)。向所得溶液中加入一定体积1. 0mol/LNaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32. 0g固体。试计算:
(1)原混合物中CuO的质量_______ ;
(2)加入NaOH溶液的体积_______ 。
(1)原混合物中CuO的质量
(2)加入NaOH溶液的体积
您最近一年使用:0次
名校
9 . (1)钠、铝、铁是中学化学中常见的三种重要金属。请回答下列问题
①实验室中少量钠通常保存在_______ (填“煤油”或“四氯化碳”)
②铁的一种氧化物俗称“铁红”,用做红色颜料,铁红的化学式是_______ (填“FeO”或“Fe2O3”或“Fe3O4”)
③Al(OH)3能溶于盐酸或氢氧化钠溶液。请写出Al(OH)3与盐酸溶液反应的离子方程式_______
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
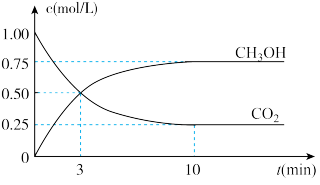
从反应开始到平衡,氢气的平均反应速率v(H2)=_______ mol/(L·min),生成的水的物质的量为_______ mol。
①实验室中少量钠通常保存在
②铁的一种氧化物俗称“铁红”,用做红色颜料,铁红的化学式是
③Al(OH)3能溶于盐酸或氢氧化钠溶液。请写出Al(OH)3与盐酸溶液反应的离子方程式
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,氢气的平均反应速率v(H2)=
您最近一年使用:0次
名校
10 . 化工厂用浓氨水检验氯气管道是否漏气,利用的反应如下:8NH3+3Cl2=N2+xNH4Cl。
(1)方程式中x=_______ 。
(2)作还原剂的物质是_______ (写化学式),氯元素的化合价_______ (填“升高”或“降低”)。
(3)反应中每生成6mol NH4Cl,则消耗Cl2的物质的量至少为_______ mol,转移电子的物质的量为_______ mol。
(1)方程式中x=
(2)作还原剂的物质是
(3)反应中每生成6mol NH4Cl,则消耗Cl2的物质的量至少为
您最近一年使用:0次



