解题方法
1 . 研究化学反应中的能量变化具有重要的意义。回答下列问题:
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+ O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
①由上述热化学方程式可知甲醇的燃烧热△H=____________ 。
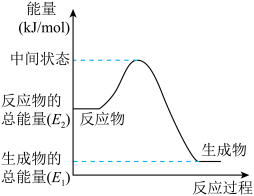
②上述第二个反应的能量变化如图所示,则△H2=___________ k/mol。(用E1、E2的相关式子表示)。.
(2)已知反应N2(g)+3H2(g) 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=________ 。
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是__________ (填化学式)。
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:_____________ 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________ 。
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol①由上述热化学方程式可知甲醇的燃烧热△H=
②上述第二个反应的能量变化如图所示,则△H2=

(2)已知反应N2(g)+3H2(g)
 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近一年使用:0次
名校
解题方法
2 . 有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
名校
3 . 对碳及其氧化物的化学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。用 代替
代替 与燃料
与燃料 反应,既可以提高燃烧效率,又能得到高纯
反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①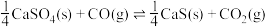
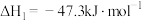
②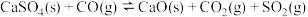
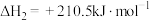
③
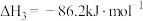
(1)反应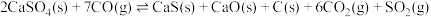 的
的
___________ (用 表示)。
表示)。
(2)向盛有 的真空恒容容器中充入
的真空恒容容器中充入 ,反应①于
,反应①于 达到平衡(
达到平衡( ),平衡时
),平衡时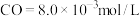 ,
, 的平衡转化率为
的平衡转化率为___________ 。(忽略副反应,结果保留2位有效数字)。
(3)其它条件不变时,升高温度戒缩小容器的体积,均能使反应②的平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P,缩小容器体积)变化而变化的示意图_______ :
(4)某温度下,测得 的
的 溶液的
溶液的 为11,将该温度下
为11,将该温度下 的
的 溶液
溶液 与
与 的
的 溶液,
溶液, 混合,通过计算填写以下不同情况时两溶液的体积比:
混合,通过计算填写以下不同情况时两溶液的体积比:
①若所得混合溶液为中性,且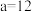 ,
,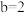 ,则
,则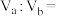
___________ 。
②若所得混合溶液为中性,且 ,则
,则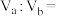
___________ 。
③若所得混合溶液的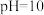 ,且
,且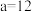 ,
,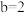 ,则
,则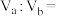
___________ 。
 代替
代替 与燃料
与燃料 反应,既可以提高燃烧效率,又能得到高纯
反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。①
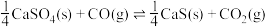
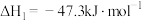
②
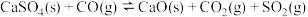
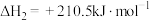
③

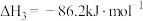
(1)反应
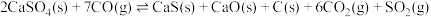 的
的
 表示)。
表示)。(2)向盛有
 的真空恒容容器中充入
的真空恒容容器中充入 ,反应①于
,反应①于 达到平衡(
达到平衡( ),平衡时
),平衡时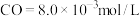 ,
, 的平衡转化率为
的平衡转化率为(3)其它条件不变时,升高温度戒缩小容器的体积,均能使反应②的平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P,缩小容器体积)变化而变化的示意图

(4)某温度下,测得
 的
的 溶液的
溶液的 为11,将该温度下
为11,将该温度下 的
的 溶液
溶液 与
与 的
的 溶液,
溶液, 混合,通过计算填写以下不同情况时两溶液的体积比:
混合,通过计算填写以下不同情况时两溶液的体积比:①若所得混合溶液为中性,且
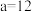 ,
,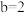 ,则
,则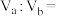
②若所得混合溶液为中性,且
 ,则
,则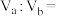
③若所得混合溶液的
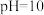 ,且
,且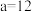 ,
,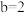 ,则
,则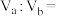
您最近一年使用:0次
名校
解题方法
4 . 一定在条件下,容积为2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应: ,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:
,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:
(1)平衡时,L和M的转化率比值为___________ 。
(2)前10s内用M表示的化学反应速率为___________ 。
(3)化学方程式中x值为___________ 。
(4)在恒温恒容条件下,往容器中加入1mol氦气,反应速率___________ (填“增大”、“减小”或“不变”)。
(5)平衡时压强与初始压强之比为___________ (整数比)。
 ,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:
,10s末平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。计算:(1)平衡时,L和M的转化率比值为
(2)前10s内用M表示的化学反应速率为
(3)化学方程式中x值为
(4)在恒温恒容条件下,往容器中加入1mol氦气,反应速率
(5)平衡时压强与初始压强之比为
您最近一年使用:0次
2023-10-26更新
|
108次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期10月月考化学试题
解题方法
5 . 已知:
①H2O(g)=H2(g)+ O2(g) ΔH=+241.8kJ/mol
O2(g) ΔH=+241.8kJ/mol
②C(s)+ O2(g)=CO(g) ΔH=-110.5kJ/mol
O2(g)=CO(g) ΔH=-110.5kJ/mol
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是_______ (填序号)。
(2)表示C的燃烧热的热化学方程式为_______ (填序号)。
(3)10gH2完全燃烧生成水蒸气,放出的热量为_______ kJ。
(4)写出CO燃烧的热化学方程式:_______ 。
(5)FeS2焙烧产生的 可用于制硫酸。已知
可用于制硫酸。已知 、
、 时:
时:
2SO2(g)+O2(g) 2SO3(g) ∆H1=-197kJ∙mol-1
2SO3(g) ∆H1=-197kJ∙mol-1
H2O(g) H2O(l) ∆H2=-44kJ∙mol-1
H2O(l) ∆H2=-44kJ∙mol-1
2SO2(g)+O2(g)+2H2O(g)= 2H2SO4(l) ∆H3=-545kJ∙mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_______ 。
①H2O(g)=H2(g)+
 O2(g) ΔH=+241.8kJ/mol
O2(g) ΔH=+241.8kJ/mol②C(s)+
 O2(g)=CO(g) ΔH=-110.5kJ/mol
O2(g)=CO(g) ΔH=-110.5kJ/mol③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是
(2)表示C的燃烧热的热化学方程式为
(3)10gH2完全燃烧生成水蒸气,放出的热量为
(4)写出CO燃烧的热化学方程式:
(5)FeS2焙烧产生的
 可用于制硫酸。已知
可用于制硫酸。已知 、
、 时:
时:2SO2(g)+O2(g)
 2SO3(g) ∆H1=-197kJ∙mol-1
2SO3(g) ∆H1=-197kJ∙mol-1H2O(g)
 H2O(l) ∆H2=-44kJ∙mol-1
H2O(l) ∆H2=-44kJ∙mol-12SO2(g)+O2(g)+2H2O(g)= 2H2SO4(l) ∆H3=-545kJ∙mol-1
则SO3(g)与H2O(l)反应的热化学方程式是
您最近一年使用:0次
6 . 某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品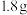 ,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重
,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重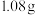 和
和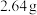 。试求该有机物的实验式和分子式
。试求该有机物的实验式和分子式___________ 。
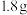 ,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重
,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重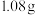 和
和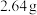 。试求该有机物的实验式和分子式
。试求该有机物的实验式和分子式
您最近一年使用:0次
名校
解题方法
7 . 已知:NO(g)+CO2(g)=NO2(g)+CO(g)ΔH1;
2CO(g)+O2(g)=2CO2(g)ΔH2
则2NO2(g) 2NO(g)+O2(g)的反应热ΔH=
2NO(g)+O2(g)的反应热ΔH=__ (用含△H1,△H2的代数式表示)。
2CO(g)+O2(g)=2CO2(g)ΔH2
则2NO2(g)
 2NO(g)+O2(g)的反应热ΔH=
2NO(g)+O2(g)的反应热ΔH=
您最近一年使用:0次
8 . (1)H2S溶于水的电离方程式为______________ ;___________ 。
①向H2S溶液中加入CuSO4溶液时,电离平衡向___________ 移动(填写“左”或“右”),c(H+)___________ , c(S2-)___________ 。(填写“增大”、“减小”或“不变”,下同) (提示:CuS难溶于水)
②向H2S溶液中加入NaOH固体时,电离平衡向___________ 移动,c(H+)___________ , c(S2-)___________ 。
③若将H2S溶液加热至沸腾,c(H2S)___________ 。
(2)某温度下,纯水中的c(H+)=2.0×10-7 mol·L-1,则此时溶液的c(OH-)是___________ mol·L-1,这种水显___________ (填“酸”“碱”或“中”)性,其理由是___________ ;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=___________ mol·L-1。
(3) 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
①准确称取烧碱样品2.50 g,将样品配成250 mL的待测液。
②滴定管使用前洗涤后应___________ 。
③取10.00 mL待测液,用___________ (填仪器名称)量取注入锥形瓶中。
④用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________ 直到滴定终点。
⑤根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度为___________ 。
⑥根据上述测定数据,分析得到合理数据,计算烧碱的纯度为___________ 。
⑦若锥形瓶中的溶液在滴定过程中溅出,结果偏___________ ;酸式滴定管装液后尖嘴部位有气泡,滴定后气泡消失,结果偏___________ 。
①向H2S溶液中加入CuSO4溶液时,电离平衡向
②向H2S溶液中加入NaOH固体时,电离平衡向
③若将H2S溶液加热至沸腾,c(H2S)
(2)某温度下,纯水中的c(H+)=2.0×10-7 mol·L-1,则此时溶液的c(OH-)是
(3) 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
①准确称取烧碱样品2.50 g,将样品配成250 mL的待测液。
②滴定管使用前洗涤后应
③取10.00 mL待测液,用
④用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
⑤根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度为
| 滴定 次数 | 待测液体 积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 10.40 |
| 第二次 | 10.00 | 4.00 | 14.10 |
| 第三次 | 10.00 | 4.20 | 15.70 |
⑥根据上述测定数据,分析得到合理数据,计算烧碱的纯度为
⑦若锥形瓶中的溶液在滴定过程中溅出,结果偏
您最近一年使用:0次
名校
解题方法
9 . (1)pH相同的下列物质的溶液①(NH4)2SO4;②NH4HSO4;③NH4NO3,铵根离子浓度由小到大的顺序是__________ (填序号)。
(2)同浓度的下列溶液:①HCl;②NH4Cl;③Na2CO3;④NaHCO3,其中pH由大到小的顺序是______________ 。
(3)物质的量浓度相同的①盐酸、②硫酸溶液、元③醋酸(CH3COOH)溶液各100mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是___________ 。
(4)等体积的CH3COOH与NaOH溶液反应后溶液中存在c(Na+)<c(CH3COO-),该溶液呈______ 性(填“酸”、“碱”或“中”),反应前c(NaOH)_____ c(CH3COOH)(填“>”“<”或“=”)
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为____ mol/L,此时溶液中c(CrO42-)等于_____ mol/L。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(2)同浓度的下列溶液:①HCl;②NH4Cl;③Na2CO3;④NaHCO3,其中pH由大到小的顺序是
(3)物质的量浓度相同的①盐酸、②硫酸溶液、元③醋酸(CH3COOH)溶液各100mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是
(4)等体积的CH3COOH与NaOH溶液反应后溶液中存在c(Na+)<c(CH3COO-),该溶液呈
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
您最近一年使用:0次
2020-11-07更新
|
1001次组卷
|
4卷引用:天津市第一中学2022-2023学年高二上学期月考化学试题
天津市第一中学2022-2023学年高二上学期月考化学试题安徽省六安市第一中学2020-2021学年高二上学期第一次段考化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)辽宁省铁岭市昌图县第一高级中学2023-2024学年高二上学期9月考试化学试题
名校
10 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_______ 中溶解,完全溶解后,全部转移至100mL的_______ 中,加蒸馏水至_______ 。
(2)滴定取0.00950mol/L的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应: +6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: I2+2
+6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: I2+2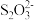 =
=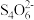 +2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液_______ ,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为_______ %(保留1位小数)。
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
(2)滴定取0.00950mol/L的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:
 +6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: I2+2
+6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: I2+2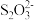 =
=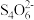 +2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液
+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液
您最近一年使用:0次
2020-09-14更新
|
2481次组卷
|
11卷引用:天津市耀华中学2022-2023学年高二上学期期中调研化学试题
天津市耀华中学2022-2023学年高二上学期期中调研化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题4 酸碱中和滴定鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题山西省介休市第十中学2022-2023学年高二上学期 期中考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题(已下线)专题十三 综合题中的滴定问题(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)05 常考题空5 实验题中常考滴定计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)考点07 物质的量浓度(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型二 实验中常考滴定计算-备战2024年高考化学答题技巧与模板构建



