1 . 常温下, 、HCOOH(甲酸)、二元弱酸
、HCOOH(甲酸)、二元弱酸 的电离常数见下表,下列说法正确的是
的电离常数见下表,下列说法正确的是
 、HCOOH(甲酸)、二元弱酸
、HCOOH(甲酸)、二元弱酸 的电离常数见下表,下列说法正确的是
的电离常数见下表,下列说法正确的是| 分子式 |  | HCOOH |  |
| 电离常数 |  | 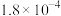 |  、 、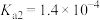 |
A.等物质的量浓度的几种溶液pH大小关系: |
B.HCOONa溶液中滴入少量 ,发生反应 ,发生反应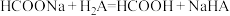 |
C.NaHA溶液中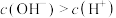 |
D. 的电离常数小于 的电离常数小于 |
您最近一年使用:0次
名校
解题方法
2 . 取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为___________ ;
(2)稀盐酸中的溶质质量分数为___________ ;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为___________ ?(写出计算过程,计算结果精确到0.1%)
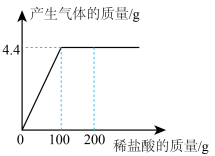
(1)混合物CaCO3中的质量为
(2)稀盐酸中的溶质质量分数为
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为

您最近一年使用:0次
名校
3 . 2SO2(g)+O2(g) 2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
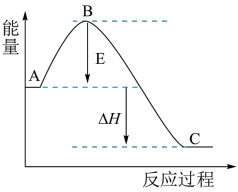
(1)图中A、表示:_____ (填“反应物能量”或“生成物能量 ”)。E的大小对该反应的反应热有无影响?_______ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点_____ (填“升高” “降低”)。
(2)图中ΔH=________ kJ/mol。
(3)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的总反应的ΔH=________ kJ/mol。
(4)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是_________
(5)已知中和热ΔH=-57.3kJ·mol-1,0.5 mol Ba(OH)2和0.5 molH2SO4的反应热ΔH_______ (填“>”“=”或“<”)-57.3kJ·mol-1
 2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
(1)图中A、表示:
(2)图中ΔH=
(3)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的总反应的ΔH=
(4)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是
(5)已知中和热ΔH=-57.3kJ·mol-1,0.5 mol Ba(OH)2和0.5 molH2SO4的反应热ΔH
您最近一年使用:0次
2023-02-21更新
|
257次组卷
|
2卷引用:江西省抚州创新实验学校2021-2022学年高二上学期期末考试化学试题
4 . 已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,Ksp[Mg(OH)2]=4.0×10-12,lg5=0.7。请回答下列问题:
(1)25℃时,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的c(Ag+)为___________ mol·L-1,pH为___________ 。
(2)25℃时,Mg(OH)2饱和溶液___________ (填“能”或“不能”)使石蕊溶液变蓝色。
(1)25℃时,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的c(Ag+)为
(2)25℃时,Mg(OH)2饱和溶液
您最近一年使用:0次
解题方法
5 . 在25 ℃时,有pH为x的盐酸和pH为y的NaOH溶液,取Vx L该盐酸同该NaOH溶液中和,需Vy L NaOH溶液(其中x≤6,y≥8)。问:
(1)若x+y=14, =
=_______ (填数值);
(2)若x+y=13, =
=_______ (填数值);
(3)若x+y>14, =
=_______ (填表达式),且Vx_______ Vy(填“>”、“<”或“=”)。
(1)若x+y=14,
 =
=(2)若x+y=13,
 =
=(3)若x+y>14,
 =
=
您最近一年使用:0次
名校
6 . 在一定温度下,在某4L恒容容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。

(1)该反应的化学方程式为_________ (需要标注M、N的物质状态,且系数化成最简整数)。
(2)比较t2时刻,正、逆反应速率大小:v(正)_________ v(逆)(填“>”“=”或“<”)。
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)_________ mol·L-1·min-1。
(4)该反应的化学平衡常数K=_________ 。
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H_________ 0(填“>”“=”或“<”)。

(1)该反应的化学方程式为
(2)比较t2时刻,正、逆反应速率大小:v(正)
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)
(4)该反应的化学平衡常数K=
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H
您最近一年使用:0次
22-23高二上·全国·课时练习
名校
解题方法
7 . 反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
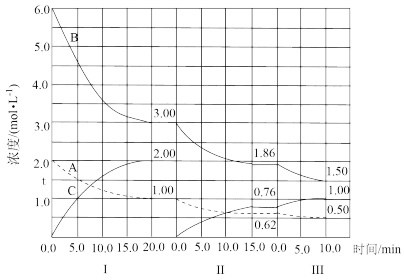
问题:
(1)反应的化学方程式中a∶b∶c为____ 。
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为____ 。
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是____ ,其值是____ 。
(4)由第一次平衡到第二次平衡,平衡向____ 移动,采取的措施是____ 。
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2____ T3(填“<”“>”“=”),判断的理由是____ 。
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
问题:
(1)反应的化学方程式中a∶b∶c为
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是
(4)由第一次平衡到第二次平衡,平衡向
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2
您最近一年使用:0次
2022-10-18更新
|
1095次组卷
|
4卷引用:江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题
江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题(已下线)2.2.3 化学反应速率和化学平衡图像——同步学习必备知识内蒙古包钢第一中学2022-2023学年高二上学期月考化学试题河南省郑州中学2023-2024学年高三上学期第二次月考化学试题
解题方法
8 . 在容积为1.00L的密闭容器中,通入一定量的N2O4,发生反应:N2O4(g) 2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
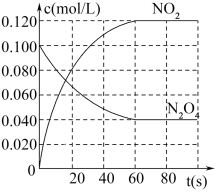
请回答:
(1)60s内,v(N2O4)=___ mol/(L•s)。
(2)若升高温度,混合气体的颜色变深,则正反应是___ (填“放热”或吸热”)反应。
(3)100℃时,该反应的化学平衡常数数值为___ 。
(4)平衡时,N2O4的转化率是___ 。
 2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
请回答:
(1)60s内,v(N2O4)=
(2)若升高温度,混合气体的颜色变深,则正反应是
(3)100℃时,该反应的化学平衡常数数值为
(4)平衡时,N2O4的转化率是
您最近一年使用:0次
2022-09-18更新
|
483次组卷
|
3卷引用:江西省宜春市丰城市东煌学校2023-2024学年高二上学期11月期中化学试题
9 . 填空
(1)从1L 溶液中取出100mL,向其中加入200mL
溶液中取出100mL,向其中加入200mL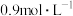 的
的 溶液恰好使
溶液恰好使 完全沉淀,则原溶液中
完全沉淀,则原溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(2)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是_______ 。
(3)标况下,1体积水中溶解了V体积HCl气体,所得溶液的密度为 ,所得溶液的物质的量浓度为
,所得溶液的物质的量浓度为_______ 。
(1)从1L
 溶液中取出100mL,向其中加入200mL
溶液中取出100mL,向其中加入200mL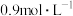 的
的 溶液恰好使
溶液恰好使 完全沉淀,则原溶液中
完全沉淀,则原溶液中 的物质的量浓度为
的物质的量浓度为(2)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是
(3)标况下,1体积水中溶解了V体积HCl气体,所得溶液的密度为
 ,所得溶液的物质的量浓度为
,所得溶液的物质的量浓度为
您最近一年使用:0次
名校
10 . 在一定温度下,向体积为2L的恒容密闭容器中充入一定量的A、B发生化学反应(除物质D为固体外,其余的物质均为气体),各物质的含量随时间的变化情况如图所示,请回答下列问题:
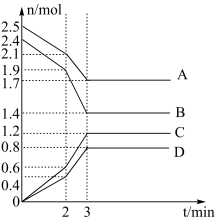
(1)写出该反应的化学方程式:___________ ,0~2min内用C表示的化学反应速率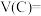
___ 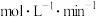 。
。
(2)该反应在2min时改变了某一条件,则该条件可能为___________ 。
(3)下列能说明反应达到平衡的是___________(填标号)。
(4)反应至某时刻,此时压强与初始压强的比值为43:49,则此时B物质的转化率为_________ %(保留三位有效数字),此时该反应________ (填“是”或“否”)达到平衡。

(1)写出该反应的化学方程式:
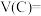
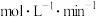 。
。(2)该反应在2min时改变了某一条件,则该条件可能为
(3)下列能说明反应达到平衡的是___________(填标号)。
| A.反应体系内气体的压强不再发生变化 |
| B.反应体系内气体的密度不再发生变化 |
| C.A与C的浓度之比为6:4 |
D.当有 被消耗的同时有 被消耗的同时有 被消耗 被消耗 |
您最近一年使用:0次
2022-07-28更新
|
585次组卷
|
2卷引用:江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题



