1 . 下列关于热化学反应的描述正确的是
A.稀盐酸和 稀溶液反应的中和反应反应热 稀溶液反应的中和反应反应热 ,则1mol的稀硫酸与足量氢氧化钡溶液反应放出的热量为 ,则1mol的稀硫酸与足量氢氧化钡溶液反应放出的热量为 |
B. 的燃烧热为 的燃烧热为 ,则反应2H2O(l)=2H2(g)+O2(g)的 ,则反应2H2O(l)=2H2(g)+O2(g)的 |
| C.放热反应比吸热反应容易发生 |
| D.丙烷燃烧生成水和二氧化碳所放出的热量是丙烷的燃烧热 |
您最近半年使用:0次
2 . 手持技术测定中和反应反应热的装置和测定结果如图。假设:一次性加入 溶液。已知:混合溶液的密度为
溶液。已知:混合溶液的密度为 ,比热容为
,比热容为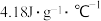 。下列相关说法正确的是
。下列相关说法正确的是
 溶液。已知:混合溶液的密度为
溶液。已知:混合溶液的密度为 ,比热容为
,比热容为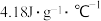 。下列相关说法正确的是
。下列相关说法正确的是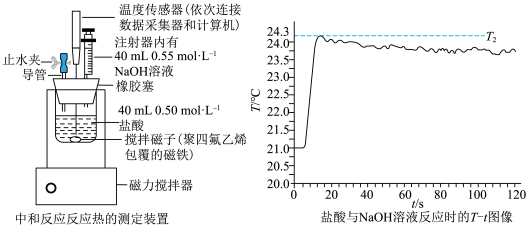
A.分批加入 溶液,反应更充分,测量结果更准确 溶液,反应更充分,测量结果更准确 |
| B.将磁子表面的聚四氟乙烯换成铁,测量更精准 |
C.本实验中测定的中和反应反应热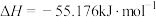 |
D.若将盐酸换成同浓度、同体积的醋酸, 将偏小 将偏小 |
您最近半年使用:0次
解题方法
3 . 某实验小组学生用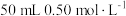 的稀硝酸与
的稀硝酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应的反应热。下列说法不正确
溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应的反应热。下列说法不正确
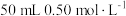 的稀硝酸与
的稀硝酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应的反应热。下列说法不正确
溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应的反应热。下列说法不正确
| A.图中实验装置缺少玻璃搅拌器 |
| B.若用铜丝做成搅拌器,求得的反应热偏大 |
C.把稀硝酸体积改为 ,所求中和反应的反应热改变 ,所求中和反应的反应热改变 |
| D.烧杯间填满碎纸条的作用是减少实验过程中的热量损失,减小实验误差 |
您最近半年使用:0次
解题方法
4 . 下列化学反应表示正确的是
A.稀 和氨水的稀溶液反应的热化学方程式为: 和氨水的稀溶液反应的热化学方程式为: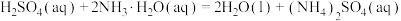 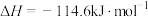 |
B.火箭发射时 和 和 反应: 反应: |
C.锂离子电池放电时的正极反应: |
D.两性氧化物 溶于NaOH溶液的反应: 溶于NaOH溶液的反应: |
您最近半年使用:0次
解题方法
5 . 下列依据热化学方程式得出的结论正确的是
A.若  ,则 ,则 燃烧热为 燃烧热为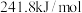 |
B.已知  ,则 ,则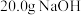 固体与稀盐酸完全中和,放出28.7kJ的热量 固体与稀盐酸完全中和,放出28.7kJ的热量 |
C.已知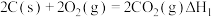 ; ; ,则 ,则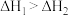 |
D.若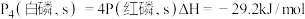 ,则红磷比白磷稳定 ,则红磷比白磷稳定 |
您最近半年使用:0次
名校
解题方法
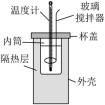
6 . 利用如图所示装置测定中和热的实验步骤如下:
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,用温度计测出其温度;
③将NaOH溶液分次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的平均温度;
④重复测量2~3次,准确记录数据。
(1)上述步骤中有两点错误,分别是____ 、____ 。
(2)____ (填“能”或“不能”)用相同形状的细铁丝代替玻璃搅拌器,理由是____ 。
(3)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1稀盐酸恰好完全反应,其反应热分别为 H1、
H1、 H2、
H2、 H3,则
H3,则 H1、
H1、 H2、
H2、 H3的大小关系为
H3的大小关系为____ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1。为了计算中和热,某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热 H=
H=____ (结果保留1位小数)。
(5)上述实验结果与中和热数值57.3kJ·mol-1有偏差,产生偏差的原因不可能为___ (填序号)。
①实验装置保温、隔热效果差 ②用量筒量取盐酸溶液体积时仰视读数
③分多次把NaOH溶液倒入内筒中 ④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,用温度计测出其温度;
③将NaOH溶液分次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的平均温度;
④重复测量2~3次,准确记录数据。
(1)上述步骤中有两点错误,分别是
(2)
(3)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1稀盐酸恰好完全反应,其反应热分别为
 H1、
H1、 H2、
H2、 H3,则
H3,则 H1、
H1、 H2、
H2、 H3的大小关系为
H3的大小关系为(4)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1。为了计算中和热,某学生实验记录数据如表:
| 起始温度t1/℃ | 终止温度t2/℃ | ||
| 实验序号 | 盐酸 | 氢氧化钠溶液 | 混合溶液 |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
 H=
H=(5)上述实验结果与中和热数值57.3kJ·mol-1有偏差,产生偏差的原因不可能为
①实验装置保温、隔热效果差 ②用量筒量取盐酸溶液体积时仰视读数
③分多次把NaOH溶液倒入内筒中 ④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
您最近半年使用:0次
7 . 请回答下列问题:
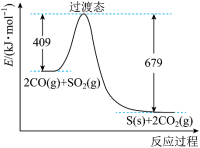
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16g S(s),该反应_______ (填“放出”或“吸收”)的热量为_______ kJ。_______ 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每转移1mole-,放热44.4kJ,写出该反应的热化学方程式_______ 。
(4)近年来空气污染日益严重,原因之一是汽车尾气中含有NO、NO2、CO等气体。为消除汽车尾气的污染,可采取:NO和CO在催化转换器中发生如下反应:2NO(g)+2CO (g)=2CO2(g)+N2(g) H1 ;
H1 ;
已知:2NO(g)+O2 (g)=2NO2(g) H2 ;
H2 ;
CO的燃烧热为 H3;
H3;
NO2与CO发生反应的热化学方程式:2NO2(g)+4CO (g)=4CO2(g)+N2(g) H =
H = _______ (用 H1、
H1、 H2、
H2、 H3表示)。
H3表示)。
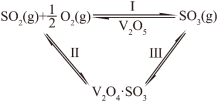
(5)工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3.V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如下:
①由此计算反应Ⅰ的 H =
H = _______ kJ/mol。
②反应Ⅱ、Ⅲ的化学方程式为_______ 、_______ 。
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16g S(s),该反应
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每转移1mole-,放热44.4kJ,写出该反应的热化学方程式
(4)近年来空气污染日益严重,原因之一是汽车尾气中含有NO、NO2、CO等气体。为消除汽车尾气的污染,可采取:NO和CO在催化转换器中发生如下反应:2NO(g)+2CO (g)=2CO2(g)+N2(g)
 H1 ;
H1 ;已知:2NO(g)+O2 (g)=2NO2(g)
 H2 ;
H2 ;CO的燃烧热为
 H3;
H3;NO2与CO发生反应的热化学方程式:2NO2(g)+4CO (g)=4CO2(g)+N2(g)
 H =
H =  H1、
H1、 H2、
H2、 H3表示)。
H3表示)。(5)工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3.V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如下:
| 化学键 | S=O (SO2) | O=O (O2) | S=O (SO3) |
| 能量/kJ | 535 | 496 | 472 |
 H =
H = ②反应Ⅱ、Ⅲ的化学方程式为
您最近半年使用:0次
解题方法
8 . 下列说法正确的是
| A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=−57.3kJ∙mol−1,在中和热的测定时实际加入的酸碱的量的多少会影响该反应的ΔH |
| B.1mol H2与0.5mol O2反应放出的热量就是H2的燃烧热 |
| C.加入催化剂可以改变反应的活化能,不能改变焓变 |
D.500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ∆H=−38.6kJ∙mol−1 2NH3(g) ∆H=−38.6kJ∙mol−1 |
您最近半年使用:0次
解题方法
9 . 已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
下列结论正确的是
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
下列结论正确的是
| A.碳的燃烧热大于110.5 kJ/mol |
| B.O2的能量大于CO的能量 |
| C.稀硫酸与Ba(OH)2溶液反应的反应热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
您最近半年使用:0次
10 . 下列说法正确的是
A.手性分子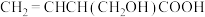 与足量的 与足量的 反应后分子有两个手性碳原子 反应后分子有两个手性碳原子 |
B.500℃、30MPa下,将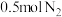 和 和 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成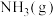 ,放热19.3kJ,其热化学方程式为: ,放热19.3kJ,其热化学方程式为:  |
C.在25℃和101kPa时:① 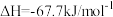 ② 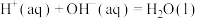 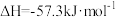 ,则氢氟酸的电离方程式及热效应可表示为: ,则氢氟酸的电离方程式及热效应可表示为: 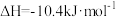 |
D.已知氢气在氯气中燃烧的热化学方程式:  ,拆开1molH-H键和1molCl-Cl键所需能量大于拆开2molH-Cl键所需能量 ,拆开1molH-H键和1molCl-Cl键所需能量大于拆开2molH-Cl键所需能量 |
您最近半年使用:0次



