解题方法
1 . 将硝酸钠(NaNO3)和硝酸钡[Ba(NO3)2]的混合物29.1g放入烧杯,加入100.0g水使其完全溶解,再加入94.2g硫酸钠溶液恰好完全反应,过滤(忽略溶液的损失),称得滤液的质量为200.0g。请计算:
(1)恰好完全反应后产生的沉淀质量为______ g。
(2)所得滤液的溶质质量分数(写出完整的解题过程)________ 。
(1)恰好完全反应后产生的沉淀质量为
(2)所得滤液的溶质质量分数(写出完整的解题过程)
您最近一年使用:0次
解题方法
2 . 计算题
(1)硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为:_______ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl(g)+HCl(g) ΔH1>0
SiHCl(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3
反应③的ΔH3=_______ (用ΔH1、ΔH2表示)。
(3)实现反应 对减少温室气体排放和减缓燃料危机具有重要意义。
对减少温室气体排放和减缓燃料危机具有重要意义。
已知:

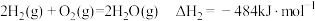

则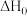 =
=_______  。
。
(4)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法高炉内可能发生的反应:
①C(s) +O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s) + CO2(g)= 2CO(g) △H2=+172.5 kJ/mol
③4CO(g) + Fe3O4(s)=4CO2(g)+3Fe(s) △H3=-13.7 kJ/mol
则:3Fe(s)+2O2(g)= Fe3O4(s) △H=_______ 。
(1)硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为:
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl(g)+HCl(g) ΔH1>0
SiHCl(g)+HCl(g) ΔH1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3反应③的ΔH3=
(3)实现反应
 对减少温室气体排放和减缓燃料危机具有重要意义。
对减少温室气体排放和减缓燃料危机具有重要意义。已知:

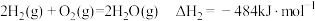

则
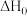 =
= 。
。(4)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法高炉内可能发生的反应:
①C(s) +O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s) + CO2(g)= 2CO(g) △H2=+172.5 kJ/mol
③4CO(g) + Fe3O4(s)=4CO2(g)+3Fe(s) △H3=-13.7 kJ/mol
则:3Fe(s)+2O2(g)= Fe3O4(s) △H=
您最近一年使用:0次
3 . 为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1:2:3。
(1)有机物A的相对分子质量是_______ ;
(2)有机物A的最简式分子式是_______ ,分子式是_______
(3)写出有机物A的结构简式:_______ 。
(4)写出有机物A的一种同分异构体结构简式:_______ 。
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1:2:3。

(1)有机物A的相对分子质量是
(2)有机物A的最简式分子式是
(3)写出有机物A的结构简式:
(4)写出有机物A的一种同分异构体结构简式:
您最近一年使用:0次
2021-05-11更新
|
342次组卷
|
3卷引用:西藏自治区山南市第二高级中学2020-2021学年高二下学期期中考试化学试题
西藏自治区山南市第二高级中学2020-2021学年高二下学期期中考试化学试题(已下线)专题一 有机化合物的结构特点与研究方法-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)6月刊 (期末复习必刷题)河北省石家庄北华中学2023-2024学年高三上学期10月月考考试化学试题
名校
解题方法
4 . (1)一定温度下,在密闭容器中通入一定量的NO2,发生反应:2NO2(g) 2NO(g)+O2(g),达到化学平衡时,测得混合气中NO2浓度为0.06mol·L-1,O2的浓度为0.12mol·L-1。
2NO(g)+O2(g),达到化学平衡时,测得混合气中NO2浓度为0.06mol·L-1,O2的浓度为0.12mol·L-1。
则:①该可逆反应的平衡常数K=___ (请用数字计算式表达)。
②此时NO2的转化率____ 。
(2)在容积为2L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。
3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。
计算:①5min末A的物质的量浓度为___ ;
②前5min内用B表示的化学反应速率v(B)为___ ;
③化学方程式中n值为___ 。
 2NO(g)+O2(g),达到化学平衡时,测得混合气中NO2浓度为0.06mol·L-1,O2的浓度为0.12mol·L-1。
2NO(g)+O2(g),达到化学平衡时,测得混合气中NO2浓度为0.06mol·L-1,O2的浓度为0.12mol·L-1。则:①该可逆反应的平衡常数K=
②此时NO2的转化率
(2)在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)
 3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。
3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:①5min末A的物质的量浓度为
②前5min内用B表示的化学反应速率v(B)为
③化学方程式中n值为
您最近一年使用:0次
名校
5 . (1)常温下,稀释0.5mol/L的醋酸溶液过程中,溶液中随着加水量的增加,c(OH-)___ (填“增大”、“减小”、或“不变”)。
(2)常温下0.01mol·L-1HCl溶液中c(H+)=___ ,pH=____ ;常温下0.01mol·L-1NaOH溶液:pH=___ 。
(3)pH=3的盐酸稀释100倍,pH___ 5(填“>”、“=”、或“<”)。
(4)pH=13的强碱溶液与pH=2的强酸溶液混合pH=7,则强碱与强酸的体积比为___ 。
(2)常温下0.01mol·L-1HCl溶液中c(H+)=
(3)pH=3的盐酸稀释100倍,pH
(4)pH=13的强碱溶液与pH=2的强酸溶液混合pH=7,则强碱与强酸的体积比为
您最近一年使用:0次
6 . (1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1___ ΔH2。
(2)肼(N2H4)可作为火箭发动机的燃料。肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l)ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)ΔH2=-534kJ·mol-1
试计算1mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为__ ,写出肼(l)和N2O4(l)反应的热化学方程式:__ 。
(3)已知H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如表:
则表中a=___ 。
(4)研究CO2的利用对促进低碳社会的构建具有重要的意义。已知拆开1molH2、1molO2和液态水中1molO—H键使之成为气态原子所需的能量分别为436kJ、495kJ和462kJ;CH3OH(g)的燃烧热为727kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)ΔH=___ kJ·mol-1。
(2)肼(N2H4)可作为火箭发动机的燃料。肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l)ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)ΔH2=-534kJ·mol-1
试计算1mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为
(3)已知H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
(4)研究CO2的利用对促进低碳社会的构建具有重要的意义。已知拆开1molH2、1molO2和液态水中1molO—H键使之成为气态原子所需的能量分别为436kJ、495kJ和462kJ;CH3OH(g)的燃烧热为727kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)ΔH=
您最近一年使用:0次
2020-11-18更新
|
153次组卷
|
2卷引用:西藏自治区日喀则市第二高级中学2020-2021学年高二上学期期中考试化学试题
7 . 反应N2+3H2⇌2NH3△H=—92.4kJ/mol,在密闭容器中进行并达到平衡,如果最初c(N2)=4mol/L,c(H2)=8mol/L,反应达到平衡时有10%的N2转化,求:
(1)达到平衡时,N2、H2和NH3的浓度各是多少?_____________ 。
(2)平衡时NH3占总体积百分数是多少?_____________ 。
(1)达到平衡时,N2、H2和NH3的浓度各是多少?
(2)平衡时NH3占总体积百分数是多少?
您最近一年使用:0次
2020-11-06更新
|
101次组卷
|
3卷引用:西藏拉萨市第二高级中学2019-2020学年高二上学期期中考试化学试题
解题方法
8 . 一密闭容器内装有N2和H2,反应开始时,N2浓度为2mol/L,H2浓度为5mol/L,两分钟后,测得N2浓度为1·8mol/L,则两分钟内N2的平均反应速率是多少___ ?H2和NH3的平均反应速率又分别是多少___ ?
您最近一年使用:0次
名校
9 . 恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)(注:要求写出计算过程)
2NH3(g)(注:要求写出计算过程)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值_______ 。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量__________ 。
(3)原混合气体与平衡混合气体的总物质的量之比_________ 。
(4)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=__________ 。
 2NH3(g)(注:要求写出计算过程)
2NH3(g)(注:要求写出计算过程)(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量
(3)原混合气体与平衡混合气体的总物质的量之比
(4)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=
您最近一年使用:0次
2020-11-04更新
|
73次组卷
|
2卷引用:西藏拉萨市第二高级中学2019-2020学年高二上学期期中考试化学试题
解题方法
10 . 已知可逆反应:M(g)+N(g)⇌P(g)+Q(g),△H>0,在一密闭容器中进行。在某温度下,反应物的起始浓度分别为:c(M)=1mol/L,c(N)=2.4mol/L;在12分钟末达到平衡后,M的转化率为60%,此时:
(1)以P浓度变化表示的该段时间内的平均反应速率是______________ 。
(2)该反应平衡常数K=__________ 。
(3)N的转化率是__________ 。转化率=(指定反应物的起始浓度-指定反应物的平衡浓度)∕指定反应物的起始浓度×100%
(1)以P浓度变化表示的该段时间内的平均反应速率是
(2)该反应平衡常数K=
(3)N的转化率是
您最近一年使用:0次
2020-08-08更新
|
200次组卷
|
3卷引用:西藏自治区日喀则市第三高级中学2019-2020学年高二上学期期末考试化学(理)试题



