名校
解题方法
1 . 研究化学反应中的能量变化对生产、生活有重要的意义。
(1)甲烷是一种高效清洁的新能源, 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为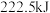 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)已知:


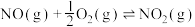


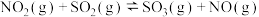


则
___________ (填含 、
、 的表达式),
的表达式),
___________ (填含 、
、 的表达式)。
的表达式)。
(3)已知: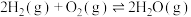
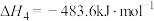 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:
①合成氨反应 的活化能
的活化能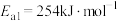 ,则氨分解反应
,则氨分解反应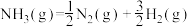 的活化能
的活化能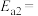
___________  。
。
②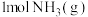 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出___________ kJ的热量;又已知
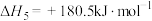 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为___________ 。
(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

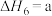
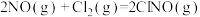
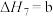
则反应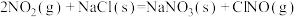 的
的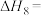
___________ (用含a、b的表达式表示)。
(1)甲烷是一种高效清洁的新能源,
 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为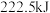 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)已知:



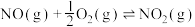


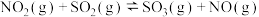


则

 、
、 的表达式),
的表达式),
 、
、 的表达式)。
的表达式)。(3)已知:
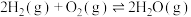
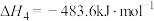 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:| 化学键 | H—H |  | N—H |
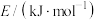 | 436 | 946 | 391 |
 的活化能
的活化能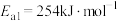 ,则氨分解反应
,则氨分解反应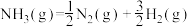 的活化能
的活化能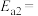
 。
。②
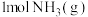 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出
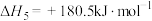 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

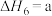
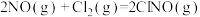
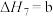
则反应
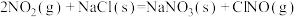 的
的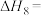
您最近一年使用:0次
2023-11-13更新
|
212次组卷
|
2卷引用:甘肃省白银市靖远县2023-2024学年高二上学期11月期中联考化学试题
名校
2 . 工业废水中常含有一定量的 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。
(1) 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的酸式电离方程式:
的酸式电离方程式:_____ 。
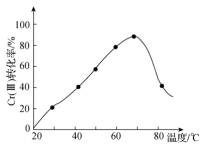
(2) 在强碱中可被双氧水氧化为
在强碱中可被双氧水氧化为 ,控制其他条件不变,反应温度对
,控制其他条件不变,反应温度对 转化率的影响如图所示。请分析温度超过70℃时,
转化率的影响如图所示。请分析温度超过70℃时, 转化率下降的原因是
转化率下降的原因是_______ 。
(3)溶液中的 与强碱性溶液反应,使
与强碱性溶液反应,使 完全沉淀的
完全沉淀的 为
为_______ {通常认为溶液中离子浓度小于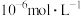 为沉淀完全;
为沉淀完全; 的
的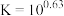 ,
,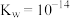 ,
, }。
}。
(4)25℃时,将 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为_______ 。
(5)标准状况下,将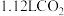 通入
通入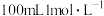 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: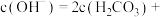
_______ 。
 ,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为
转化为 ,再将
,再将 转化为
转化为 沉淀。
沉淀。(1)
 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的酸式电离方程式:
的酸式电离方程式:(2)
 在强碱中可被双氧水氧化为
在强碱中可被双氧水氧化为 ,控制其他条件不变,反应温度对
,控制其他条件不变,反应温度对 转化率的影响如图所示。请分析温度超过70℃时,
转化率的影响如图所示。请分析温度超过70℃时, 转化率下降的原因是
转化率下降的原因是
(3)溶液中的
 与强碱性溶液反应,使
与强碱性溶液反应,使 完全沉淀的
完全沉淀的 为
为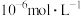 为沉淀完全;
为沉淀完全; 的
的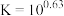 ,
,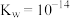 ,
, }。
}。(4)25℃时,将
 的醋酸与
的醋酸与 氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用含a、b式子表示醋酸的电离平衡常数为(5)标准状况下,将
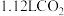 通入
通入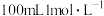 的
的 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式: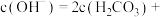
您最近一年使用:0次
3 . 在一个容积为1L的密闭容器中,充入5mol H2和2 mol N2。在一定温度和一定压强下,发生如下反应在:3H2(g) +N2(g)  2NH3(g),经过5min后达到平衡状态。若此时测得NH3的浓度为2 mol/L,求:
2NH3(g),经过5min后达到平衡状态。若此时测得NH3的浓度为2 mol/L,求:
(1)达平衡时N2的转化率_______ ;
(2)该温度下的K_______ 。
 2NH3(g),经过5min后达到平衡状态。若此时测得NH3的浓度为2 mol/L,求:
2NH3(g),经过5min后达到平衡状态。若此时测得NH3的浓度为2 mol/L,求:(1)达平衡时N2的转化率
(2)该温度下的K
您最近一年使用:0次
解题方法
4 . 在2L密闭容器中加入适量的氮气和氢气,发生反应N2(g)+3H2(g)  2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:
2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:
(1)N2的转化率和这段时间内NH3的化学反应速率分别是:____ 、____ ;
(2)平衡时压强与开始时压强的比值_______ ;
(3)该温度下反应的平衡常数_________ 。
 2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:
2NH3(g),10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol,n(H2)=1mol,n(NH3)=4mol,求:(1)N2的转化率和这段时间内NH3的化学反应速率分别是:
(2)平衡时压强与开始时压强的比值
(3)该温度下反应的平衡常数
您最近一年使用:0次
2022-12-03更新
|
150次组卷
|
2卷引用:甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(A卷)试题
5 . 汽车尾气中主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是___________ ,图1中对应反应的热化学方程式为___________ 。
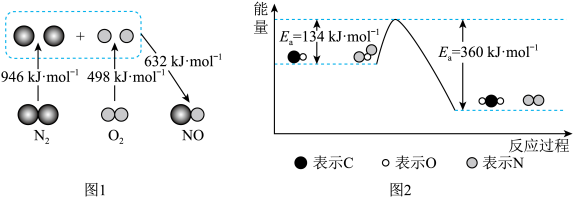
(2)N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:CO(g)+N2O(g) N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
①图2中反应是___________ (填“放热”或“吸热”)反应,该反应的活化能为___________ ,该反应的△H=___________ 。
②加入Pt2O+作为该反应的催化剂,则Ea___________ (填“增大”“减小”或“不变”,下同),△H___________ 。
(3)利用NH3还原法可将NOx,还原为N2进行脱除。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-2070 kJ∙mol-1,若有0.5molNO被还原,放出的热量为___________ 。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是

(2)N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:CO(g)+N2O(g)
 N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。①图2中反应是
②加入Pt2O+作为该反应的催化剂,则Ea
(3)利用NH3还原法可将NOx,还原为N2进行脱除。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-2070 kJ∙mol-1,若有0.5molNO被还原,放出的热量为
您最近一年使用:0次
2022-11-24更新
|
293次组卷
|
2卷引用:甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 某温度时,纯水的pH为6。
(1)该温度下水的离子积KW为_______ ,
(2)该温度下, 的
的 溶液的pH=
溶液的pH=_______ ,该溶液中由水电离出的 的大小为
的大小为_______ 。
(3)将此温度下 的NaOH溶液与
的NaOH溶液与 的盐酸等体积混合(设混合后溶液体积的变化忽略不计,下同),混合后溶液的
的盐酸等体积混合(设混合后溶液体积的变化忽略不计,下同),混合后溶液的
_______ 。
(4)将此温度下 的NaOH溶液aL与
的NaOH溶液aL与 的稀硫酸bL混合。若所得的混合溶液pH=10,则
的稀硫酸bL混合。若所得的混合溶液pH=10,则
_______ 。
(1)该温度下水的离子积KW为
(2)该温度下,
 的
的 溶液的pH=
溶液的pH= 的大小为
的大小为(3)将此温度下
 的NaOH溶液与
的NaOH溶液与 的盐酸等体积混合(设混合后溶液体积的变化忽略不计,下同),混合后溶液的
的盐酸等体积混合(设混合后溶液体积的变化忽略不计,下同),混合后溶液的
(4)将此温度下
 的NaOH溶液aL与
的NaOH溶液aL与 的稀硫酸bL混合。若所得的混合溶液pH=10,则
的稀硫酸bL混合。若所得的混合溶液pH=10,则
您最近一年使用:0次
名校
解题方法
7 . 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)前5min内用B表示的平均反应速率v(B)=_______ mol/(L·min);
(2)5min时物质A的转化率为_______ 。
 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:(1)前5min内用B表示的平均反应速率v(B)=
(2)5min时物质A的转化率为
您最近一年使用:0次
解题方法
8 . 取含26.1gMnO2的软锰矿石跟200mL10mol/L的浓盐酸反应完全,已知:MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O。计算:
(1)生成的氯气在标准状况的体积为多少升___ ?
(2)在反应中被消耗的HCl的质量为多少克___ ?
(3)在反应后的溶液中加入足量的硝酸银溶液,试计算产生沉淀的质量___ ?(不考虑氯化氢的挥发)。
(1)生成的氯气在标准状况的体积为多少升
(2)在反应中被消耗的HCl的质量为多少克
(3)在反应后的溶液中加入足量的硝酸银溶液,试计算产生沉淀的质量
您最近一年使用:0次
解题方法
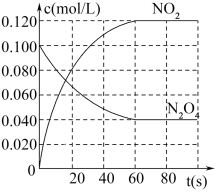
9 . 在容积为1.00L的密闭容器中,通入一定量的N2O4,发生反应:N2O4(g) 2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
请回答:
(1)60s内,v(N2O4)=___ mol/(L•s)。
(2)若升高温度,混合气体的颜色变深,则正反应是___ (填“放热”或吸热”)反应。
(3)100℃时,该反应的化学平衡常数数值为___ 。
(4)平衡时,N2O4的转化率是___ 。
 2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如图所示。
请回答:
(1)60s内,v(N2O4)=
(2)若升高温度,混合气体的颜色变深,则正反应是
(3)100℃时,该反应的化学平衡常数数值为
(4)平衡时,N2O4的转化率是
您最近一年使用:0次
2022-09-18更新
|
483次组卷
|
3卷引用:甘肃省镇原县第二中学2021-2022学年高二上学期期中考试化学试题
10 . 标准状况时,33.6LNH3约含有____ 个氨分子,质量是____ g,全部溶于水后配成1L溶液,所得溶液的物质的量浓度为____ mol/L。
您最近一年使用:0次
2022-09-18更新
|
203次组卷
|
2卷引用:甘肃省镇原县第二中学2021-2022学年高二上学期期中考试化学试题



