1 . 次磷酸钠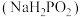 广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
(1)红磷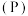 与白磷之间的关系为互为
与白磷之间的关系为互为_______ ,二者在一定条件下可以发生转化,该反应属于_______ (填“氧化还原反应”或“非氧化还原反应”)。
(2) 中磷元素的化合价为
中磷元素的化合价为_______ ,已知 为一元酸,则
为一元酸,则 为
为_______ (填“酸式盐”“碱式盐”或“正盐”)。
(3)写出“碱溶”过程发生反应的化学方程式:_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
(4)由“镀镍”过程可知 具有
具有_______ (填“氧化”或“还原”)性,理论上要制备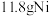 需要
需要 的质量为
的质量为_______ 。
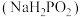 广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下: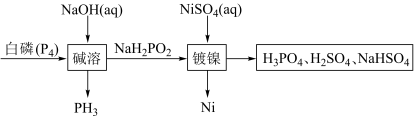
(1)红磷
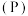 与白磷之间的关系为互为
与白磷之间的关系为互为(2)
 中磷元素的化合价为
中磷元素的化合价为 为一元酸,则
为一元酸,则 为
为(3)写出“碱溶”过程发生反应的化学方程式:
(4)由“镀镍”过程可知
 具有
具有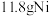 需要
需要 的质量为
的质量为
您最近一年使用:0次
解题方法
2 . 有A、B、C、D、E五种短周期元素,其原子序数依次增大,在元素周期表中A的原子半径最小,B的主族序数是周期序数的2倍,D是地壳中含量最多的元素,在元素周期表中A和E同主族。回答下列问题:
(1)化合物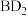 的电子式是
的电子式是_______ 。
(2)化合物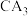 的结构式为
的结构式为_______ 。
(3)C的最低价氢化物与C的最高价氧化物对应的水化物反应生成的盐的化学式为_______ 。
(4)用电子式表示化合物 的形成过程:
的形成过程:_______ 。
(5)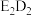 中所含化学键类型是
中所含化学键类型是_______ ,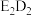 与
与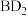 反应的化学方程式为
反应的化学方程式为_______ 。
(1)化合物
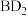 的电子式是
的电子式是(2)化合物
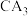 的结构式为
的结构式为(3)C的最低价氢化物与C的最高价氧化物对应的水化物反应生成的盐的化学式为
(4)用电子式表示化合物
 的形成过程:
的形成过程:(5)
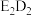 中所含化学键类型是
中所含化学键类型是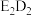 与
与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . A是石油裂解气的主要产物之一,标准状况下2.24L的A气体完全燃烧生成8.8 g  和3.6 g
和3.6 g  ,G是一种高分子化合物。
,G是一种高分子化合物。___________ ,书写D与丙三醇反应的化学方程式___________ 。
(2)上述过程中属于取代反应的有___________ ,属于氧化反应的有___________ 。
(3)书写过程③的化学方程式___________ 。
(4)1 mol F在光照条件下最多能与___________ 1 mol  发生反应。
发生反应。
(5)下列说法正确的是___________ 。
A.生成E时,浓硫酸用作催化剂和吸水剂
B.可以用饱和碳酸钠溶液鉴别B、D和E三种物质
C.等质量C和E完全燃烧消耗氧气的质量相等
D.物质A能使溴水、酸性高锰酸钾溶液褪色,且两者原理相同
E.G属于纯净物
 和3.6 g
和3.6 g  ,G是一种高分子化合物。
,G是一种高分子化合物。
(2)上述过程中属于取代反应的有
(3)书写过程③的化学方程式
(4)1 mol F在光照条件下最多能与
 发生反应。
发生反应。(5)下列说法正确的是
A.生成E时,浓硫酸用作催化剂和吸水剂
B.可以用饱和碳酸钠溶液鉴别B、D和E三种物质
C.等质量C和E完全燃烧消耗氧气的质量相等
D.物质A能使溴水、酸性高锰酸钾溶液褪色,且两者原理相同
E.G属于纯净物
您最近一年使用:0次
4 . 工业上以铝土矿(主要成分为 ,含有少量MgO、
,含有少量MgO、 和
和 )为原料冶炼金属铝,其工艺流程示意图如下:
)为原料冶炼金属铝,其工艺流程示意图如下:___________ 。
为加快铝土矿在盐酸中的溶解,可采取的措施有___________ 。
(2)过滤操作必须用到的玻璃仪器除了烧杯,还有___________ 。
(3)工业上常用金属Al作还原剂冶炼金属Fe,写出对应的化学方程式:___________ 。
(4)若往溶液A中逐滴滴加NaOH溶液,则实验过程中产生沉淀的物质的量与加入NaOH溶液的体积之间的关系图正确的是___________(填标号)。
(5)是否可以用氨水代替NaOH溶液,___________ (填“是”或“否”),理由是:___________ 。
 ,含有少量MgO、
,含有少量MgO、 和
和 )为原料冶炼金属铝,其工艺流程示意图如下:
)为原料冶炼金属铝,其工艺流程示意图如下: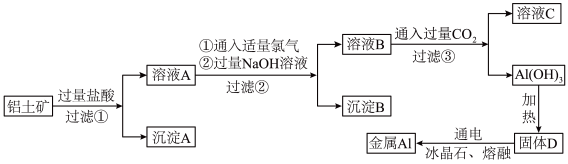
为加快铝土矿在盐酸中的溶解,可采取的措施有
(2)过滤操作必须用到的玻璃仪器除了烧杯,还有
(3)工业上常用金属Al作还原剂冶炼金属Fe,写出对应的化学方程式:
(4)若往溶液A中逐滴滴加NaOH溶液,则实验过程中产生沉淀的物质的量与加入NaOH溶液的体积之间的关系图正确的是___________(填标号)。
A.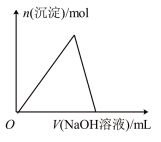 | B.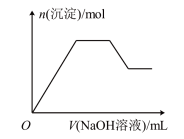 |
C.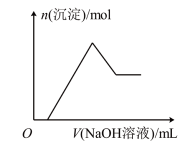 | D.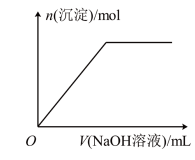 |
(5)是否可以用氨水代替NaOH溶液,
您最近一年使用:0次
名校
解题方法
5 . 汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一,回答下列问题:
(1)已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,图中三种分子最稳定的是___________ ,生成2 mol NO时
___________ 。___________ 。
②传感器在一段时间内监测出NO的含量为67.2 L(标况),则电池工作时转移电子数目为___________ 。
(3)在恒温恒容(2L)的密闭容器中充入3 mol CO和3 mol NO混合气体,发生反应: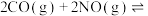
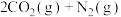 ,测得反应过程中
,测得反应过程中 的体积分数与时间(min)的关系如下图所示。
的体积分数与时间(min)的关系如下图所示。 的反应速率为
的反应速率为___________ ,NO的转化率为___________ 。
②平衡后往该容器中再充入一定量的氦气,则 的反应速率
的反应速率___________ 。(填“增大”、“减小”或“不变”)
③能说明上述反应已达化学平衡状态的是___________ (填字母)。
A. B.混合气体密度保持不变
B.混合气体密度保持不变
C.反应容器内压强保持不变 D.混合气体的平均相对分子质量保持不变
(1)已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,图中三种分子最稳定的是

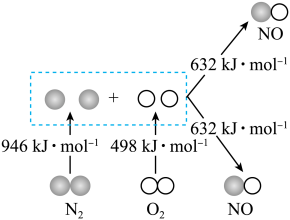
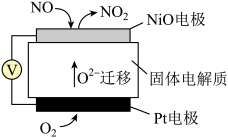
②传感器在一段时间内监测出NO的含量为67.2 L(标况),则电池工作时转移电子数目为
(3)在恒温恒容(2L)的密闭容器中充入3 mol CO和3 mol NO混合气体,发生反应:
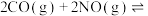
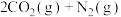 ,测得反应过程中
,测得反应过程中 的体积分数与时间(min)的关系如下图所示。
的体积分数与时间(min)的关系如下图所示。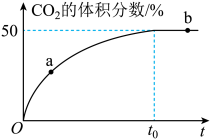
 的反应速率为
的反应速率为②平衡后往该容器中再充入一定量的氦气,则
 的反应速率
的反应速率③能说明上述反应已达化学平衡状态的是
A.
 B.混合气体密度保持不变
B.混合气体密度保持不变C.反应容器内压强保持不变 D.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
名校
6 .  的排放,往往会产生污染。某研究性小组验证NO与炽热的铜粉会发生反应
的排放,往往会产生污染。某研究性小组验证NO与炽热的铜粉会发生反应 ,从而可减少NO的污染,方案设计如下:
,从而可减少NO的污染,方案设计如下: ,此体系中产生的
,此体系中产生的 浓度较稀。
浓度较稀。
(1)装置C的名称______ ,写出装置A中发生反应化学方程式为____________ 。
(2)装置B中Cu单质的作用____________ 。
(3)有关该实验,下列说法不正确的是______ 。
A.实验开始前要通 ,实验结束后也要通
,实验结束后也要通
B.C装置中的 可用无水
可用无水 替代
替代
C.F装置中的试剂是NaOH,吸收尾气,防止污染环境
(4)B装置中也可加入稀硫酸,目的是____________ ;实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为____________ 。
(5)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中不可行的是______。
 的排放,往往会产生污染。某研究性小组验证NO与炽热的铜粉会发生反应
的排放,往往会产生污染。某研究性小组验证NO与炽热的铜粉会发生反应 ,从而可减少NO的污染,方案设计如下:
,从而可减少NO的污染,方案设计如下: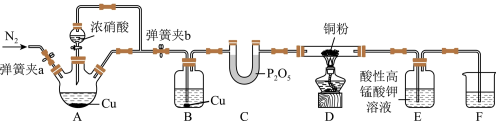
 ,此体系中产生的
,此体系中产生的 浓度较稀。
浓度较稀。(1)装置C的名称
(2)装置B中Cu单质的作用
(3)有关该实验,下列说法不正确的是
A.实验开始前要通
 ,实验结束后也要通
,实验结束后也要通
B.C装置中的
 可用无水
可用无水 替代
替代C.F装置中的试剂是NaOH,吸收尾气,防止污染环境
(4)B装置中也可加入稀硫酸,目的是
(5)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中不可行的是______。
| A.适当加热该绿色溶液,观察颜色变化 |
| B.加水稀释绿色溶液,观察颜色变化 |
| C.向该绿色溶液中通入氮气,观察颜色变化 |
| D.向硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
您最近一年使用:0次
名校
解题方法
7 . 工业上可以用乙烯、丙烯等为原料合成制得食品添加剂丙烯酸乙酯。 )中含氧官能团的名称是
)中含氧官能团的名称是______ 。
(2)A生成有机物B的化学方程式为____________ ,有机物B发生催化氧化反应的化学方程式为____________ 。
(3)有机物D的结构简式为______ 。
(4)12.4 g Y与足量的金属Na完全反应,生成标准状况下氢气的体积为______ L。
(5)有机物B、D反应生成丙烯酸乙酯的反应在实验室中可在如图装置中进行。______ 。试管乙中的导管口要在液面以上的原因是____________ 。
②该反应的化学方程式是____________ 。
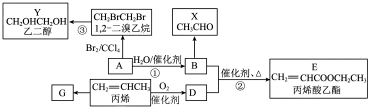
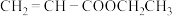 )中含氧官能团的名称是
)中含氧官能团的名称是(2)A生成有机物B的化学方程式为
(3)有机物D的结构简式为
(4)12.4 g Y与足量的金属Na完全反应,生成标准状况下氢气的体积为
(5)有机物B、D反应生成丙烯酸乙酯的反应在实验室中可在如图装置中进行。
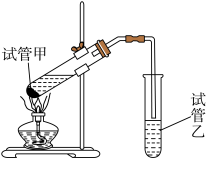
②该反应的化学方程式是
您最近一年使用:0次
8 . 现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
(1)实验发现反应后(a)中温度升高,由此可以判断(a)中发生的反应是______ (填“吸”或“放”)热反应;根据能量守恒定律,(b)中反应物的总能量应该______ (填“低于”或“高于”)其生成物的总能量。
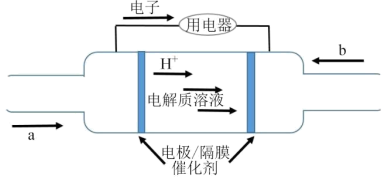
Ⅱ.某种氢燃料电池的内部结构如图所示。______ 。
(3)右侧的电极反应式为______ 。
Ⅲ.在2 L的恒容密闭容器中充入1 mol CO和2 mol ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 和
和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
______ mol⋅L ⋅min
⋅min 。下列措施能增大反应速率的是
。下列措施能增大反应速率的是______ (填字母)。
A.升高温度 B.降低压强
C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(5)下列描述能说明反应 达到平衡状态的是______(填字母)。
达到平衡状态的是______(填字母)。
(6)平衡时CO的体积分数为______ (保留3位有效数字)。
(7)已知断开1 mol 和2 mol
和2 mol  中的化学键需要吸收的能量为1924kJ,则断开1mol
中的化学键需要吸收的能量为1924kJ,则断开1mol 中的化学键需要吸收
中的化学键需要吸收______ kJ的能量。

(1)实验发现反应后(a)中温度升高,由此可以判断(a)中发生的反应是
Ⅱ.某种氢燃料电池的内部结构如图所示。
(3)右侧的电极反应式为
Ⅲ.在2 L的恒容密闭容器中充入1 mol CO和2 mol
 ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 和
和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。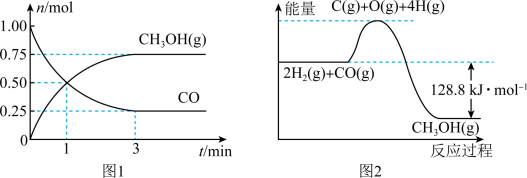

 ⋅min
⋅min 。下列措施能增大反应速率的是
。下列措施能增大反应速率的是A.升高温度 B.降低压强
C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(5)下列描述能说明反应
 达到平衡状态的是______(填字母)。
达到平衡状态的是______(填字母)。A.CO、 和 和 三种物质的浓度相等 三种物质的浓度相等 |
| B.密闭容器中混合气体的密度不随时间的变化而变化 |
| C.密闭容器中混合气体的总物质的量不随时间的变化而变化 |
D.单位时间内消耗2 mol 的同时生成1 mol 的同时生成1 mol |
(6)平衡时CO的体积分数为
(7)已知断开1 mol
 和2 mol
和2 mol  中的化学键需要吸收的能量为1924kJ,则断开1mol
中的化学键需要吸收的能量为1924kJ,则断开1mol 中的化学键需要吸收
中的化学键需要吸收
您最近一年使用:0次
名校
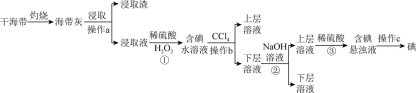
9 . 浩瀚的海洋里蕴藏着丰富的化学资源,从海带中提取碘单质和从海水中提取溴单质的工艺流程如图。回答下列问题:
Ⅰ.海带提碘______ (填标号)。____________ 。
(3)操作b的名称为______ 。
(4)写出②加入NaOH溶液的目的____________ ;写出③反应中氧化剂与还原剂物质的量之比为______ 。
Ⅱ.海水提溴____________ (写出离子方程式)。
(6)步骤③离子方程式为____________ 。
Ⅰ.海带提碘
(3)操作b的名称为
(4)写出②加入NaOH溶液的目的
Ⅱ.海水提溴
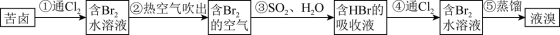
(6)步骤③离子方程式为
您最近一年使用:0次
名校
10 . 回答下列问题
(1)小组同学设计了两种制备 的方案。
的方案。
a.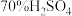 溶液与
溶液与 粉末反应;
粉末反应;
b. 粉与浓H2SO4在加热条件下反应。
粉与浓H2SO4在加热条件下反应。
小组同学用如图所示装置检验上述方案b中所有气体产物。___________ ,装置B中盛放的试剂为___________ 。
②按气流方向,上述装置合理的连接顺序为
___________ 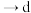 (填仪器接口的小写字母)。
(填仪器接口的小写字母)。
③装置C中仪器n的作用为___________ 。
(2)硫酸厂产生的尾气中含有少量 ,如图为双碱法脱硫的原理示意图。
,如图为双碱法脱硫的原理示意图。___________ 。
(3)某实验小组进行如下实验:分别用煮沸和未煮沸过的蒸馏水配制的 和
和 溶液,操作装置如图所示。
溶液,操作装置如图所示。
①据G、H、I中现象推测以上实验中产生的白色沉淀的化学式是___________ 。
②据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是___________ 。
(1)小组同学设计了两种制备
 的方案。
的方案。a.
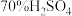 溶液与
溶液与 粉末反应;
粉末反应;b.
 粉与浓H2SO4在加热条件下反应。
粉与浓H2SO4在加热条件下反应。小组同学用如图所示装置检验上述方案b中所有气体产物。
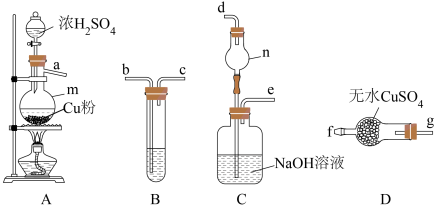
②按气流方向,上述装置合理的连接顺序为

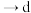 (填仪器接口的小写字母)。
(填仪器接口的小写字母)。③装置C中仪器n的作用为
(2)硫酸厂产生的尾气中含有少量
 ,如图为双碱法脱硫的原理示意图。
,如图为双碱法脱硫的原理示意图。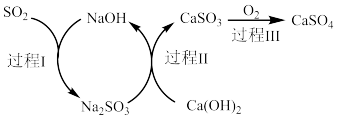
(3)某实验小组进行如下实验:分别用煮沸和未煮沸过的蒸馏水配制的
 和
和 溶液,操作装置如图所示。
溶液,操作装置如图所示。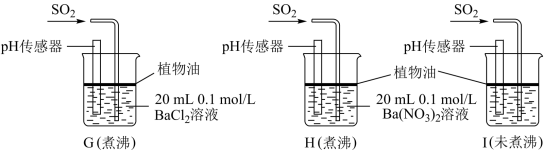
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生, 传感器测得溶液 传感器测得溶液 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
②据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是
您最近一年使用:0次



