名校
解题方法
1 . 苯甲酸可用于合成纤维、树脂涂料等,也可作为药物或防腐剂,有抑制真菌、细菌生长的作用。实验室利用高锰酸钾溶液氧化甲苯制备苯甲酸,其反应装置、制备原理如下:
②苯甲酸密度比水大,熔点122.13℃,沸点249.2℃,微溶于冷水,易溶于乙醇、热水,式量为122。
③高锰酸钾在中性溶液中被甲苯还原为二氧化锰。
(1)仪器 的名称为
的名称为______ ,冷凝水从______ 口流出(填“甲”或“乙”)。
(2)下列说法不正确 的是______。
(3)提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作______ 。
(4)纯度测定:称取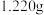 产品,配成
产品,配成 甲醇溶液,每次移取
甲醇溶液,每次移取 溶液。用
溶液。用 的
的 标准溶液滴定,三次滴定平均消耗
标准溶液滴定,三次滴定平均消耗 的
的 标准溶液。产品中苯甲酸质量分数为
标准溶液。产品中苯甲酸质量分数为______ ,进一步纯化的方法是______ 。

②苯甲酸密度比水大,熔点122.13℃,沸点249.2℃,微溶于冷水,易溶于乙醇、热水,式量为122。
③高锰酸钾在中性溶液中被甲苯还原为二氧化锰。
(1)仪器
 的名称为
的名称为(2)下列说法
| A.将原料充分加热回流至回流液不再出现油珠,此时甲苯已完全被氧化 |
B.反应结束后,从分液漏斗中滴加适量 溶液,可除去过量的高锰酸钾 溶液,可除去过量的高锰酸钾 |
| C.将反应后的混合物充分冷却,先加入浓盐酸酸化,再过滤,可分离出苯甲酸 |
| D.提纯苯甲酸,可将粗苯甲酸加入热水溶解,趁热过滤,冷却结晶,再用乙醇洗涤 |
(3)提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作
(4)纯度测定:称取
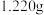 产品,配成
产品,配成 甲醇溶液,每次移取
甲醇溶液,每次移取 溶液。用
溶液。用 的
的 标准溶液滴定,三次滴定平均消耗
标准溶液滴定,三次滴定平均消耗 的
的 标准溶液。产品中苯甲酸质量分数为
标准溶液。产品中苯甲酸质量分数为
您最近一年使用:0次
名校
2 . 碳族化合物在研究和生产中有许多重要用途,请回答下列问题:
(1)已知 中硅元素为
中硅元素为 价,则H、C、O、
价,则H、C、O、 的电负性由大到小的顺序为
的电负性由大到小的顺序为_______ 。
(2) 与P形成的某化合物晶体的晶胞如图。
与P形成的某化合物晶体的晶胞如图。_______ ,该化合物的化学式为_______ 。
(3)已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是 。试回答:
。试回答:
①Y元素原子最外层电子排布图为_______ 。
②若X、Y两元素的电负性分别为1.8和3.0,则 中X与Y之间的化学键为
中X与Y之间的化学键为_______ (填“共价键”或“离子键”)。
③ 的沸点与
的沸点与 比较:
比较:_______ (填化学式)的高,原因是_______ 。
(1)已知
 中硅元素为
中硅元素为 价,则H、C、O、
价,则H、C、O、 的电负性由大到小的顺序为
的电负性由大到小的顺序为(2)
 与P形成的某化合物晶体的晶胞如图。
与P形成的某化合物晶体的晶胞如图。
(3)已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是
 。试回答:
。试回答:①Y元素原子最外层电子排布图为
②若X、Y两元素的电负性分别为1.8和3.0,则
 中X与Y之间的化学键为
中X与Y之间的化学键为③
 的沸点与
的沸点与 比较:
比较:
您最近一年使用:0次
名校
解题方法
3 . 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理如图:
实验步骤:
Ⅰ.向如图所示装置中加入甲苯、水和高锰酸钾,慢慢开启搅拌器,加热回流约 后停止加热并继续搅拌
后停止加热并继续搅拌 。
。 溶液,混合振荡,过滤、用少量热水洗涤滤渣。将含有苯甲酸钾
溶液,混合振荡,过滤、用少量热水洗涤滤渣。将含有苯甲酸钾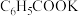 和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。
和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。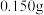 粗苯甲酸样品(杂质不与
粗苯甲酸样品(杂质不与 反应),配成溶液并置于
反应),配成溶液并置于 容量瓶中定容。移取
容量瓶中定容。移取 溶液,用
溶液,用 的
的 标准溶液滴定,平均消耗
标准溶液滴定,平均消耗 的
的 标准溶液。
标准溶液。
回答下列问题:
(1)由甲苯制得苯甲酸钾的反应类型为_______ 。
(2)仪器b的作用是_______ 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是_______ ;该步骤中可以用来替代亚硫酸氢钠的是_______ (填字母)。
A. B.
B. C.
C.
(4)步骤Ⅱ中“用少量热水洗涤滤渣”中滤渣的主要成分是_______ 。
(5)下列说法不正确 的是_______。
(6)粗品中苯甲酸的质量分数为_______ 。

物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
甲苯 | 92 |
| 110.6 | 不溶于水,易溶于乙醇 |
苯甲酸 | 122 | 122.4 | 248 | 微溶于冷水,易溶于乙醇、热水 |
Ⅰ.向如图所示装置中加入甲苯、水和高锰酸钾,慢慢开启搅拌器,加热回流约
 后停止加热并继续搅拌
后停止加热并继续搅拌 。
。
 溶液,混合振荡,过滤、用少量热水洗涤滤渣。将含有苯甲酸钾
溶液,混合振荡,过滤、用少量热水洗涤滤渣。将含有苯甲酸钾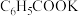 和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。
和甲苯的滤液按如下流程分离出苯甲酸和回收未反应的甲苯。
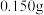 粗苯甲酸样品(杂质不与
粗苯甲酸样品(杂质不与 反应),配成溶液并置于
反应),配成溶液并置于 容量瓶中定容。移取
容量瓶中定容。移取 溶液,用
溶液,用 的
的 标准溶液滴定,平均消耗
标准溶液滴定,平均消耗 的
的 标准溶液。
标准溶液。回答下列问题:
(1)由甲苯制得苯甲酸钾的反应类型为
(2)仪器b的作用是
(3)加入适量饱和亚硫酸氢钠溶液的目的是
A.
 B.
B. C.
C.
(4)步骤Ⅱ中“用少量热水洗涤滤渣”中滤渣的主要成分是
(5)下列说法
| A.操作①是分液,操作②是蒸馏 |
| B.无色液体A是甲苯,白色固体是B苯甲酸 |
| C.为了得到更多的白色固体B,冷却结晶时温度越低越好 |
| D.可通过多次重结晶以提高苯甲酸的纯度 |
(6)粗品中苯甲酸的质量分数为
您最近一年使用:0次
名校
4 . 化合物 是一种用于预防和治疗心、脑及其它动脉循环障碍疾病的药物,以
是一种用于预防和治疗心、脑及其它动脉循环障碍疾病的药物,以 为原料合成
为原料合成 的路线如下图:
的路线如下图:
(1)有机物D中官能团名称是______ ;
(2)Y的结构简式为______ ;
(3)下列说法正确的是______;
(4)写出由C→D的化学方程式______ ;
(5)G是相对分子质量比A大14的同系物,写出符合下列条件的G的同分异构体的结构简式(不考虑立体异构)______ ;
①属于芳香族化合物;
②具有与A相同的官能团;
③ 谱有四组峰且峰面积之比为2∶2∶2∶1
谱有四组峰且峰面积之比为2∶2∶2∶1
(6)请结合题中信息,设计以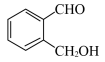 为有机原料制备化合物
为有机原料制备化合物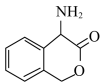 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)______ 。
 是一种用于预防和治疗心、脑及其它动脉循环障碍疾病的药物,以
是一种用于预防和治疗心、脑及其它动脉循环障碍疾病的药物,以 为原料合成
为原料合成 的路线如下图:
的路线如下图: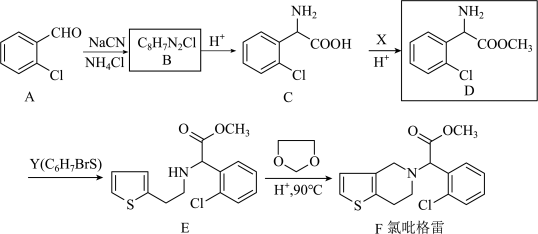
已知:R—CHO
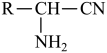
(1)有机物D中官能团名称是
(2)Y的结构简式为
(3)下列说法正确的是______;
| A.有机物B能发生消去反应 | B.有机物C中含酰胺基 |
| C.有机物D中的碳原子轨道杂化类型有两种 | D.有机物E、F分子中均有一个手性碳原子 |
(4)写出由C→D的化学方程式
(5)G是相对分子质量比A大14的同系物,写出符合下列条件的G的同分异构体的结构简式(不考虑立体异构)
①属于芳香族化合物;
②具有与A相同的官能团;
③
 谱有四组峰且峰面积之比为2∶2∶2∶1
谱有四组峰且峰面积之比为2∶2∶2∶1(6)请结合题中信息,设计以
 为有机原料制备化合物
为有机原料制备化合物 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
5 . 回答下列问题:
(1)丙烯腈 分子中碳原子杂化轨道类型为
分子中碳原子杂化轨道类型为______ , 键的数目和
键的数目和 键的数目比值为
键的数目比值为______ .
(2)基态Mn原子的价层电子轨道表示式为______ .
(3)硫酸铜溶液呈天蓝色,向其中逐滴加入氨水至过量,现象是______ ,此过程中,与铜离子形成配位键的分子 中,配位能力强弱:______ >______ (填分子式),解释原因:______ .
(4)工业生产中,含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。______ .
A.离子键 B.非极性共价键 C.极性共价键 D.氢键 E.配位键
(1)丙烯腈
 分子中碳原子杂化轨道类型为
分子中碳原子杂化轨道类型为 键的数目和
键的数目和 键的数目比值为
键的数目比值为(2)基态Mn原子的价层电子轨道表示式为
(3)硫酸铜溶液呈天蓝色,向其中逐滴加入氨水至过量,现象是
(4)工业生产中,含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。

A.离子键 B.非极性共价键 C.极性共价键 D.氢键 E.配位键
您最近一年使用:0次
名校
解题方法
6 . 第ⅤA族元素又称氮族元素,回答下列问题。
(1)根据价层电子对互斥模型, 的VSEPR模型名称为
的VSEPR模型名称为______ ,空间结构为______ .
(2)下列说法不正确 的是______.
(3)氮、磞和氢可以形成平面六元环结构的硼氮苯,分子式为 ,其结构式为
,其结构式为______ .
(4)某含砷化合物晶胞如图所示,As原子位于紧邻 原子构成的正三棱柱的体心。阿伏加德罗常数的值为
原子构成的正三棱柱的体心。阿伏加德罗常数的值为 ,则该晶体的化学式为
,则该晶体的化学式为______ ,密度为______  (写出计算式即可)
(写出计算式即可)
(1)根据价层电子对互斥模型,
 的VSEPR模型名称为
的VSEPR模型名称为(2)下列说法
| A.激发态氮原子跃迁到基态时,可用光谱仪摄取原子的吸收光谱 |
B.第二周期中第一电离能介于 与 与 之间的元素有3种 之间的元素有3种 |
| C.氮族元素单质的晶体类型都相同 |
D. 是正四面体形分子,键角为 是正四面体形分子,键角为 |
(3)氮、磞和氢可以形成平面六元环结构的硼氮苯,分子式为
 ,其结构式为
,其结构式为(4)某含砷化合物晶胞如图所示,As原子位于紧邻
 原子构成的正三棱柱的体心。阿伏加德罗常数的值为
原子构成的正三棱柱的体心。阿伏加德罗常数的值为 ,则该晶体的化学式为
,则该晶体的化学式为 (写出计算式即可)
(写出计算式即可)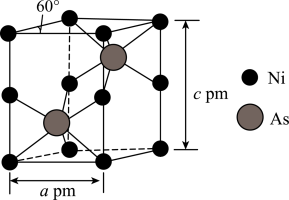
您最近一年使用:0次
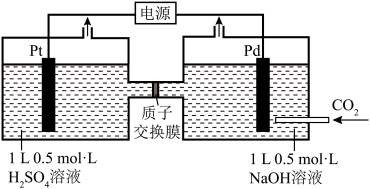
7 . 利用电化学方法可以将CO2有效地转化为HCOO-(其中C元素的化合价为+2价),装置如图所示。_______ 。
(2)一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ:HCOOH CO+H2O (快)
CO+H2O (快) 
Ⅱ:HCOOH CO2+H2 (慢)
CO2+H2 (慢) 
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。回答下列问题:
①一定条件下水气变换反应的焓变
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
②反应I正反应速率方程为: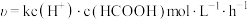 ,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为
,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为 时,此时反应Ⅰ速率
时,此时反应Ⅰ速率
_______  (用含Ka、x和k的代数式表示)。
(用含Ka、x和k的代数式表示)。
(3)反应Ⅲ:CO+H2O HCOOH且在恒温、恒容的密闭容器中进行,采用充分搅拌催化剂M的DMSO(有机溶剂)溶液,使CO2和H2在该溶液中反应制备HCOOH,反应过程中保持CO2和H2压强不变,反应速率为
HCOOH且在恒温、恒容的密闭容器中进行,采用充分搅拌催化剂M的DMSO(有机溶剂)溶液,使CO2和H2在该溶液中反应制备HCOOH,反应过程中保持CO2和H2压强不变,反应速率为 ,反应机理如下列三个基元反应,各反应的活化能
,反应机理如下列三个基元反应,各反应的活化能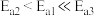 。
。
Ⅳ: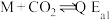
V: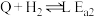
Ⅵ: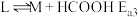
①催化剂M足量的条件下,下列说法正确的是_______ 。
A.反应Ⅳ是总反应的决速反应 B. 与溶液中溶解的CO2浓度有关
与溶液中溶解的CO2浓度有关
C.温度升高,反应速率 一定增大 D.催化剂可以降低反应的活化能,加快反应速率
一定增大 D.催化剂可以降低反应的活化能,加快反应速率
②该总反应随催化剂浓度的增加,反应速率先增大后保持不变,请解释原因_______ 。
(2)一定条件下,水气变换反应CO+H2O
 CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:Ⅰ:HCOOH
 CO+H2O (快)
CO+H2O (快) 
Ⅱ:HCOOH
 CO2+H2 (慢)
CO2+H2 (慢) 
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。回答下列问题:
①一定条件下水气变换反应的焓变

 、
、 的代数式表示)。
的代数式表示)。②反应I正反应速率方程为:
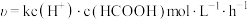 ,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为
,k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为 时,此时反应Ⅰ速率
时,此时反应Ⅰ速率
 (用含Ka、x和k的代数式表示)。
(用含Ka、x和k的代数式表示)。(3)反应Ⅲ:CO+H2O
 HCOOH且在恒温、恒容的密闭容器中进行,采用充分搅拌催化剂M的DMSO(有机溶剂)溶液,使CO2和H2在该溶液中反应制备HCOOH,反应过程中保持CO2和H2压强不变,反应速率为
HCOOH且在恒温、恒容的密闭容器中进行,采用充分搅拌催化剂M的DMSO(有机溶剂)溶液,使CO2和H2在该溶液中反应制备HCOOH,反应过程中保持CO2和H2压强不变,反应速率为 ,反应机理如下列三个基元反应,各反应的活化能
,反应机理如下列三个基元反应,各反应的活化能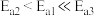 。
。Ⅳ:
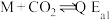
V:
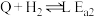
Ⅵ:
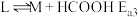
①催化剂M足量的条件下,下列说法正确的是
A.反应Ⅳ是总反应的决速反应 B.
 与溶液中溶解的CO2浓度有关
与溶液中溶解的CO2浓度有关C.温度升高,反应速率
 一定增大 D.催化剂可以降低反应的活化能,加快反应速率
一定增大 D.催化剂可以降低反应的活化能,加快反应速率②该总反应随催化剂浓度的增加,反应速率先增大后保持不变,请解释原因
您最近一年使用:0次
名校
解题方法
8 . 将 和空气(不参与反应)按体积比1:3混合通入含水8%的
和空气(不参与反应)按体积比1:3混合通入含水8%的 中制备
中制备 ,并用水吸收
,并用水吸收 (不含
(不含 )制备HClO溶液。实验装置如图。
)制备HClO溶液。实验装置如图。 )为棕黄色气体,沸点为3.8℃、42℃以上会分解生成
)为棕黄色气体,沸点为3.8℃、42℃以上会分解生成 和
和 ,
, 易溶于水、并与水反应生成HClO。
易溶于水、并与水反应生成HClO。
(1)装置A中盛装浓盐酸的仪器名称是_______ 。
(2)各装置的连接顺序为_______ 。
(3)下列说法正确的是_______。
(4)装置B中多孔球泡的作用是_______ 。
(5)写出B装置中制备 的化学方程式
的化学方程式_______ 。
(6)已知 可被
可被 还原,用下列实验方案测定装置E所得溶液中
还原,用下列实验方案测定装置E所得溶液中 的物质的量浓度:量取
的物质的量浓度:量取 上述
上述 溶液,并稀释至
溶液,并稀释至 ,再从其中取出
,再从其中取出 于锥形瓶中,用邻二氮菲作指示剂,并加入
于锥形瓶中,用邻二氮菲作指示剂,并加入 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 ,则原HClO溶液的浓度为
,则原HClO溶液的浓度为_______  。
。
 和空气(不参与反应)按体积比1:3混合通入含水8%的
和空气(不参与反应)按体积比1:3混合通入含水8%的 中制备
中制备 ,并用水吸收
,并用水吸收 (不含
(不含 )制备HClO溶液。实验装置如图。
)制备HClO溶液。实验装置如图。
 )为棕黄色气体,沸点为3.8℃、42℃以上会分解生成
)为棕黄色气体,沸点为3.8℃、42℃以上会分解生成 和
和 ,
, 易溶于水、并与水反应生成HClO。
易溶于水、并与水反应生成HClO。(1)装置A中盛装浓盐酸的仪器名称是
(2)各装置的连接顺序为
(3)下列说法正确的是_______。
A.装置C的作用是吸收 中的 中的 |
| B.反应过程中装置B需放在冷水中 |
C.相对用 直接溶于水制备 直接溶于水制备 ,此法的优点是制备的 ,此法的优点是制备的 纯度高、浓度大 纯度高、浓度大 |
D.工业上用装置A制 ,制得的 ,制得的 中会混有HCl 中会混有HCl |
(4)装置B中多孔球泡的作用是
(5)写出B装置中制备
 的化学方程式
的化学方程式(6)已知
 可被
可被 还原,用下列实验方案测定装置E所得溶液中
还原,用下列实验方案测定装置E所得溶液中 的物质的量浓度:量取
的物质的量浓度:量取 上述
上述 溶液,并稀释至
溶液,并稀释至 ,再从其中取出
,再从其中取出 于锥形瓶中,用邻二氮菲作指示剂,并加入
于锥形瓶中,用邻二氮菲作指示剂,并加入 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 ,则原HClO溶液的浓度为
,则原HClO溶液的浓度为 。
。
您最近一年使用:0次
名校
解题方法
9 . 锌在工业中有重要作用,也是人体必需的微量元素。请回答:
(1)基态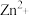 的价层电子排布式
的价层电子排布式_______ , 中阴离子空间结构为
中阴离子空间结构为_______ 。
(2)下列说法正确的是_______。
(3)已知: 和
和 的熔点数据如下表:
的熔点数据如下表:
 熔点明显高于
熔点明显高于 ,原因是
,原因是_______ 。
(4)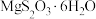 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。 个数为
个数为_______ 。已知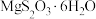 的摩尔质量是
的摩尔质量是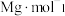 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为_______  。(
。( )
)
(1)基态
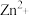 的价层电子排布式
的价层电子排布式 中阴离子空间结构为
中阴离子空间结构为(2)下列说法正确的是_______。
A.电负性: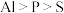 | B.离子半径: |
| C.Fe位于元素周期表的第四周期第Ⅷ族 | D.Cr在元素周期表中处于d区 |
(3)已知:
 和
和 的熔点数据如下表:
的熔点数据如下表:| 物质 | 熔点/℃ |
 | 800.7 |
 |  |
 熔点明显高于
熔点明显高于 ,原因是
,原因是(4)
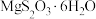 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
 个数为
个数为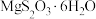 的摩尔质量是
的摩尔质量是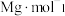 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 。(
。( )
)
您最近一年使用:0次
10 . 2024年1月从自然资源部获悉,四川雅江探获锂资源近百万吨,是亚洲迄今探明最大规模伟晶岩型单体锂矿”。锂对实现“碳中和”有重要意义。
(1)下列锂原子电子排布图表示的状态中,能量最高的是___________(填字母)。
(2) 是常用的还原剂,
是常用的还原剂, 中心原子Al的杂化方式为
中心原子Al的杂化方式为___________ 杂化,其阴离子的空间结构为___________ 。
(3)第二周期四种主族元素与锂组成的盐是一种新型电池的电解质,结构如图1。下列说法不正确的是___________。
(4)一种新型材料,其立方晶胞结构如图2所示,该物质的化学式为___________ 。 的体积与X的空腔大小相近,恰好能进入X的环内,且
的体积与X的空腔大小相近,恰好能进入X的环内,且 与氧原子的一对孤电子对作用形成稳定结构W(如图)。冠醚Y不能与
与氧原子的一对孤电子对作用形成稳定结构W(如图)。冠醚Y不能与 形成稳定结构的原因是
形成稳定结构的原因是___________ 。
(1)下列锂原子电子排布图表示的状态中,能量最高的是___________(填字母)。
A. | B.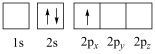 |
C. | D. |
(2)
 是常用的还原剂,
是常用的还原剂, 中心原子Al的杂化方式为
中心原子Al的杂化方式为(3)第二周期四种主族元素与锂组成的盐是一种新型电池的电解质,结构如图1。下列说法不正确的是___________。

A.该物质中存在的作用力有离子键、配位键、 键、 键、 键 键 |
B.基态原子未成对电子数: |
C.离子半径: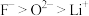 |
| D.阴离子中所有原子均满足8电子稳定结构 |
(4)一种新型材料,其立方晶胞结构如图2所示,该物质的化学式为

 的体积与X的空腔大小相近,恰好能进入X的环内,且
的体积与X的空腔大小相近,恰好能进入X的环内,且 与氧原子的一对孤电子对作用形成稳定结构W(如图)。冠醚Y不能与
与氧原子的一对孤电子对作用形成稳定结构W(如图)。冠醚Y不能与 形成稳定结构的原因是
形成稳定结构的原因是
您最近一年使用:0次




