解题方法
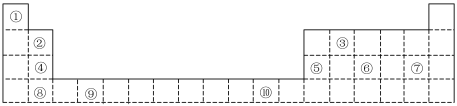
1 . 下表为元素周期表的一部分,其中的编号对应的元素。
(1)表中有___________ 种金属元素,其中属于ds区元素的是___________ (填元素符号)。
(2)表中元素⑥原子的最外电子层上未成对电子数为___________ 个。
(3)元素④的第一电离能___________ 元素⑤的第一电离能(填“>”“=”或“<”,下同);元素⑥的电负性___________ 元素⑦的电负性;元素⑦的简单离子的半径___________ 元素⑧的简单离子的半径。
(4)⑨号元素在周期表种的位置___________ ,位于___________ 区。元素周期表写出元素⑨的价层电子排布式___________ 。
(5)根据对角线规则,②与⑤的氧化物、氢氧化物的性质相似。写出少量②的最高价氧化物与氢氧化钠的水溶液反应所生成的盐的化学式___________ 。
(1)表中有
(2)表中元素⑥原子的最外电子层上未成对电子数为
(3)元素④的第一电离能
(4)⑨号元素在周期表种的位置
(5)根据对角线规则,②与⑤的氧化物、氢氧化物的性质相似。写出少量②的最高价氧化物与氢氧化钠的水溶液反应所生成的盐的化学式
您最近一年使用:0次
2 . 用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)生产ZnSO4∙7H2O的流程如下(已知PbO不溶于稀硫酸酸):
(1)“酸浸”时用的稀酸是_______ (写名称)。
(2)加入NaClO的目的是_______ ,加入ZnO除杂时pH控制范围是_______ ~5.0。
(3)写出ZnO除杂得到滤渣2的离子反应方程式_______ 。
(4)滤渣3是_______ (写化学式) 。
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、_______ 、 过滤、洗涤、干燥。
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=_______ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
| 沉淀完全的pH | 3.0 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是
(2)加入NaClO的目的是
(3)写出ZnO除杂得到滤渣2的离子反应方程式
(4)滤渣3是
(5)由滤液得到ZnSO4∙7H2O的操作是 蒸发浓缩、
(6)已知Fe3+沉淀完全的标准为1.0×10-6mol。L-1,根据题目条件求常温下Fe(OH)3的Ksp=
您最近一年使用:0次
3 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见图)中的重要反应之一
人工合成淀粉(节选途径见图)中的重要反应之一
反应②: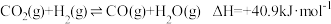
反应③: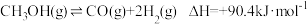
(1)反应①: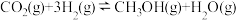 的
的
_______ 。
(2) 2的转化率与温度的关系如图所示。
2的转化率与温度的关系如图所示。_______ 逆反应速率(填“>或<或=”)。
②下列叙述能说明上述反应能达到化学平衡状态的是_______ 。(填字母)。
a.3v(CO2)=v(H2) b. 的体积分数不再改变
的体积分数不再改变
c.消耗1mol CO2的同时消耗3mol H2 d.混合气体的平均相对分子质量不再改变
③250℃后 2的平衡转化率降低的原因
2的平衡转化率降低的原因_______
(3)往一容积为 的密闭容器内,充入0.2mol CO2与
的密闭容器内,充入0.2mol CO2与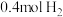 发生反应,反应达到c点时,从上图像可知在平衡时
发生反应,反应达到c点时,从上图像可知在平衡时 2的转化率是
2的转化率是_______ ,则c点时 的体积分数是
的体积分数是_______ ;平衡后再加入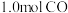 2后重新到达平衡,则H2的转化率
2后重新到达平衡,则H2的转化率_______ (填“增大”或“不变”或“减小”)。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见图)中的重要反应之一
人工合成淀粉(节选途径见图)中的重要反应之一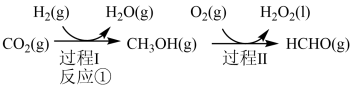
反应②:
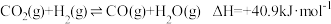
反应③:
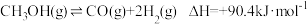
(1)反应①:
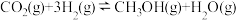 的
的
(2)
 2的转化率与温度的关系如图所示。
2的转化率与温度的关系如图所示。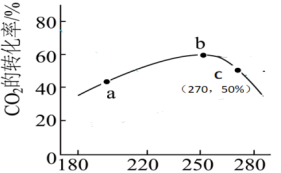
②下列叙述能说明上述反应能达到化学平衡状态的是
a.3v(CO2)=v(H2) b.
 的体积分数不再改变
的体积分数不再改变c.消耗1mol CO2的同时消耗3mol H2 d.混合气体的平均相对分子质量不再改变
③250℃后
 2的平衡转化率降低的原因
2的平衡转化率降低的原因(3)往一容积为
 的密闭容器内,充入0.2mol CO2与
的密闭容器内,充入0.2mol CO2与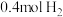 发生反应,反应达到c点时,从上图像可知在平衡时
发生反应,反应达到c点时,从上图像可知在平衡时 2的转化率是
2的转化率是 的体积分数是
的体积分数是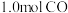 2后重新到达平衡,则H2的转化率
2后重新到达平衡,则H2的转化率
您最近一年使用:0次
4 . 某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,KIO3和Na2SO3可发生反应生成I2,生成的I2可用淀粉溶液检验,根据出现蓝色的时间来衡量该反应的速率。
回答下列问题:
(1)实验①③中V1=_______ ,V2=_______ 。
(2)出现蓝色的时间t1与t3大到小关系_______ 。
(3)实验②③的目的是_______ 。
(4)实验中加水的目的是_______ 。
(5)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.02 mol·L-1,则5 s内消耗Na2SO3的平均速率v(Na2SO3)=_______ 。
| 实验序号 | 0.1 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.1 mol·L-1Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 5 | t1 |
| ② | 5 | 5 | 30 | 25 | t2 |
| ③ | 5 | V2 | 20 | 25 | t3 |
(1)实验①③中V1=
(2)出现蓝色的时间t1与t3大到小关系
(3)实验②③的目的是
(4)实验中加水的目的是
(5)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.02 mol·L-1,则5 s内消耗Na2SO3的平均速率v(Na2SO3)=
您最近一年使用:0次
名校
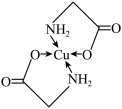
5 . 太阳能的开发利用在新能源研究中占据重要地位,单品硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物的结构如图所示。请回答下列问题:_______ 区,最外层原子轨道呈_______ 形。
(2)基态二价铜离子的电子排布式为_______ ,已知高温下 比CuO更稳定,试从核外电子排布角度解释
比CuO更稳定,试从核外电子排布角度解释_______ 。
(3)在基态硼原子中,核外存在_______ 个运动状态不同的电子。
(4) 的价层电子排布图为
的价层电子排布图为_______ 。
(5)根据元素周期律,电负性O_______ Se(填“大于”“小于”或“等于”),N、O、Se三种元素中的第一电离能最大的为_______ 。
(2)基态二价铜离子的电子排布式为
 比CuO更稳定,试从核外电子排布角度解释
比CuO更稳定,试从核外电子排布角度解释(3)在基态硼原子中,核外存在
(4)
 的价层电子排布图为
的价层电子排布图为(5)根据元素周期律,电负性O
您最近一年使用:0次
名校
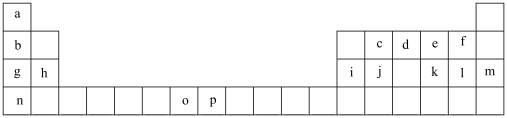
6 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题。_______ (用元素符号表示),1和n的离子半径较大的是_______ (填离子符号)。
(2)h的单质在空气中燃烧发出耀眼的白光,从原子结构角度解释是涉及电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,以下现象与该原理一样的是_______ (填字母)。
A.燃放焰火 B.棱镜分出的光 C.霓虹灯射出五颜六色的光
(3)o、p两元素的部分电离能数据如下表所示。
比较两元素的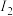 、
、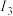 可知,气态
可知,气态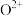 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你认为原因可能是
再失去一个电子难。对此,你认为原因可能是_______ 。
(4)第三周期8种元素其中电负性最大的是_______ (填图中的序号)。
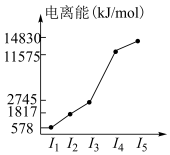
(5)表中所列的某主族元素的电离能情况如图所示,写出该元素的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式:_______ 。
(2)h的单质在空气中燃烧发出耀眼的白光,从原子结构角度解释是涉及电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,以下现象与该原理一样的是
A.燃放焰火 B.棱镜分出的光 C.霓虹灯射出五颜六色的光
(3)o、p两元素的部分电离能数据如下表所示。
电离能/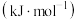 | 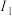 | 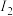 | 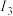 |
| o | 717 | 1509 | 3248 |
| p | 759 | 1561 | 2957 |
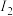 、
、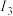 可知,气态
可知,气态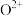 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你认为原因可能是
再失去一个电子难。对此,你认为原因可能是(4)第三周期8种元素其中电负性最大的是
(5)表中所列的某主族元素的电离能情况如图所示,写出该元素的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式:
您最近一年使用:0次
名校
解题方法
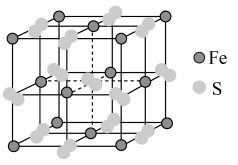
7 . 铁及其化合物在生产生活中有重要应用。Fe的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为anm。___________ ;写出其阴离子的电子式___________ 。
(2)下列说法正确的是___________。
(3)已知阿伏加德罗常数的值为 ,该晶胞密度为
,该晶胞密度为___________  。铁原子之间最短距离为
。铁原子之间最短距离为___________ 。
(4)在该晶胞中,每个 周围它最近且等距的
周围它最近且等距的 有
有___________ 个;下列属于从该晶体结构中分割出的部分结构图的是___________ 。(白球、黑球分别代表题中阴、阳离子)
(2)下列说法正确的是___________。
| A.该晶胞与NaCl晶胞结构相似 |
| B.该晶胞中的阴离子存在两种不同取向 |
C.该晶体结构中存在 和 和 |
| D.该物质中含有离子键、共价键和分子间作用力 |
(3)已知阿伏加德罗常数的值为
 ,该晶胞密度为
,该晶胞密度为 。铁原子之间最短距离为
。铁原子之间最短距离为(4)在该晶胞中,每个
 周围它最近且等距的
周围它最近且等距的 有
有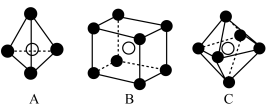
您最近一年使用:0次
8 . 为尽快实现“碳达峰”“碳中和”,碳化学研究已成为当前科学研究的热点。由CO2合成淀粉的部分流程如图所示:
①
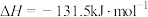
②
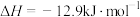
③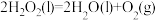
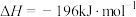
④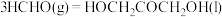
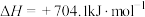
回答下列问题:
(1)反应①中,反应物的总能量_______ (填“大于”、“小于”或“等于”,下同)生成物的总能量,反应④中,反应物的总键能_______ 生成物的总键能。
(2)反应①中使用催化剂的作用有_______ (填标号);
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界_______ (填“吸收”或“放出”)的热量为______ kJ。(所有能量均充分利用,且不考㤐能量的损耗)
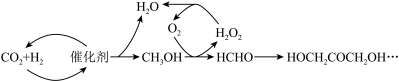
①

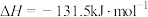
②

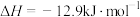
③
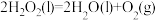
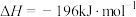
④
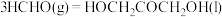
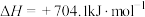
回答下列问题:
(1)反应①中,反应物的总能量
(2)反应①中使用催化剂的作用有
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界
您最近一年使用:0次
9 . 目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。___________ 。
(2)温度降低,平衡常数K___________ (填“增大”、“不变”或“减小”)。
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率 (H2)为
(H2)为____________ mol·L-1·min-1, CO2和H2的转化率比是___________ 。___________ 。
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。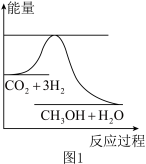
(2)温度降低,平衡常数K
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率
 (H2)为
(H2)为
您最近一年使用:0次
名校
解题方法
10 . 利用如图所示装置测定中和热的实验步骤如下:
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,用温度计测出其温度;
③将NaOH溶液分次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的平均温度;
④重复测量2~3次,准确记录数据。
(1)上述步骤中有两点错误,分别是____ 、____ 。
(2)____ (填“能”或“不能”)用相同形状的细铁丝代替玻璃搅拌器,理由是____ 。
(3)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1稀盐酸恰好完全反应,其反应热分别为 H1、
H1、 H2、
H2、 H3,则
H3,则 H1、
H1、 H2、
H2、 H3的大小关系为
H3的大小关系为____ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1。为了计算中和热,某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热 H=
H=____ (结果保留1位小数)。
(5)上述实验结果与中和热数值57.3kJ·mol-1有偏差,产生偏差的原因不可能为___ (填序号)。
①实验装置保温、隔热效果差 ②用量筒量取盐酸溶液体积时仰视读数
③分多次把NaOH溶液倒入内筒中 ④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
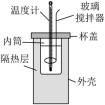
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,用温度计测出其温度;
③将NaOH溶液分次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的平均温度;
④重复测量2~3次,准确记录数据。
(1)上述步骤中有两点错误,分别是
(2)
(3)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1稀盐酸恰好完全反应,其反应热分别为
 H1、
H1、 H2、
H2、 H3,则
H3,则 H1、
H1、 H2、
H2、 H3的大小关系为
H3的大小关系为(4)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1。为了计算中和热,某学生实验记录数据如表:
| 起始温度t1/℃ | 终止温度t2/℃ | ||
| 实验序号 | 盐酸 | 氢氧化钠溶液 | 混合溶液 |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
 H=
H=(5)上述实验结果与中和热数值57.3kJ·mol-1有偏差,产生偏差的原因不可能为
①实验装置保温、隔热效果差 ②用量筒量取盐酸溶液体积时仰视读数
③分多次把NaOH溶液倒入内筒中 ④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
您最近一年使用:0次



