名校
1 . 2020年9月22日,中国政府在第75届联合国大会上提出:“中国将提高国家自主贡献力度,采取更有力的政策和措施。二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。” 碳中和也叫碳补偿(Carbon Offset),是现代人为减缓全球变暖所作的努力之一。碳中和的实现方式包括两种:一是通过植树造林等方式增加CO2的吸收量,二是通过技术手段减少CO2的排放量。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌ CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g) ⇌ CH3OH(g) △H2= —99kJ·mol-1
(1)总反应的
_______ kJ·mol-1;
(2)氢氧燃料电池具有启动快,效率高等优点,若电解质为酸性,氢氧燃料电池的正极反应为_______
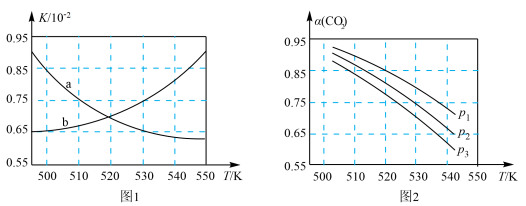
(3)图1中能正确反映平衡常数K随温度变化关系的曲线为_______ (填曲线标记字母),体系中的CO2平衡转化率(a)与温度和压强的关系如图2所示,则图2中的压强由大到小为_______ 。_______ (用含a的式子表示)。
Ⅱ. 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为: 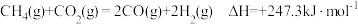 。回答下列问题:
。回答下列问题:
(5)该反应体系的熵值变化为_______ (填“增加”或“减小”);根据公式△G=△H—T△S判断:此反应在_______ (填“低温”或“高温”)条件下可以自发进行。
(6)其它条件相同,在不同催化剂(A、B)作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图3所示。
的产率随反应温度的变化如图3所示。_______ ,在催化剂A、B作用下,它们反应活化能分别用 、
、 表示,则
表示,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(7)将原料 和
和 按等物质的量充入密闭容器中,保持体系压强为
按等物质的量充入密闭容器中,保持体系压强为 发生反应:
发生反应: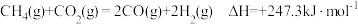 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图4所示,则在
体积分数与温度的关系如图4所示,则在 、
、 下,达平衡时
下,达平衡时 转化率=
转化率=_______ 。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌ CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g) ⇌ CH3OH(g) △H2= —99kJ·mol-1
(1)总反应的

(2)氢氧燃料电池具有启动快,效率高等优点,若电解质为酸性,氢氧燃料电池的正极反应为
(3)图1中能正确反映平衡常数K随温度变化关系的曲线为
Ⅱ.
 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为: 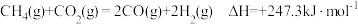 。回答下列问题:
。回答下列问题:(5)该反应体系的熵值变化为
(6)其它条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图3所示。
的产率随反应温度的变化如图3所示。 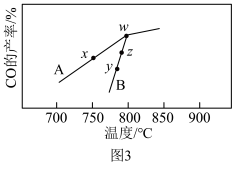
 、
、 表示,则
表示,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(7)将原料
 和
和 按等物质的量充入密闭容器中,保持体系压强为
按等物质的量充入密闭容器中,保持体系压强为 发生反应:
发生反应: 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图4所示,则在
体积分数与温度的关系如图4所示,则在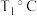 、
、 下,达平衡时
下,达平衡时 转化率=
转化率=
您最近一年使用:0次
2 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施_______ (写出一条,合理即可)。
(2)滤渣1经过处理可作为制备水玻璃( 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式_______ 。
(3)加入试剂除铁前,滤液1中的阳离子除了 、
、 外还有的阳离子是
外还有的阳离子是_______ (填离子符号)。滤渣2主要成分为 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理_______ 。
(4)向滤液1中加入的试剂可以是 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因_______ 。
(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于_______ (保留小数点一位)。
(6)某兴趣小组为了测定晶体中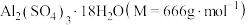 的质量分数,进行如下实验:
的质量分数,进行如下实验:
①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。
则晶体中 的质量分数是
的质量分数是_______ 。
 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于
(6)某兴趣小组为了测定晶体中
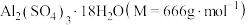 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入
 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。则晶体中
 的质量分数是
的质量分数是
您最近一年使用:0次
名校
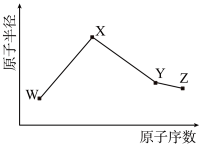
3 . W、X、Y、Z是元素周期表中的四种短周期元素,其相关信息及原子半径与原子序数的关系如表所示。请回答下列问题:
(1)W与X形成的含有共价键的常见化合物的电子式为_______ 。
(2)Y的价层电子排布式_______ 。
(3)Z的简单氢化物沸点比同主族上一周期元素简单氢化物沸点要_______ (填“高”或“低”)
(4)CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于顶点和面心,
位于顶点和面心, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。 距离最近的
距离最近的 数目为
数目为_______ 。
② CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为_______  。
。
| 元素 | 相关信息 | 原子半径与原子序数的关系 |
| W | 其一种核素的质量数为18,中子数为10 |
|
| X | 其原子与电子排布式为1s22s22p6的原子的核外电子数相差1 | |
| Y | 其单质是一种常见的半导体材料 | |
| Z | 电负性在同周期元素中最大 |
(1)W与X形成的含有共价键的常见化合物的电子式为
(2)Y的价层电子排布式
(3)Z的简单氢化物沸点比同主族上一周期元素简单氢化物沸点要
(4)CuS晶胞中
 的位置如图1所示,
的位置如图1所示, 位于顶点和面心,
位于顶点和面心, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
 距离最近的
距离最近的 数目为
数目为② CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
4 . 2020年9月我国明确提出2030年实现“碳达练”与2060年实现“碳中和”的目标,倡导绿色、环保、低碳的生活方式。二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 和
和 在铁系催化剂作用下发生化学反应:
在铁系催化剂作用下发生化学反应:
Ⅰ.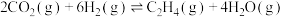

Ⅱ.

回答下列问题:
(1)反应Ⅰ能自发进行,则
___________ 0(填“<”“>”或“=”):该反应自发进行的条件是___________ (填“高温”或“低温”)。
(2)在密闭容器中通入1
 和3
和3
 ,在铁系催化剂作用下进行反应,某一压强下,
,在铁系催化剂作用下进行反应,某一压强下, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。___________ (填标号)。
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.反应Ⅱ化学方程式前后物质的化学计量数之和相等、所以增大压强反应Ⅱ的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将 和
和 的初始物质的量之比变为2∶3,可提高
的初始物质的量之比变为2∶3,可提高 平衡转化率
平衡转化率
②图1中点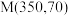 ,此时乙烯的选择性为
,此时乙烯的选择性为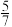 (选择性:转化的
(选择性:转化的 中,用于生成
中,用于生成 的
的 所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
___________ (结果用分数表示)。
(3)利用电解法也可以实现 转化为
转化为 ,试写出在酸性介质中该电解池阴极的电极反应式:
,试写出在酸性介质中该电解池阴极的电极反应式:___________ 。
(4)工业上常用乙烯水合法制乙醇,乙醇脱水可制得二乙醚:
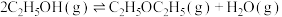
 。
。
实验测得: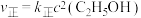 ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入0.2
温度下,向2L恒容密闭容器中加入0.2
 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,用
的体积分数为25%,用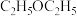 表示的平均反应速率为
表示的平均反应速率为___________  ,当温度变为
,当温度变为 时,
时,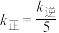 ,则
,则
___________  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
(5)温度为T℃时、在恒容密闭容器中发生反应 ,反应物
,反应物 和
和 的平衡转化率分别随着水、一氧化碳的物质的量之比
的平衡转化率分别随着水、一氧化碳的物质的量之比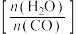 的变化曲线如图所示:
的变化曲线如图所示:
 、1.8
、1.8
 、3.2
、3.2
 、1.2
、1.2
 ,发生上述反应,反应进行的方向为
,发生上述反应,反应进行的方向为___________ (填“正向”或“逆向”)。
 和
和 在铁系催化剂作用下发生化学反应:
在铁系催化剂作用下发生化学反应:Ⅰ.
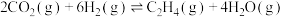

Ⅱ.


回答下列问题:
(1)反应Ⅰ能自发进行,则

(2)在密闭容器中通入1

 和3
和3
 ,在铁系催化剂作用下进行反应,某一压强下,
,在铁系催化剂作用下进行反应,某一压强下, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。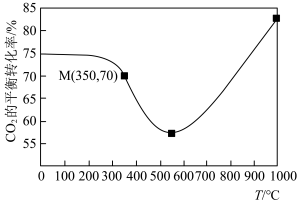
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.反应Ⅱ化学方程式前后物质的化学计量数之和相等、所以增大压强反应Ⅱ的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将
 和
和 的初始物质的量之比变为2∶3,可提高
的初始物质的量之比变为2∶3,可提高 平衡转化率
平衡转化率②图1中点
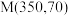 ,此时乙烯的选择性为
,此时乙烯的选择性为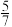 (选择性:转化的
(选择性:转化的 中,用于生成
中,用于生成 的
的 所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
(3)利用电解法也可以实现
 转化为
转化为 ,试写出在酸性介质中该电解池阴极的电极反应式:
,试写出在酸性介质中该电解池阴极的电极反应式:(4)工业上常用乙烯水合法制乙醇,乙醇脱水可制得二乙醚:
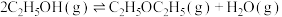
 。
。实验测得:
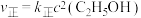 ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入0.2
温度下,向2L恒容密闭容器中加入0.2
 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,用
的体积分数为25%,用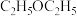 表示的平均反应速率为
表示的平均反应速率为 ,当温度变为
,当温度变为 时,
时,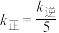 ,则
,则
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(5)温度为T℃时、在恒容密闭容器中发生反应
 ,反应物
,反应物 和
和 的平衡转化率分别随着水、一氧化碳的物质的量之比
的平衡转化率分别随着水、一氧化碳的物质的量之比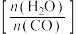 的变化曲线如图所示:
的变化曲线如图所示: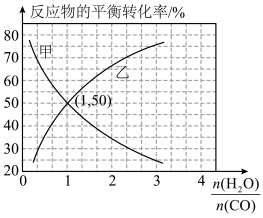

 、1.8
、1.8
 、3.2
、3.2
 、1.2
、1.2
 ,发生上述反应,反应进行的方向为
,发生上述反应,反应进行的方向为
您最近一年使用:0次
名校
5 . 高铁酸钾( )是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾(
)是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾( )可用于自来水的杀菌消毒和净化,一种由磁铁矿(主要成分为
)可用于自来水的杀菌消毒和净化,一种由磁铁矿(主要成分为 ,还含有少量的
,还含有少量的 、
、 、
、 等)制备高铁酸钾的过程如下图所示:
等)制备高铁酸钾的过程如下图所示:
①高铁酸钾( )难溶于醇等有机溶剂;
)难溶于醇等有机溶剂;
②25℃时部分难溶物的溶度积如下:
回答下列问题:
(1)“酸溶”后得到的滤渣的主要成分为___________ 。
(2)加入 “氧化”过程主要发生的离子方程式为
“氧化”过程主要发生的离子方程式为___________ 。
(3)根据制备过程,步骤“调 ”过程应控制
”过程应控制 范围
范围___________ (已知:氧化后镁、铝离子浓度为0.01 ,当离子浓度小于
,当离子浓度小于 时认为离子沉淀完全)。“氧化、过滤”过程中生成
时认为离子沉淀完全)。“氧化、过滤”过程中生成 ,写出该过程的离子方程式:
,写出该过程的离子方程式:___________ 。
(4) 粗产品含有
粗产品含有 、
、 等杂质,用
等杂质,用___________ 方法进行分离提纯,其提纯步骤为:将一定量的 粗产品溶于冷的3
粗产品溶于冷的3
 溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和
溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和 溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用
溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用___________ (填标号)。
a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(5)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:



现称取a g高铁酸钾( )(摩尔质量为M
)(摩尔质量为M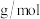 )样品溶于过量的碱性亚铬酸盐
)样品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在250
溶液中,充分反应后过滤,滤液在250 容量瓶中定容,每次取25.00
容量瓶中定容,每次取25.00 于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c
于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c 标准溶液滴定至终点,消耗标准溶液V
标准溶液滴定至终点,消耗标准溶液V ,该产品中高铁酸钾(
,该产品中高铁酸钾( )的纯度为
)的纯度为___________ (用含a、M、c、V的代数式表示)。
 )是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾(
)是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾( )可用于自来水的杀菌消毒和净化,一种由磁铁矿(主要成分为
)可用于自来水的杀菌消毒和净化,一种由磁铁矿(主要成分为 ,还含有少量的
,还含有少量的 、
、 、
、 等)制备高铁酸钾的过程如下图所示:
等)制备高铁酸钾的过程如下图所示:
①高铁酸钾(
 )难溶于醇等有机溶剂;
)难溶于醇等有机溶剂;②25℃时部分难溶物的溶度积如下:
 |  |  |  |
 |  |  |  |
(1)“酸溶”后得到的滤渣的主要成分为
(2)加入
 “氧化”过程主要发生的离子方程式为
“氧化”过程主要发生的离子方程式为(3)根据制备过程,步骤“调
 ”过程应控制
”过程应控制 范围
范围 ,当离子浓度小于
,当离子浓度小于 时认为离子沉淀完全)。“氧化、过滤”过程中生成
时认为离子沉淀完全)。“氧化、过滤”过程中生成 ,写出该过程的离子方程式:
,写出该过程的离子方程式:(4)
 粗产品含有
粗产品含有 、
、 等杂质,用
等杂质,用 粗产品溶于冷的3
粗产品溶于冷的3
 溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和
溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和 溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用
溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(5)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:



现称取a g高铁酸钾(
 )(摩尔质量为M
)(摩尔质量为M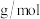 )样品溶于过量的碱性亚铬酸盐
)样品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在250
溶液中,充分反应后过滤,滤液在250 容量瓶中定容,每次取25.00
容量瓶中定容,每次取25.00 于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c
于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c 标准溶液滴定至终点,消耗标准溶液V
标准溶液滴定至终点,消耗标准溶液V ,该产品中高铁酸钾(
,该产品中高铁酸钾( )的纯度为
)的纯度为
您最近一年使用:0次
名校
6 . 以下是用苯作为原料制备一系列化合物的转化关系图。
(1)A中碳、氮原子杂化轨道类型是___________ ,B的名称为___________ 。
(2)比较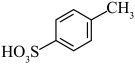 和D的酸性强弱:
和D的酸性强弱:___________ (用结构简式表示),由D生成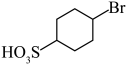 的反应类型为
的反应类型为___________ 。
(3)由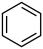 生成A的化学反应方程式为
生成A的化学反应方程式为___________ 。
(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以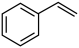 为原料合成E的化学反应方程式:
为原料合成E的化学反应方程式:___________ 。化合物F的分子式为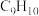 ,和
,和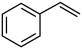 互为同系物,F的可能结构有
互为同系物,F的可能结构有___________ 种,其中一种核磁共振氢谱有五组吸收峰,且峰面积之比为3∶2∶2∶1∶2,写出其结构简式:___________ (任写一种)。
(5)已知: (R表示烃基);
(R表示烃基);
苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响。
根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为___________ 。
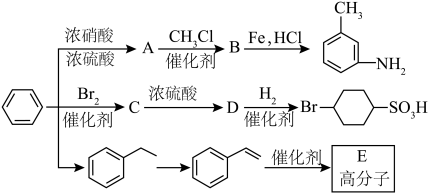
已知:
(1)A中碳、氮原子杂化轨道类型是
(2)比较
 和D的酸性强弱:
和D的酸性强弱: 的反应类型为
的反应类型为(3)由
 生成A的化学反应方程式为
生成A的化学反应方程式为(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以
 为原料合成E的化学反应方程式:
为原料合成E的化学反应方程式: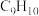 ,和
,和 互为同系物,F的可能结构有
互为同系物,F的可能结构有(5)已知:
 (R表示烃基);
(R表示烃基);苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响。
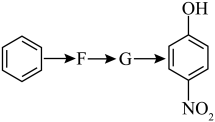
根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
您最近一年使用:0次
名校
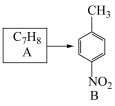
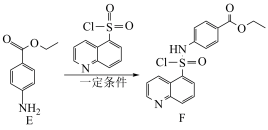
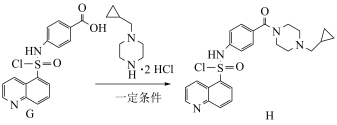
7 . PKR抑制剂(H)可用于治疗遗传性溶血性贫血。一种制取PKR抑制剂的合成路线如下:
(1)C中官能团的名称是________ 。D→E的反应类型为________ ;
(2)A→B反应所需的试剂及条件为________________ ;
(3)E在酸性条件下发生水解反应的一种产物的分子式为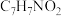 ,该分子经聚合反应可制成高分子纤维。该聚合反应化学方程式为
,该分子经聚合反应可制成高分子纤维。该聚合反应化学方程式为________________ ;
(4)PKR抑制剂(H)分子中N原子的杂化方式为________ ;
(5)在E的芳香族同分异构体中,含有硝基且苯环上只有两个取代基的结构有________ 种(不考虑立体异构),其中核磁共振氢谱显示有四组峰的结构简式为________________ ;
(6)由F合成G的过程需要用到的四氢呋喃(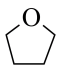 )作为溶剂。
)作为溶剂。________________ (无机试剂任选)。
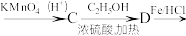

(1)C中官能团的名称是
(2)A→B反应所需的试剂及条件为
(3)E在酸性条件下发生水解反应的一种产物的分子式为
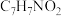 ,该分子经聚合反应可制成高分子纤维。该聚合反应化学方程式为
,该分子经聚合反应可制成高分子纤维。该聚合反应化学方程式为(4)PKR抑制剂(H)分子中N原子的杂化方式为
(5)在E的芳香族同分异构体中,含有硝基且苯环上只有两个取代基的结构有
(6)由F合成G的过程需要用到的四氢呋喃(
 )作为溶剂。
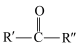
)作为溶剂。已知: +
+

您最近一年使用:0次
名校
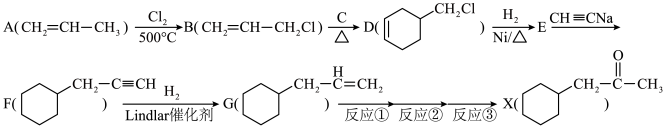
8 . 有机物X的合成流程图如下所示:
①醛类物质能发生银镜反应___________ 。
(2)写出A中碳原子的杂化方式:___________ 。
(3)化合物C最多有___________ 个原子共平面。
(4)化合物E的分子式为___________ ,分别写出E在NaOH水溶液和NaOH乙醇溶液中的化学反应方程式___________ 、___________ 。
(5)符合下列条件的X的同分异构体有___________ 种(不考虑立体异构)。
a.含有五元环结构
b.五元环上有两个取代基,分别连接在不同碳原子上
c.能发生银镜反应
①醛类物质能发生银镜反应
②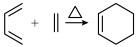
(2)写出A中碳原子的杂化方式:
(3)化合物C最多有
(4)化合物E的分子式为
(5)符合下列条件的X的同分异构体有
a.含有五元环结构
b.五元环上有两个取代基,分别连接在不同碳原子上
c.能发生银镜反应
您最近一年使用:0次
名校
9 . Ⅰ.设 为分压平衡常数(用分压代替浓度,气体分压
为分压平衡常数(用分压代替浓度,气体分压 总压
总压 该组分的物质的量分数),50℃、101kPa下,将足量的
该组分的物质的量分数),50℃、101kPa下,将足量的 、
、 置于一个密闭容器中,再充入已除去
置于一个密闭容器中,再充入已除去 的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为
的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为 。
。
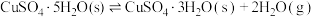
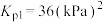
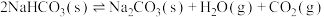

(1)①平衡时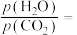
___________ ,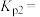
___________ 。
②平衡后,用总压为101kPa的潮湿空气[其中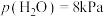 、
、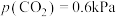 ]替换容器中的气体,50℃下达到新平衡。容器内,
]替换容器中的气体,50℃下达到新平衡。容器内, 质量将
质量将___________ (填“增加”“减少”或“不变”)。
Ⅱ.反应中产生的 可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。
可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是___________ 。
Ⅲ. 还可以通过催化加氢制甲醇,其总反应可表示为:
还可以通过催化加氢制甲醇,其总反应可表示为: 。向另一恒容密闭容器中按
。向另一恒容密闭容器中按 和
和 物质的量的比为
物质的量的比为 投料,在有催化剂的密闭容器中进行以下反应:
投料,在有催化剂的密闭容器中进行以下反应:
主反应:
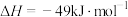
副反应:

测得 平衡转化率、和CO选择性[转化的
平衡转化率、和CO选择性[转化的 中生成或CO的百分比,如:选择性
中生成或CO的百分比,如:选择性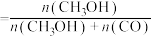 ]随温度、压强变化情况分别如图2、图3所示:
]随温度、压强变化情况分别如图2、图3所示: 的平衡转化率增大,而
的平衡转化率增大,而 的选择性降低。分析其原因:
的选择性降低。分析其原因:___________ 。
②图3中,温度 时,三条曲线几乎交于一点,分析其原因:
时,三条曲线几乎交于一点,分析其原因:___________ 。
(4)合成的甲醇可利用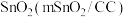 和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。
和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。___________ 。
②若有1mol 通过质子交换膜时,则该装置生成
通过质子交换膜时,则该装置生成 和HCOOH共计
和HCOOH共计___________ mol。
 为分压平衡常数(用分压代替浓度,气体分压
为分压平衡常数(用分压代替浓度,气体分压 总压
总压 该组分的物质的量分数),50℃、101kPa下,将足量的
该组分的物质的量分数),50℃、101kPa下,将足量的 、
、 置于一个密闭容器中,再充入已除去
置于一个密闭容器中,再充入已除去 的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为
的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为 。
。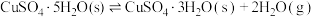
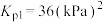
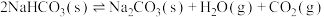

(1)①平衡时
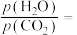
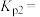
②平衡后,用总压为101kPa的潮湿空气[其中
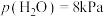 、
、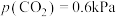 ]替换容器中的气体,50℃下达到新平衡。容器内,
]替换容器中的气体,50℃下达到新平衡。容器内, 质量将
质量将Ⅱ.反应中产生的
 可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。
可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。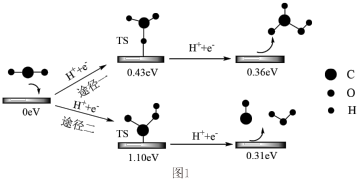
 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是Ⅲ.
 还可以通过催化加氢制甲醇,其总反应可表示为:
还可以通过催化加氢制甲醇,其总反应可表示为: 。向另一恒容密闭容器中按
。向另一恒容密闭容器中按 和
和 物质的量的比为
物质的量的比为 投料,在有催化剂的密闭容器中进行以下反应:
投料,在有催化剂的密闭容器中进行以下反应:主反应:

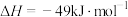
副反应:


测得
 平衡转化率、和CO选择性[转化的
平衡转化率、和CO选择性[转化的 中生成或CO的百分比,如:选择性
中生成或CO的百分比,如:选择性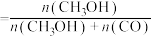 ]随温度、压强变化情况分别如图2、图3所示:
]随温度、压强变化情况分别如图2、图3所示: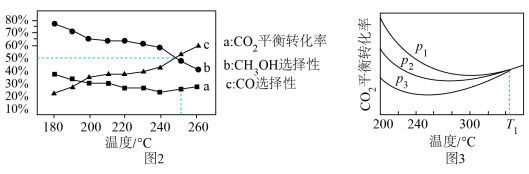
 的平衡转化率增大,而
的平衡转化率增大,而 的选择性降低。分析其原因:
的选择性降低。分析其原因:②图3中,温度
 时,三条曲线几乎交于一点,分析其原因:
时,三条曲线几乎交于一点,分析其原因:(4)合成的甲醇可利用
 和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。
和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。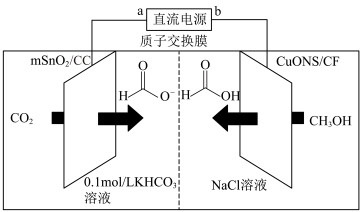
②若有1mol
 通过质子交换膜时,则该装置生成
通过质子交换膜时,则该装置生成 和HCOOH共计
和HCOOH共计
您最近一年使用:0次
名校
10 . 废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下:___________ ,“碱浸”步骤中铝溶解的离子方程式为___________ 。
(2)已知Li在化合物中显+1价, 中Co的化合价显+3价,“酸浸”步骤中
中Co的化合价显+3价,“酸浸”步骤中 固体溶解的化学方程式为
固体溶解的化学方程式为___________ 。
(3)“酸浸”后的溶液中含有少量 、
、 、
、 ,其中除
,其中除 的离子方程式为
的离子方程式为___________ ,废渣2的主要成分是___________ 。
(4)“沉钴”过程发生反应的化学方程式为___________ 。
(5)“母液”中的主要溶质成分是___________ (填化学式)。
 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下: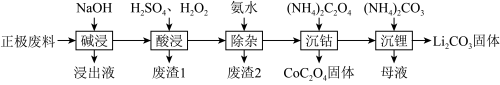
(2)已知Li在化合物中显+1价,
 中Co的化合价显+3价,“酸浸”步骤中
中Co的化合价显+3价,“酸浸”步骤中 固体溶解的化学方程式为
固体溶解的化学方程式为(3)“酸浸”后的溶液中含有少量
 、
、 、
、 ,其中除
,其中除 的离子方程式为
的离子方程式为(4)“沉钴”过程发生反应的化学方程式为
(5)“母液”中的主要溶质成分是
您最近一年使用:0次