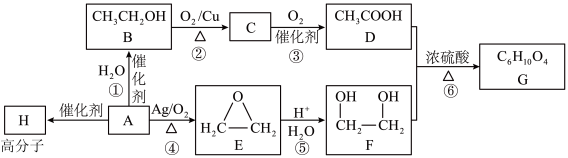
1 . 有机物A为煤的干馏产物之一,其产量可以用来衡量一个国家石油化工的发展水平,以A为原料合成香料G的流程如下:
(1)C的官能团名称为_______ ,常用于检验该官能团的一种试剂名称为_______ 。
(2)写出反应①的化学反应方程式_______ 。
(3)写出反应⑤的化学反应方程式_______ ,此反应的原子利用率为_______ 。
(4)1molF与足量的金属钠反应可产生_______ L气体(标准状况)。相对分子质量比A多14的物质的高聚物的结构简式_______ 。
(5)F经酸性 溶液氧化可转化为J
溶液氧化可转化为J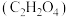 ,J与F可反应生成一种六元环状化合物,写出J与F反应的化学方程式
,J与F可反应生成一种六元环状化合物,写出J与F反应的化学方程式_______ 。
(1)C的官能团名称为
(2)写出反应①的化学反应方程式
(3)写出反应⑤的化学反应方程式
(4)1molF与足量的金属钠反应可产生
(5)F经酸性
 溶液氧化可转化为J
溶液氧化可转化为J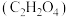 ,J与F可反应生成一种六元环状化合物,写出J与F反应的化学方程式
,J与F可反应生成一种六元环状化合物,写出J与F反应的化学方程式
您最近一年使用:0次
解题方法
2 . 实验室为探究铜与浓硫酸的反应,并验证 的性质,设计如图所示装置进行实验。
的性质,设计如图所示装置进行实验。
(1)装置A中的反应,浓硫酸体现了_______ 性和_______ 性。
(2)装置B中酸性 溶液逐渐褪色,证明
溶液逐渐褪色,证明 具有
具有_______ 性;装置C中发生反应的化学方程式_______ 。
(3)装置D的作用是_______ ;实验结束时需从导管a通入大量空气,其目的是_______ 。
(4)装置E中NaOH溶液足量,写出E中反应的离子方程式_______ 。
(5) 溶于水生成
溶于水生成 ,已知酸性
,已知酸性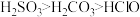 ,为了证明酸性
,为了证明酸性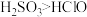 ,将
,将 通入到下列试剂,下列试剂排序正确的是_______(填选项)。
通入到下列试剂,下列试剂排序正确的是_______(填选项)。
①小苏打溶液;②品红溶液;③酸性 溶液;④漂白粉溶液
溶液;④漂白粉溶液
(6)实验室制取的乙烯中常混有少量 ,用下面装置证明混合气体中含有乙烯。其中Ⅱ中为品红溶液,Ⅲ中为溴的四氯化碳溶液。
,用下面装置证明混合气体中含有乙烯。其中Ⅱ中为品红溶液,Ⅲ中为溴的四氯化碳溶液。_______ (填字母)。
a.酸性 溶液 b.NaOH溶液 c.
溶液 b.NaOH溶液 c. 溶液
溶液
②证明含有乙烯的现象是_______ 。
 的性质,设计如图所示装置进行实验。
的性质,设计如图所示装置进行实验。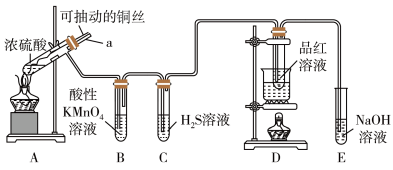
(1)装置A中的反应,浓硫酸体现了
(2)装置B中酸性
 溶液逐渐褪色,证明
溶液逐渐褪色,证明 具有
具有(3)装置D的作用是
(4)装置E中NaOH溶液足量,写出E中反应的离子方程式
(5)
 溶于水生成
溶于水生成 ,已知酸性
,已知酸性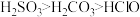 ,为了证明酸性
,为了证明酸性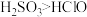 ,将
,将 通入到下列试剂,下列试剂排序正确的是_______(填选项)。
通入到下列试剂,下列试剂排序正确的是_______(填选项)。①小苏打溶液;②品红溶液;③酸性
 溶液;④漂白粉溶液
溶液;④漂白粉溶液| A.②①③④ | B.③②①④ | C.①③②④ | D.④③②① |
(6)实验室制取的乙烯中常混有少量
 ,用下面装置证明混合气体中含有乙烯。其中Ⅱ中为品红溶液,Ⅲ中为溴的四氯化碳溶液。
,用下面装置证明混合气体中含有乙烯。其中Ⅱ中为品红溶液,Ⅲ中为溴的四氯化碳溶液。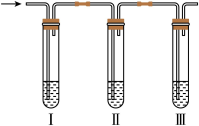
a.酸性
 溶液 b.NaOH溶液 c.
溶液 b.NaOH溶液 c. 溶液
溶液②证明含有乙烯的现象是
您最近一年使用:0次
3 . 按要求回答下列问题
(1)已知: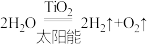 ,根据下表数据回答:
,根据下表数据回答:
①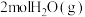 完全分解需
完全分解需_______ (填“放出”或“吸收”)能量_______ kJ。
②能正确表示该过程能量变化的示意图是_______ 。 和
和 发生反应,生成
发生反应,生成 和
和 ,
, 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。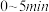 内,
内,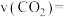
_______  。
。
②下列说明该反应一定达到化学平衡状态的是_______ 。
a.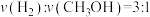
b.容器中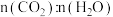 不再变化
不再变化
c.容器中气体压强不再变化
d.容器中气体密度不再变化
e.体系的温度保持不再变化
(3)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。_______ (填“a”或“b”),该电极上发生的电极反应是_______ 。
②电池工作时产生的水会以水蒸气的形式被气体物质带出,在出口加装冷凝器可以将水回收,冷凝器应装在出口_______ (填“c”或“d”)处。
③电池工作时,电解质溶液会因稀释及吸收 而变质,此时电解质溶液的pH将
而变质,此时电解质溶液的pH将_______ (填“升高”或“降低”)。
(1)已知:
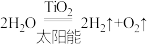 ,根据下表数据回答:
,根据下表数据回答:| 化学键 |  |  |  |
键能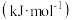 | 436 | 496 | 463 |
 完全分解需
完全分解需②能正确表示该过程能量变化的示意图是
A.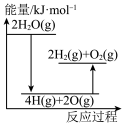 B.
B.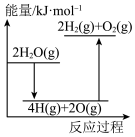
C.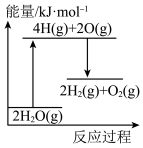 D.
D.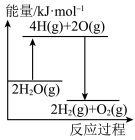
 和
和 发生反应,生成
发生反应,生成 和
和 ,
, 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。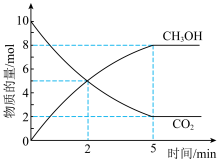
 内,
内,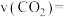
 。
。②下列说明该反应一定达到化学平衡状态的是
a.
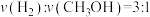
b.容器中
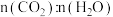 不再变化
不再变化c.容器中气体压强不再变化
d.容器中气体密度不再变化
e.体系的温度保持不再变化
(3)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。
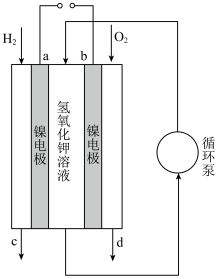
②电池工作时产生的水会以水蒸气的形式被气体物质带出,在出口加装冷凝器可以将水回收,冷凝器应装在出口
③电池工作时,电解质溶液会因稀释及吸收
 而变质,此时电解质溶液的pH将
而变质,此时电解质溶液的pH将
您最近一年使用:0次
解题方法
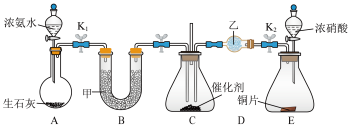
4 . Ⅰ.某化学自主实验小组利用如图所示装置探究NO2能否被NH3还原为无污染气体(K1、K2为止水夹,夹持固定及加热装置略去)。___________ (用文字表述)。
(2)装置E发生反应的化学方程式为___________ 。
(3)甲、乙分别是___________ (填字母)。
a.浓硫酸、浓硫酸 b.碱石灰、无水氯化钙
c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(4)若NO2能够被NH3还原,则反应的化学方程式为___________ 。
(5)此实验装置存在一个明显的缺陷是___________ 。
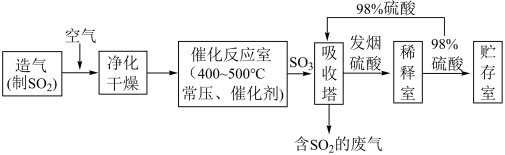
Ⅱ.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:___________ 。
(7)写出催化反应室中SO2被氧化为SO3的化学方程式:___________ 。
(8)实验室模拟硫酸工业的尾气中含有少量SO2,可用___________ (填试剂名称)吸收。
(2)装置E发生反应的化学方程式为
(3)甲、乙分别是
a.浓硫酸、浓硫酸 b.碱石灰、无水氯化钙
c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(4)若NO2能够被NH3还原,则反应的化学方程式为
(5)此实验装置存在一个明显的缺陷是
Ⅱ.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
(7)写出催化反应室中SO2被氧化为SO3的化学方程式:
(8)实验室模拟硫酸工业的尾气中含有少量SO2,可用
您最近一年使用:0次
解题方法
5 . 以淀粉为原料制备具有果香味的物质 和高分子化合物
和高分子化合物 的路线如下所示,其中A的产量可以用来衡量一个国家石油化学工业的发展水平。
的路线如下所示,其中A的产量可以用来衡量一个国家石油化学工业的发展水平。
(1)A的结构简式为___________ ,C中官能团的名称为___________ 。
(2)A→B的反应类型为___________ ,F的化学名称为___________ 。
(3)F→B的化学反应方程式为___________ 。
(4)B+D→E反应中,B中O均用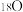 标记,反应结束后,含有
标记,反应结束后,含有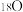 的物质有
的物质有___________ (填名称)。
(5) 是
是 的同分异构体,其中属于酯的
的同分异构体,其中属于酯的 的结构简式为
的结构简式为___________ (任写1种)。
(6)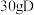 与
与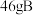 在一定条件下发生
在一定条件下发生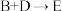 的反应,如果实际产率为
的反应,如果实际产率为 ,则可得到
,则可得到 的质量是
的质量是___________  。
。
 和高分子化合物
和高分子化合物 的路线如下所示,其中A的产量可以用来衡量一个国家石油化学工业的发展水平。
的路线如下所示,其中A的产量可以用来衡量一个国家石油化学工业的发展水平。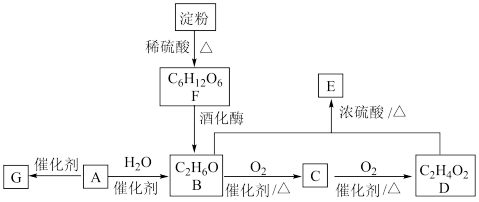
(1)A的结构简式为
(2)A→B的反应类型为
(3)F→B的化学反应方程式为
(4)B+D→E反应中,B中O均用
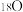 标记,反应结束后,含有
标记,反应结束后,含有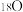 的物质有
的物质有(5)
 是
是 的同分异构体,其中属于酯的
的同分异构体,其中属于酯的 的结构简式为
的结构简式为(6)
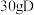 与
与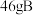 在一定条件下发生
在一定条件下发生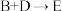 的反应,如果实际产率为
的反应,如果实际产率为 ,则可得到
,则可得到 的质量是
的质量是 。
。
您最近一年使用:0次
6 . 化学反应都会伴随能量变化,化学能可以与热能、电能、光能等各种形式的能量之间相互转化,回答下列问题:
(1)下列反应中,生成物总能量高于反应物总能量的是___________(填字母)。
(2)利用如图所示装置测定中和反应反应热的实验步骤如下: 盐酸倒入内筒中,测出盐酸温度;
盐酸倒入内筒中,测出盐酸温度;
Ⅱ.用另一量筒量取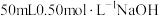 溶液,并用同一温度计测出其温度;
溶液,并用同一温度计测出其温度;
Ⅲ.将 溶液倒入内筒中,使之与盐酸混合均匀,测得混合液最高温度。
溶液倒入内筒中,使之与盐酸混合均匀,测得混合液最高温度。
① 溶液稍过量的原因是
溶液稍过量的原因是___________ 。
②倒入 溶液的正确操作是
溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
③假设盐酸和 溶液的密度都是
溶液的密度都是 ,中和反应后生成溶液的比热容
,中和反应后生成溶液的比热容 。为了计算中和反应的反应热,某学生实验记录如表数据。则生成
。为了计算中和反应的反应热,某学生实验记录如表数据。则生成 水的反应热
水的反应热
___________  (保留三位有效数字)。
(保留三位有效数字)。
(3)以 为原料合成
为原料合成 依然是“碳达峰”环境下的科研热点,相关反应如下:
依然是“碳达峰”环境下的科研热点,相关反应如下:
i.

ii.
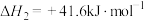
iii.
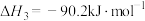
①
___________  。
。
②部分键能的数据如下表所示,则
___________ 。
(4) 和
和 是两种比较稳定的温室气体,科学家利用原电池装置,实现了两种分子的耦合转化,装置如图所示。
是两种比较稳定的温室气体,科学家利用原电池装置,实现了两种分子的耦合转化,装置如图所示。___________ (填“正”或“负”)极。
②催化电极1的电极反应式为___________ 。
(1)下列反应中,生成物总能量高于反应物总能量的是___________(填字母)。
| A.锌与稀硫酸 | B.食物的腐烂 |
| C.碳酸钙分解 | D.红热的木炭与水蒸气 |
(2)利用如图所示装置测定中和反应反应热的实验步骤如下:
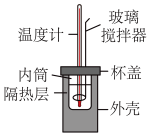
 盐酸倒入内筒中,测出盐酸温度;
盐酸倒入内筒中,测出盐酸温度;Ⅱ.用另一量筒量取
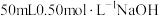 溶液,并用同一温度计测出其温度;
溶液,并用同一温度计测出其温度;Ⅲ.将
 溶液倒入内筒中,使之与盐酸混合均匀,测得混合液最高温度。
溶液倒入内筒中,使之与盐酸混合均匀,测得混合液最高温度。①
 溶液稍过量的原因是
溶液稍过量的原因是②倒入
 溶液的正确操作是
溶液的正确操作是A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
③假设盐酸和
 溶液的密度都是
溶液的密度都是 ,中和反应后生成溶液的比热容
,中和反应后生成溶液的比热容 。为了计算中和反应的反应热,某学生实验记录如表数据。则生成
。为了计算中和反应的反应热,某学生实验记录如表数据。则生成 水的反应热
水的反应热
 (保留三位有效数字)。
(保留三位有效数字)。| 实验序号 | 起始温度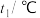 | 终止温度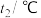 | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(3)以
 为原料合成
为原料合成 依然是“碳达峰”环境下的科研热点,相关反应如下:
依然是“碳达峰”环境下的科研热点,相关反应如下:i.


ii.

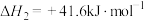
iii.

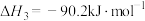
①

 。
。②部分键能的数据如下表所示,则

| 共价键 |  |  |  | 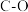 | 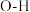 |
键能/( ) ) | 436 | 803 | 414 |  | 464 |
(4)
 和
和 是两种比较稳定的温室气体,科学家利用原电池装置,实现了两种分子的耦合转化,装置如图所示。
是两种比较稳定的温室气体,科学家利用原电池装置,实现了两种分子的耦合转化,装置如图所示。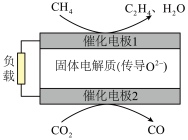
②催化电极1的电极反应式为
您最近一年使用:0次
解题方法
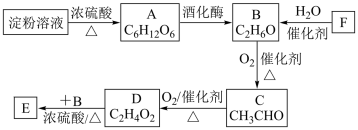
7 . 以淀粉或以石油裂解产物F(其产量常用来衡量一个国家的石油化工发展水平)为原料制备一种具有果香味的物质E的生产流程如下。
(1)F→B的反应类型为___________ ;B中官能团的名称为___________ 。
(2)写出B→C反应的化学方程式:___________ ;
(3)D+B→E反应的实验装置如图所示,该反应的化学方程式为___________ ;反应结束后,将试管中收集到的产品倒入___________ (填仪器名称)中,静置、分层,然后分离出E。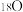 标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是___________(填字母序号)。
标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是___________(填字母序号)。
(1)F→B的反应类型为
(2)写出B→C反应的化学方程式:
(3)D+B→E反应的实验装置如图所示,该反应的化学方程式为
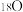 标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是___________(填字母序号)。
标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是___________(填字母序号)。A.生成的乙酸乙酯中含有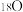 | B.生成的水分子中含有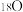 |
| C.可能生成80g乙酸乙酯 | D.可能生成相对分子质量为88的乙酸乙酯 |
您最近一年使用:0次
2024-09-07更新
|
87次组卷
|
2卷引用:辽宁省沈阳市广全实验学校2024-2025学年高二上学期开学考试化学试卷
8 . 回答下列问题。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为
 kJ⋅mol
kJ⋅mol ,能使化学反应速率加快的措施有
,能使化学反应速率加快的措施有_______ (填序号)。
①增加C的物质的量②升高温度③保持容器体积不变充入He气④缩小容器体积
(2)T℃时,在恒温恒容的密闭条件下发生反应: ,反应过程中各物质浓度的变化曲线如右图所示:
,反应过程中各物质浓度的变化曲线如右图所示: 的平均反应速率为
的平均反应速率为_______ 。
②下列能说明该反应已达到平衡状态的是_______
A.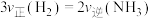 B.气体的平均摩尔质量不变
B.气体的平均摩尔质量不变
C.混合气体的密度不变 D.K保持不变
(3)用甲烷催化还原氮的氧化物可消除氮氧化物的污染:
①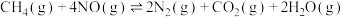
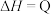 kJ⋅mol
kJ⋅mol 某温度下,密闭容器中
某温度下,密闭容器中 与NO的起始浓度分别为1mol⋅L
与NO的起始浓度分别为1mol⋅L 、2mol⋅L
、2mol⋅L ,其中
,其中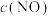 随时间变化如下图所示,
随时间变化如下图所示, 时达到平衡,保持温度不变在
时达到平衡,保持温度不变在 时将容器容积压缩到一半,请画出
时将容器容积压缩到一半,请画出 区间
区间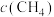 随时间变化的曲线
随时间变化的曲线_______ 。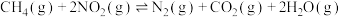 中
中 的转化率,可以采取在恒压条件下充入稀有气体,解释其原因
的转化率,可以采取在恒压条件下充入稀有气体,解释其原因_______ 。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为

 kJ⋅mol
kJ⋅mol ,能使化学反应速率加快的措施有
,能使化学反应速率加快的措施有①增加C的物质的量②升高温度③保持容器体积不变充入He气④缩小容器体积
(2)T℃时,在恒温恒容的密闭条件下发生反应:
 ,反应过程中各物质浓度的变化曲线如右图所示:
,反应过程中各物质浓度的变化曲线如右图所示: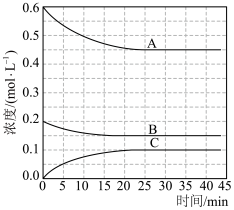
 的平均反应速率为
的平均反应速率为②下列能说明该反应已达到平衡状态的是
A.
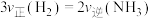 B.气体的平均摩尔质量不变
B.气体的平均摩尔质量不变C.混合气体的密度不变 D.K保持不变
(3)用甲烷催化还原氮的氧化物可消除氮氧化物的污染:
①
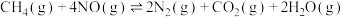
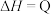 kJ⋅mol
kJ⋅mol 某温度下,密闭容器中
某温度下,密闭容器中 与NO的起始浓度分别为1mol⋅L
与NO的起始浓度分别为1mol⋅L 、2mol⋅L
、2mol⋅L ,其中
,其中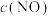 随时间变化如下图所示,
随时间变化如下图所示, 时达到平衡,保持温度不变在
时达到平衡,保持温度不变在 时将容器容积压缩到一半,请画出
时将容器容积压缩到一半,请画出 区间
区间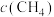 随时间变化的曲线
随时间变化的曲线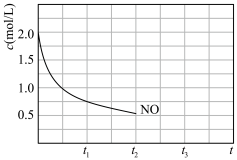
 中
中 的转化率,可以采取在恒压条件下充入稀有气体,解释其原因
的转化率,可以采取在恒压条件下充入稀有气体,解释其原因
您最近一年使用:0次
2024-09-07更新
|
213次组卷
|
2卷引用:辽宁省沈阳市广全实验学校2024-2025学年高二上学期开学考试化学试卷
解题方法
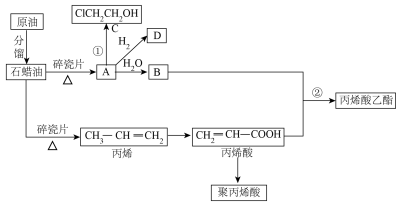
9 . 很多重要的工业原料来源于石油化工,结合下图回答有关问题:_______ (填标号)
a.干馏 b.分馏 c.裂解 d.催化重整
(2)C中含有的官能团的名称为_______ ,聚丙烯酸的链节为_______ 。
(3)反应②的化学方程式为_______ ,反应类型为_______ 。
(4)下列说法正确的是_______ (填标号)。
a.丙烯酸和乙酸互为同系物
b.烃A中,当有2个H被甲基取代后,最多有8个原子共面
c.等质量的烃A与丙烯在足量 中燃烧,丙烯消耗
中燃烧,丙烯消耗 的质量多
的质量多
d.有机物B、丙烯酸、丙烯酸乙酯均可以使 的
的 溶液褪色
溶液褪色
(5)写出与D互为同系物的含4个碳原子的有机物的所有同分异构体的结构简式:_______ 。
(6)反应①分两步完成,第一步为 ,第二步反应的原子利用率为100%,则第二步的化学方程式为
,第二步反应的原子利用率为100%,则第二步的化学方程式为_______ 。
a.干馏 b.分馏 c.裂解 d.催化重整
(2)C中含有的官能团的名称为
(3)反应②的化学方程式为
(4)下列说法正确的是
a.丙烯酸和乙酸互为同系物
b.烃A中,当有2个H被甲基取代后,最多有8个原子共面
c.等质量的烃A与丙烯在足量
 中燃烧,丙烯消耗
中燃烧,丙烯消耗 的质量多
的质量多d.有机物B、丙烯酸、丙烯酸乙酯均可以使
 的
的 溶液褪色
溶液褪色(5)写出与D互为同系物的含4个碳原子的有机物的所有同分异构体的结构简式:
(6)反应①分两步完成,第一步为
 ,第二步反应的原子利用率为100%,则第二步的化学方程式为
,第二步反应的原子利用率为100%,则第二步的化学方程式为
您最近一年使用:0次
解题方法
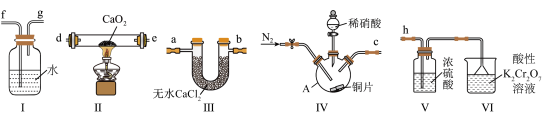
10 . 亚硝酸钙[ ]为白色粉末,易潮解、易溶于水,广泛应用于钢筋混凝土工程中,某实验小组采用下列装置,用干燥的NO与过氧化钙(
]为白色粉末,易潮解、易溶于水,广泛应用于钢筋混凝土工程中,某实验小组采用下列装置,用干燥的NO与过氧化钙( )反应制备固体
)反应制备固体 。回答下列问题。
。回答下列问题。
已知:浓硫酸与NO不反应。_______ ,实验前通入 的目的是
的目的是_______ ,装置Ⅴ的作用是_______ 。
(2)装置的连接顺序是_______ (填字母,按气体由左到右顺序)。
c→_______→_______→_______→_______→_______→_______→h
(3)装置Ⅳ中反应的化学方程式为_______ 。
(4)装置VI中氮元素被氧化为+5价,铬元素被还原为 ,则反应的离子方程式为
,则反应的离子方程式为_______ 。
(5)所得亚硝酸钙[ ]产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。
]产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。
实验步骤如下:称量13.84g产品溶于水中,加入足量碳酸钠溶液充分反应后,经过滤、洗涤、干燥并称重,得固体质量为10.00g。
所得产品中亚硝酸钙的纯度为_______ %(保留三位有效数字)。
 ]为白色粉末,易潮解、易溶于水,广泛应用于钢筋混凝土工程中,某实验小组采用下列装置,用干燥的NO与过氧化钙(
]为白色粉末,易潮解、易溶于水,广泛应用于钢筋混凝土工程中,某实验小组采用下列装置,用干燥的NO与过氧化钙( )反应制备固体
)反应制备固体 。回答下列问题。
。回答下列问题。已知:浓硫酸与NO不反应。
 的目的是
的目的是(2)装置的连接顺序是
c→_______→_______→_______→_______→_______→_______→h
(3)装置Ⅳ中反应的化学方程式为
(4)装置VI中氮元素被氧化为+5价,铬元素被还原为
 ,则反应的离子方程式为
,则反应的离子方程式为(5)所得亚硝酸钙[
 ]产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。
]产品中只含硝酸钙杂质,测定该产品中亚硝酸钙纯度。实验步骤如下:称量13.84g产品溶于水中,加入足量碳酸钠溶液充分反应后,经过滤、洗涤、干燥并称重,得固体质量为10.00g。
所得产品中亚硝酸钙的纯度为
您最近一年使用:0次



