名校
1 . 高纯MgO具有优良的电绝缘性、高导热性等,常被用作绝缘材料填料、高温耐热材料。由白云石[主要成分为 ,含少量
,含少量 、
、 、
、 等杂质]制备高纯MgO和副产品
等杂质]制备高纯MgO和副产品 的一种流程如下:
的一种流程如下:
(1)请写出基态Ca原子的价电子排布式___________ 。
(2)步骤“煅烧1”中, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“铵浸”时,含钙化合物被浸取,含镁化合物部分水化生成 (
(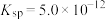 )。若铵浸液中
)。若铵浸液中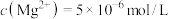 ,则其pH=
,则其pH=___________ ;滤饼“水化反应”后,将体系冷却到与铵浸液相同温度,得到主要含有 的悬浊液,其中
的悬浊液,其中
___________ 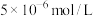 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(4)“沉钙”时主要发生反应的离子方程式为___________ 。
(5)“碳化反应”时,镁化合物转化为可溶于水的___________ (填化学式,下同),滤渣的主要成分为___________ 。
(6)“热解”时生成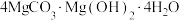 (碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
(碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质]制备高纯MgO和副产品
等杂质]制备高纯MgO和副产品 的一种流程如下:
的一种流程如下: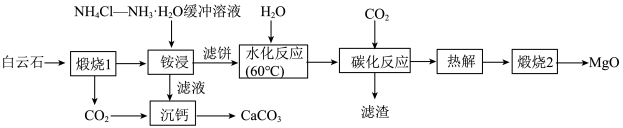
(1)请写出基态Ca原子的价电子排布式
(2)步骤“煅烧1”中,
 发生反应的化学方程式为
发生反应的化学方程式为(3)“铵浸”时,含钙化合物被浸取,含镁化合物部分水化生成
 (
(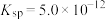 )。若铵浸液中
)。若铵浸液中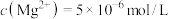 ,则其pH=
,则其pH= 的悬浊液,其中
的悬浊液,其中
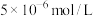 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(4)“沉钙”时主要发生反应的离子方程式为
(5)“碳化反应”时,镁化合物转化为可溶于水的
(6)“热解”时生成
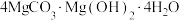 (碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
(碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
您最近一年使用:0次
名校
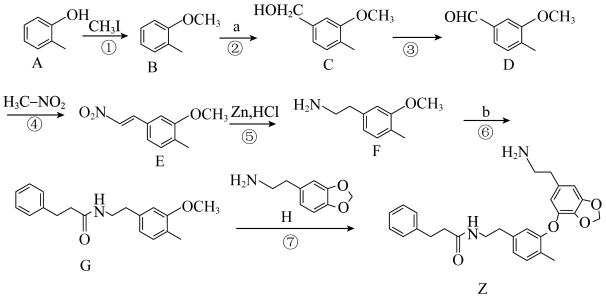
2 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(Ⅰ)的一种合成路线如下:
(1)化合物A的名称为___________ ,碳原子的杂化方式为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物a的一种用途___________ 。
(3)化合物C中含有的官能团名称为___________ ,请写出C转化为D的化学方程式___________ ,反应类型为___________ 。
(4)b能与碳酸氢钠溶液反应生成气体。芳香化合物X为b的同分异构体,能发生水解反应又能发生银镜反应,核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1,X的结构简式为___________ (写出一种)。
(5)参照上述路线,以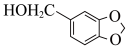 与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图_______ 。
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物a的一种用途
(3)化合物C中含有的官能团名称为
(4)b能与碳酸氢钠溶液反应生成气体。芳香化合物X为b的同分异构体,能发生水解反应又能发生银镜反应,核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1,X的结构简式为
(5)参照上述路线,以
 与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
您最近一年使用:0次
名校
3 . 乙酰苯胺可用作止痛剂、退热剂、防腐剂和染料中间体。实验室中采用苯胺(在空气中易被氧化)和冰醋酸等原料制备乙酰苯胺,反应为: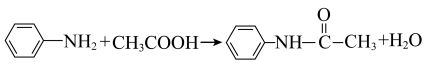 ;
;
| 摩尔质量(g/mol) | 熔点/℃ | 沸点/℃ | 密度/(g/cm³) | 溶解度/g | |||
| 水 | 乙醇 | 乙醚 | |||||
| 苯胺 | 93 | -6.2 | 184 | 1.022 | 3.6 | 混溶 | 混溶 |
| 冰醋酸 | 60 | 16.7 | 118 | 1.049 | 混溶 | 混溶 | 混溶 |
| 乙酰苯胺 | 135 | 115 | 305 | 1.212 | 溶于热水 | 溶 | 溶 |
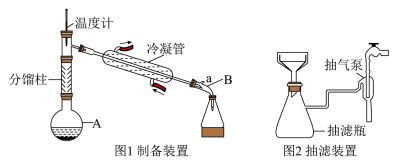
(1)加料:图1为制备装置(夹持、加热装置略),在仪器A中加入5.0mL苯胺、7.4mL冰醋酸和0.1g锌粉。仪器A的名称是
(2)加热制备粗产品;仪器A中加料后,加热至105℃。适宜使用
(3)过滤:反应结束后,将A中的反应混合物先趁热倒入适量冷水中,不断搅拌,使之充分冷却,再用图2所示的抽滤装置过滤。与普通过滤相比,抽滤的优点是
A.冷水 B.热水 C.乙醇 D.乙醚
(4)重结晶:①将粗乙酰苯胺放入适量水中,若观察到水中有油珠存在,可补加适量水,使油珠消失。根据下表乙酰苯胺的溶解度,上述水的温度选择
| 温度/℃ | 20 | 25 | 50 | 80 | 100 |
| 溶解度/g | 0.46 | 0.56 | 0.84 | 3.50 | 5.50 |
(5)产率计算:经过重结晶、干燥,得到乙酰苯胺产品5.0g,实验的产率是
您最近一年使用:0次
4 . 一种利用太阳能催化甲烷、水蒸气重整制氢反应原理及各步反应步骤如图1,以气体分压(单位为kPa)表示的平衡常数与温度T的变化关系如图2所示: )中铁的化合价为
)中铁的化合价为___________ 。
(2)若第Ⅰ步反应生成1mol ,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为
,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为___________ 。
(3)根据图2可知 (Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应:
(Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应: 的ΔH
的ΔH___________ 0(填“>”、“<”或“=”)。
(4)已知上述制氢过程中存在副反应: 。将
。将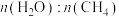
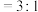 的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa,
的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa, 分压为10kPa,则
分压为10kPa,则 的平衡转化率为
的平衡转化率为___________ ,则甲烷、水蒸气重整反应的
___________ (列出计算式)。
(5)一定条件下,向密闭容器中加入一定量的CO、 和催化剂,发生反应:
和催化剂,发生反应: 。
。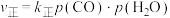 ,
,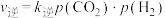 。其中
。其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 为正、逆速率常数,p为气体分压。已知降低温度时,
为正、逆速率常数,p为气体分压。已知降低温度时, 增大。调整CO和
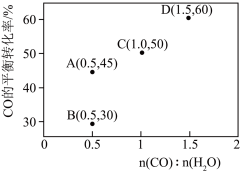
增大。调整CO和 初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是
初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是___________ ,在C点所示投料比下,当CO转化率达到40%时,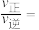
___________ 。
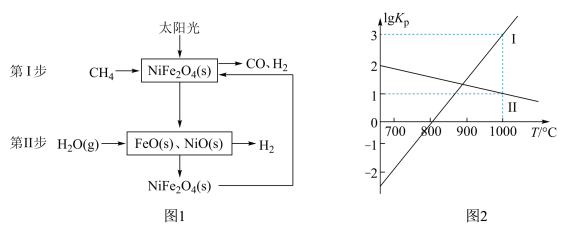
 )中铁的化合价为
)中铁的化合价为(2)若第Ⅰ步反应生成1mol
 ,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为
,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为(3)根据图2可知
 (Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应:
(Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应: 的ΔH
的ΔH(4)已知上述制氢过程中存在副反应:
 。将
。将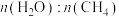
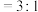 的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa,
的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa, 分压为10kPa,则
分压为10kPa,则 的平衡转化率为
的平衡转化率为
(5)一定条件下,向密闭容器中加入一定量的CO、
 和催化剂,发生反应:
和催化剂,发生反应: 。
。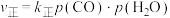 ,
,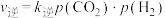 。其中
。其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 为正、逆速率常数,p为气体分压。已知降低温度时,
为正、逆速率常数,p为气体分压。已知降低温度时, 增大。调整CO和
增大。调整CO和 初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是
初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是
您最近一年使用:0次
5 . 一种合成有机物 的路线如图所示。
的路线如图所示。
(1)C的化学名称是____________ ,由B生成C的反应类型是____________ 。
(2) 的结构简式为
的结构简式为___________ , 分子中的官能团名称是
分子中的官能团名称是____________ 。
(3)写出 生成
生成 的过程中①的化学反应方程式
的过程中①的化学反应方程式__________ 。
(4)有机物 是
是 少3个碳原子的同系物。
少3个碳原子的同系物。 的同分异构体中,满足以下条件的有
的同分异构体中,满足以下条件的有_________ 种(不考虑立体异构);写出其中核磁共振氢谱有5组峰且峰面积之比为 的有机物的结构简式
的有机物的结构简式____________ 。
①苯环上有2个取代基;
②苯环上有2种不同环境的氢原子;
③能发生水解反应,且水解产物之一遇到 溶液显紫色。
溶液显紫色。
(5)已知: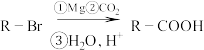 (
( 为烃基)。以
为烃基)。以 为原料,试根据所学知识设计另一条路线合成有机物
为原料,试根据所学知识设计另一条路线合成有机物 ,用流程图表示
,用流程图表示_______________ (无机试剂任选)。
 的路线如图所示。
的路线如图所示。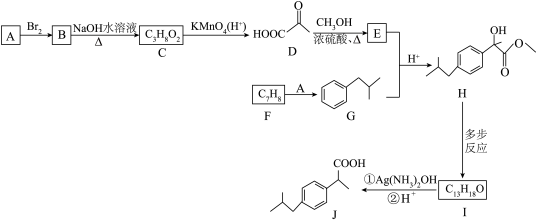
已知: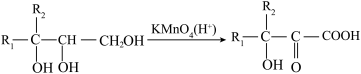 (
(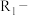 、
、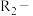 为烃基)
为烃基)
(1)C的化学名称是
(2)
 的结构简式为
的结构简式为 分子中的官能团名称是
分子中的官能团名称是(3)写出
 生成
生成 的过程中①的化学反应方程式
的过程中①的化学反应方程式(4)有机物
 是
是 少3个碳原子的同系物。
少3个碳原子的同系物。 的同分异构体中,满足以下条件的有
的同分异构体中,满足以下条件的有 的有机物的结构简式
的有机物的结构简式①苯环上有2个取代基;
②苯环上有2种不同环境的氢原子;
③能发生水解反应,且水解产物之一遇到
 溶液显紫色。
溶液显紫色。(5)已知:
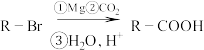 (
(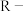 为烃基)。以
为烃基)。以 为原料,试根据所学知识设计另一条路线合成有机物
为原料,试根据所学知识设计另一条路线合成有机物 ,用流程图表示
,用流程图表示
您最近一年使用:0次
解题方法
6 . 氮化铬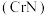 是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬
是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬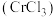 与氨气在高温下反应制备
与氨气在高温下反应制备 。
。
已知:① 的沸点是
的沸点是 ;②光气
;②光气 有毒,遇水生成
有毒,遇水生成 和
和
Ⅰ.制备无水氯化铬
反应原理为: 。相关实验装置如图(夹持装置略):
。相关实验装置如图(夹持装置略):
 .水浴加热并维持A的温度在
.水浴加热并维持A的温度在
 .打开
.打开 ,通入
,通入 并保证锥形瓶中每分钟有250个左右的气泡逸出
并保证锥形瓶中每分钟有250个左右的气泡逸出
 .点燃B处酒精喷灯,使瓷舟温度升至
.点燃B处酒精喷灯,使瓷舟温度升至 左右,反应一定时间
左右,反应一定时间
 .先后停止加热
.先后停止加热 ,冷却,并继续通入一段时间的
,冷却,并继续通入一段时间的
(1)C装置的名称是________________ 。
(2)A使用水浴加热的优点是_______________ 。
(3)D中反应的化学方程式为______________ 。
Ⅱ.制备氮化铬
某校化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略),其反应原理为:
已知: 易溶于水形成紫色的
易溶于水形成紫色的 离子,且易与水反应。
离子,且易与水反应。 装置是简易的氨气制备装置,导管
装置是简易的氨气制备装置,导管 的作用是
的作用是______________ 。
(5) 中盛放的试剂是
中盛放的试剂是__________ 。
(6)实验过程中需间歇性微热 处导管的目的是
处导管的目的是___________ 。
(7)请设计实验验证制得的 中是否含有
中是否含有
________________ 。
Ⅲ.测产品氮化铬的纯度
(8)向 所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用
所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用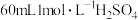 溶液完全吸收,剩余的硫酸用
溶液完全吸收,剩余的硫酸用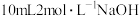 溶液恰好中和,则所得产品中氮化铬的纯度为
溶液恰好中和,则所得产品中氮化铬的纯度为_______________ 。
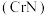 是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬
是一种良好的耐磨材料,难溶于水。实验小组用无水氯化铬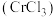 与氨气在高温下反应制备
与氨气在高温下反应制备 。
。已知:①
 的沸点是
的沸点是 ;②光气
;②光气 有毒,遇水生成
有毒,遇水生成 和
和
Ⅰ.制备无水氯化铬
反应原理为:
 。相关实验装置如图(夹持装置略):
。相关实验装置如图(夹持装置略):
 .水浴加热并维持A的温度在
.水浴加热并维持A的温度在
 .打开
.打开 ,通入
,通入 并保证锥形瓶中每分钟有250个左右的气泡逸出
并保证锥形瓶中每分钟有250个左右的气泡逸出 .点燃B处酒精喷灯,使瓷舟温度升至
.点燃B处酒精喷灯,使瓷舟温度升至 左右,反应一定时间
左右,反应一定时间 .先后停止加热
.先后停止加热 ,冷却,并继续通入一段时间的
,冷却,并继续通入一段时间的
(1)C装置的名称是
(2)A使用水浴加热的优点是
(3)D中反应的化学方程式为
Ⅱ.制备氮化铬
某校化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略),其反应原理为:

已知:
 易溶于水形成紫色的
易溶于水形成紫色的 离子,且易与水反应。
离子,且易与水反应。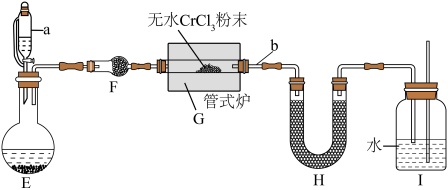
 装置是简易的氨气制备装置,导管
装置是简易的氨气制备装置,导管 的作用是
的作用是(5)
 中盛放的试剂是
中盛放的试剂是(6)实验过程中需间歇性微热
 处导管的目的是
处导管的目的是(7)请设计实验验证制得的
 中是否含有
中是否含有
Ⅲ.测产品氮化铬的纯度
(8)向
 所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用
所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后将氨气全部蒸出,将氨气用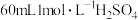 溶液完全吸收,剩余的硫酸用
溶液完全吸收,剩余的硫酸用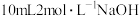 溶液恰好中和,则所得产品中氮化铬的纯度为
溶液恰好中和,则所得产品中氮化铬的纯度为
您最近一年使用:0次
7 .  是一种压电材料。一种以富钛渣(主要成分为
是一种压电材料。一种以富钛渣(主要成分为 ,含少量
,含少量 和
和 的氧化物杂质)和重晶石(主要成分是
的氧化物杂质)和重晶石(主要成分是 )为原料,制备钛酸钡的工艺流程如图所示。
)为原料,制备钛酸钡的工艺流程如图所示。 元素在不同
元素在不同 条件下的存在形式:
条件下的存在形式:
② ,
, ,
,
③ 易溶于水,
易溶于水, 微溶于水
微溶于水
回答下列问题:
(1)为提高沸腾氯化的速率,可采取的措施是_______________ (答出一点即可)。
(2)“焙烧”后固体产物是 ,则“焙烧”过程的化学方程式为
,则“焙烧”过程的化学方程式为_____________ 。“焙烧”过程中应避免氧气进入,主要原因是会产生污染性气体__________ (写化学式)。“沉淀1”中所得滤渣的主要成分是____________ (写化学式)。
(3)“沉淀2”中生成 的化学方程式为
的化学方程式为___________ (已知该反应还生成了 和
和 )。
)。
(4) 溶液显
溶液显_______ 性(填“酸”、“碱”或“中”),“沉淀2”中不可用 溶液代替的原因是
溶液代替的原因是_____________ 。
(5)立方钛酸钡晶体的结构如图所示。 周围与它最近且距离相等的
周围与它最近且距离相等的 有
有________ 个。
②该晶体晶胞的边长为 ,晶体密度为
,晶体密度为________  。(列出计算式,已知阿伏加德罗常数为
。(列出计算式,已知阿伏加德罗常数为 ,
,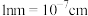 )
)
 是一种压电材料。一种以富钛渣(主要成分为
是一种压电材料。一种以富钛渣(主要成分为 ,含少量
,含少量 和
和 的氧化物杂质)和重晶石(主要成分是
的氧化物杂质)和重晶石(主要成分是 )为原料,制备钛酸钡的工艺流程如图所示。
)为原料,制备钛酸钡的工艺流程如图所示。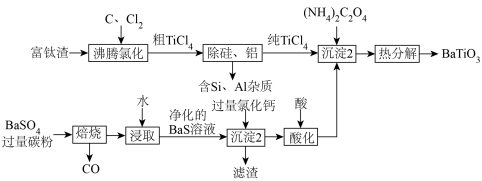
 元素在不同
元素在不同 条件下的存在形式:
条件下的存在形式: |  | 4~7 |  |
| 存在形式 |  |  |  |
 ,
, ,
,
③
 易溶于水,
易溶于水, 微溶于水
微溶于水回答下列问题:
(1)为提高沸腾氯化的速率,可采取的措施是
(2)“焙烧”后固体产物是
 ,则“焙烧”过程的化学方程式为
,则“焙烧”过程的化学方程式为(3)“沉淀2”中生成
 的化学方程式为
的化学方程式为 和
和 )。
)。(4)
 溶液显
溶液显 溶液代替的原因是
溶液代替的原因是(5)立方钛酸钡晶体的结构如图所示。
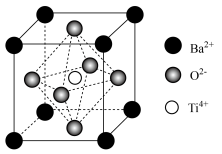
 周围与它最近且距离相等的
周围与它最近且距离相等的 有
有②该晶体晶胞的边长为
 ,晶体密度为
,晶体密度为 。(列出计算式,已知阿伏加德罗常数为
。(列出计算式,已知阿伏加德罗常数为 ,
, )
)
您最近一年使用:0次
解题方法
8 . 高分子材料PET聚酯树脂和PMMA的合成路线如下: (R、R′、R″代表烃基)
(R、R′、R″代表烃基)___________ ,B的名称是___________ 。
(2)PMMA单体的官能团名称是___________ 。
(3)步骤②发生反应的化学方程式为___________ 。
(4)E的核磁共振氢谱图显示只有一组峰,步骤⑤的化学方程式为___________ 。
(5)F的结构简式为___________ 。
(6)下列说法正确的是___________(填标号)。
(7)写出符合下列条件的PMAA单体的同分异构体的结构简式:___________ 。
A.具有PMAA单体的所有官能团
B.能与新制银氨溶液反应产生银镜
C.含有3种不同化学环境的氢原子
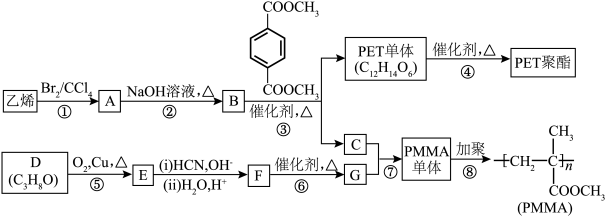
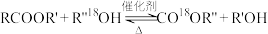 (R、R′、R″代表烃基)
(R、R′、R″代表烃基)Ⅱ、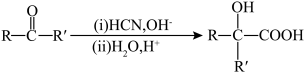 (R、R′代表烃基)
(R、R′代表烃基)
(2)PMMA单体的官能团名称是
(3)步骤②发生反应的化学方程式为
(4)E的核磁共振氢谱图显示只有一组峰,步骤⑤的化学方程式为
(5)F的结构简式为
(6)下列说法正确的是___________(填标号)。
| A.⑦为酯化反应 | B.B和C互为同系物 |
| C.D的沸点比同碳原子数的烷烃高 | D.步骤⑥的反应条件为浓硫酸、加热到140℃ |
(7)写出符合下列条件的PMAA单体的同分异构体的结构简式:
A.具有PMAA单体的所有官能团
B.能与新制银氨溶液反应产生银镜
C.含有3种不同化学环境的氢原子
您最近一年使用:0次
解题方法
9 . 将CO、CO2转化为甲烷、甲醇、甲酸等有机物是实现“碳中和”重要途径。
Ⅰ.CO2(g) + H2(g) CO(g) + H2O(g) △H1= +41 KJ/mol
CO(g) + H2O(g) △H1= +41 KJ/mol
Ⅱ.CO(g) + 2H2(g) CH3OH(g) △H2=-90 KJ/mol
CH3OH(g) △H2=-90 KJ/mol
总反应Ⅲ:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H
CH3OH(g) + H2O(g) △H
(1)总反应Ⅲ的△H为___________ kJ·mol-1。
(2)在恒温,体积为1L恒容密闭容器中,充入1molCO2(g)和3molH2(g),进行反应Ⅲ(不考虑其它副反应)。10min时测得CO2(g)和CH3OH(g)的体积分数之比为1∶3,反应达到平衡。回答下列问题:
①反应开始到平衡,氢气的平均反应速率v(H2)=___________ 。
②该温度下反应Ⅲ的平衡常数K=___________ (mol/L)-2。
③下列能说明该反应已达平衡状态的是___________ 。
A.气体的平均摩尔质量不变 B.混合气体密度不再改变
C.体系中CH3OH与H2O的浓度比不变 D.容器内压强不再改变
(3)研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g)⇌HCOOH(g) △H<0.在一容积固定的密闭容器中进行反应,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。温度为T1℃时,该反应平衡常数K=2,温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强___________ (填“>”“<”或“=”)T1℃时平衡压强,理由是___________ 。
(4)以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为___________ (填“阳膜”或“阴膜”),阳极的电极反应式为___________ 。
Ⅰ.CO2(g) + H2(g)
 CO(g) + H2O(g) △H1= +41 KJ/mol
CO(g) + H2O(g) △H1= +41 KJ/mol Ⅱ.CO(g) + 2H2(g)
 CH3OH(g) △H2=-90 KJ/mol
CH3OH(g) △H2=-90 KJ/mol 总反应Ⅲ:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) △H
CH3OH(g) + H2O(g) △H(1)总反应Ⅲ的△H为
(2)在恒温,体积为1L恒容密闭容器中,充入1molCO2(g)和3molH2(g),进行反应Ⅲ(不考虑其它副反应)。10min时测得CO2(g)和CH3OH(g)的体积分数之比为1∶3,反应达到平衡。回答下列问题:
①反应开始到平衡,氢气的平均反应速率v(H2)=
②该温度下反应Ⅲ的平衡常数K=
③下列能说明该反应已达平衡状态的是
A.气体的平均摩尔质量不变 B.混合气体密度不再改变
C.体系中CH3OH与H2O的浓度比不变 D.容器内压强不再改变
(3)研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g)⇌HCOOH(g) △H<0.在一容积固定的密闭容器中进行反应,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。温度为T1℃时,该反应平衡常数K=2,温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强
(4)以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

您最近一年使用:0次
名校
解题方法
10 . 某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸( )与乙醇(
)与乙醇( )酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:
)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:_______ ,仪器A、B中的溶液均为_______ 。
(2)甲、乙两套装置中效果比较好的装置是_______ ,原因是_______ 。
(3)乙装置中冷凝水应该从_______ (填“a”或“b”)口进入。
(4)按甲图安装好仪器后,在反应管中加入配制的体积比为3∶2的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是_______ 。
(5)乙醇需要过量一些的原因是_______ 。
(6)某同学选用了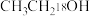 、
、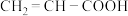 两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式:
两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式:_______ 。
(7)下列有关有机知识表述正确的是_______ (填字母)。
A.乙烯可以通过加成反应制得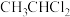
B.等物质的量的甲烷和乙酸完全燃烧时所需 的质量相同
的质量相同
C.乙酸乙酯中含有乙酸杂质,可加入一定量的乙醇和浓硫酸通过酯化反应除去
 )与乙醇(
)与乙醇( )酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:
)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:
(2)甲、乙两套装置中效果比较好的装置是
(3)乙装置中冷凝水应该从
(4)按甲图安装好仪器后,在反应管中加入配制的体积比为3∶2的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是
(5)乙醇需要过量一些的原因是
(6)某同学选用了
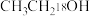 、
、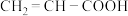 两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式:
两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式:(7)下列有关有机知识表述正确的是
A.乙烯可以通过加成反应制得
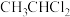
B.等物质的量的甲烷和乙酸完全燃烧时所需
 的质量相同
的质量相同C.乙酸乙酯中含有乙酸杂质,可加入一定量的乙醇和浓硫酸通过酯化反应除去
您最近一年使用:0次



