解题方法
1 . 氢气是一种清洁能源,研究制氢技术及其应用具有重要意义。
(1)利用H2可将NO还原为N2,反应为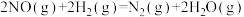
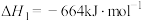 。
。
已知:键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量。某些化学键的键能如下表所示。
则NO分子中氮氧键键能为___________  。
。
(2)乙醇—水催化重整可获得H2.主要反应有:
Ⅰ.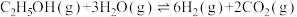
Ⅱ.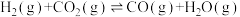
在一定条件下,向2 L恒容密闭容器中充入 和
和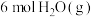 ,平衡时C2H5OH和H2O的转化率随温度的变化如图所示。
,平衡时C2H5OH和H2O的转化率随温度的变化如图所示。___________ (填字母)。
A.由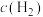 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态
B.当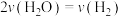 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态
C.图中a点的正反应速率大于b点的逆反应速率
②200℃条件下,反应5 min达平衡状态,则0~5 min内用H2的浓度变化表示反应的平均速率为___________  。
。
③200℃条件下,反应达平衡时,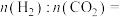
___________ 。
④当温度高于300℃,达平衡时H2O的转化率随温度升高而降低的原因可能是___________ 。
(3)甲烷和水蒸气在催化剂作用下重整制得氢。___________ 。
②该重整过程中会发生副反应: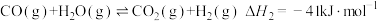 。则
。则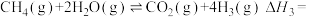
___________ 。
(1)利用H2可将NO还原为N2,反应为
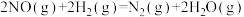
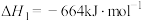 。
。已知:键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量。某些化学键的键能如下表所示。
| 共价键 | H—H | H—O | N≡N |
键能/( ) ) | 436 | 463 | 946 |
 。
。(2)乙醇—水催化重整可获得H2.主要反应有:
Ⅰ.
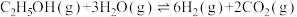
Ⅱ.
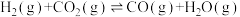
在一定条件下,向2 L恒容密闭容器中充入
 和
和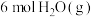 ,平衡时C2H5OH和H2O的转化率随温度的变化如图所示。
,平衡时C2H5OH和H2O的转化率随温度的变化如图所示。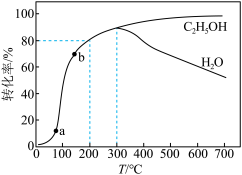
A.由
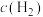 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态B.当
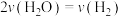 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态C.图中a点的正反应速率大于b点的逆反应速率
②200℃条件下,反应5 min达平衡状态,则0~5 min内用H2的浓度变化表示反应的平均速率为
 。
。③200℃条件下,反应达平衡时,
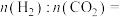
④当温度高于300℃,达平衡时H2O的转化率随温度升高而降低的原因可能是
(3)甲烷和水蒸气在催化剂作用下重整制得氢。
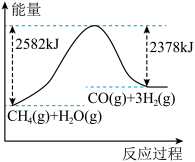
②该重整过程中会发生副反应:
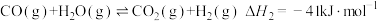 。则
。则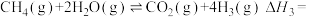
您最近一年使用:0次
2 . 氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:①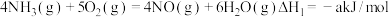 ;
;
②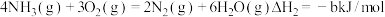 。
。
写出 与
与 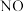 反应生成
反应生成  和
和  的热化学方程式
的热化学方程式_______ 。
(2)氢气选择性催化还原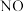 是一种比
是一种比  还原
还原 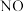 更为理想的方法,备受研究者关注。以
更为理想的方法,备受研究者关注。以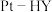 为催化剂,氢气选择性催化还原
为催化剂,氢气选择性催化还原 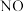 在催化剂表面的反应机理如图:
在催化剂表面的反应机理如图: 原子表面上发生的反应除
原子表面上发生的反应除 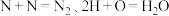 外还有
外还有_______ (不包括吸附解离过程),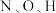 的电负性由大到小顺序为
的电负性由大到小顺序为_______ 。
(3)在密闭容器中充入 和
和  ,发生反应
,发生反应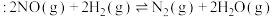
 ,平衡时
,平衡时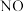 的体积分数随温度、压强的变化关系如图:
的体积分数随温度、压强的变化关系如图: 点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中
点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中 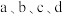 中的点
中的点 _______ 。
②下列物理量中,图中 点小于
点小于  点的是
点的是_______ 。
A.逆反应速率 B. 的体积分数 C.
的体积分数 C. 的物质的量浓度 D.平衡常数
的物质的量浓度 D.平衡常数
③ 点达平衡后,保持温度和容器体积不变,再充人
点达平衡后,保持温度和容器体积不变,再充人 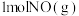 和
和  ,则平衡
,则平衡_______ (填“向左”“向右”或“不”)移动。
(4)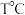 时,向容积为
时,向容积为  的恒容容器中充人
的恒容容器中充人 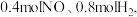 发生反应:
发生反应: ,体系的总压强
,体系的总压强  随时间
随时间  的变化如下表所示:
的变化如下表所示:
① 内该反应的平均反应速率
内该反应的平均反应速率 
_______  。
。
②该温度下反应的平衡常数
_______  (用平衡分压代替平衡浓度,平衡分压=总压
(用平衡分压代替平衡浓度,平衡分压=总压  物质的量分数)。
物质的量分数)。
(1)已知:①
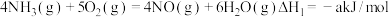 ;
;②
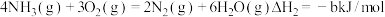 。
。写出
 与
与 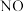 反应生成
反应生成  和
和  的热化学方程式
的热化学方程式(2)氢气选择性催化还原
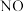 是一种比
是一种比  还原
还原 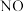 更为理想的方法,备受研究者关注。以
更为理想的方法,备受研究者关注。以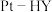 为催化剂,氢气选择性催化还原
为催化剂,氢气选择性催化还原 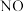 在催化剂表面的反应机理如图:
在催化剂表面的反应机理如图: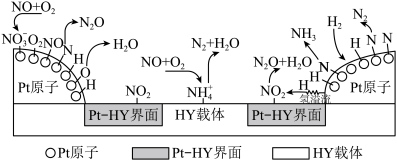
 原子表面上发生的反应除
原子表面上发生的反应除 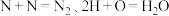 外还有
外还有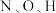 的电负性由大到小顺序为
的电负性由大到小顺序为(3)在密闭容器中充入
 和
和  ,发生反应
,发生反应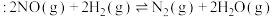
 ,平衡时
,平衡时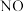 的体积分数随温度、压强的变化关系如图:
的体积分数随温度、压强的变化关系如图: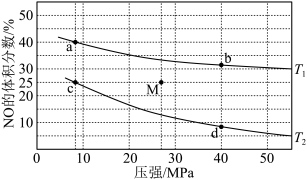
 点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中
点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中 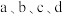 中的点
中的点 ②下列物理量中,图中
 点小于
点小于  点的是
点的是A.逆反应速率 B.
 的体积分数 C.
的体积分数 C. 的物质的量浓度 D.平衡常数
的物质的量浓度 D.平衡常数③
 点达平衡后,保持温度和容器体积不变,再充人
点达平衡后,保持温度和容器体积不变,再充人 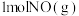 和
和  ,则平衡
,则平衡(4)
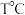 时,向容积为
时,向容积为  的恒容容器中充人
的恒容容器中充人 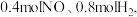 发生反应:
发生反应: ,体系的总压强
,体系的总压强  随时间
随时间  的变化如下表所示:
的变化如下表所示: | 0 | 10 | 20 | 30 | 40 |
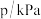 | 240 | 226 | 216 | 210 | 210 |
 内该反应的平均反应速率
内该反应的平均反应速率 
 。
。②该温度下反应的平衡常数

 (用平衡分压代替平衡浓度,平衡分压=总压
(用平衡分压代替平衡浓度,平衡分压=总压  物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解题方法
3 . 碲在冶金工业中用途广泛,被誉为现代工业的维生素。某精炼铜的阳极泥经过处理后的主要成分为 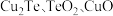 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下: 和
和  ; ②
; ②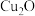 在酸性条件下会发生自身氧化还原反应;③
在酸性条件下会发生自身氧化还原反应;③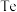 元素在酸浸和碱浸后分别转化为
元素在酸浸和碱浸后分别转化为 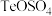 和
和  ,两种易溶于水的盐。
,两种易溶于水的盐。
回答下列问题:
(1)“焙烧”时,为提高效率,可采取的措施有_______ 填一种方法),从结构的角度分析焙烧后的产物是 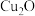 而不是
而不是 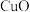
_______ 。
(2) 分子中
分子中 原子的杂化轨道类型为
原子的杂化轨道类型为_______ ,该分子属于_______ (填“极性”或“非极性”)分子。
(3)“酸浸”时还需要加入一定量的 ,其目的是
,其目的是_______ 。
(4)“还原”时发生反应的离子方程式为_______ 。
(5)"电解"制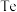 的原理如图,该电解反应的总化学方程式为
的原理如图,该电解反应的总化学方程式为____ 。该回收碲和胆矾的工艺流程中可循环使用的物质有  和
和 ____ 。
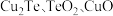 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下: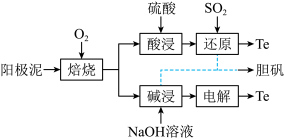
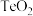 和
和 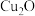 ; ②
; ②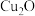 在酸性条件下会发生自身氧化还原反应;③
在酸性条件下会发生自身氧化还原反应;③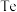 元素在酸浸和碱浸后分别转化为
元素在酸浸和碱浸后分别转化为 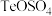 和
和  ,两种易溶于水的盐。
,两种易溶于水的盐。回答下列问题:
(1)“焙烧”时,为提高效率,可采取的措施有
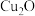 而不是
而不是 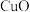
(2)
 分子中
分子中 原子的杂化轨道类型为
原子的杂化轨道类型为(3)“酸浸”时还需要加入一定量的
 ,其目的是
,其目的是(4)“还原”时发生反应的离子方程式为
(5)"电解"制
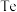 的原理如图,该电解反应的总化学方程式为
的原理如图,该电解反应的总化学方程式为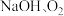 和
和 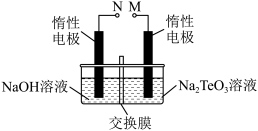
您最近一年使用:0次
解题方法
4 . Ⅰ.我国国标推荐的食品药品中  元素含量的测定方法之一为:利用
元素含量的测定方法之一为:利用 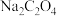 将处理后的样品中的
将处理后的样品中的  沉淀,过滤洗涤,然后将所得
沉淀,过滤洗涤,然后将所得 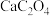 固体溶于过量的强酸,最后使用已知浓度的
固体溶于过量的强酸,最后使用已知浓度的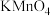 溶液通过滴定来测定溶液中
溶液通过滴定来测定溶液中  的含量。针对该实验中的滴定过程,回答以下问题:
的含量。针对该实验中的滴定过程,回答以下问题:
(1)在使用滴定管前,首先要进行的操作是_______ ,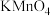 溶液应该用
溶液应该用 __________ (填“酸式”或“碱式”)滴定管盛装。
(2)滴定过程中发生反应的离子方程式为________ 。
(3)滴定终点的现象为__________ 。
(4)以下操作会导致测定结果偏低的是_______ (填字母)。
 装入
装入 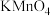 溶液前未润洗滴定管
溶液前未润洗滴定管
 滴定结束后俯视读数
滴定结束后俯视读数
 .锥形瓶装待测液前未干燥
.锥形瓶装待测液前未干燥
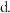 滴定前滴定管尖嘴部分无气泡,滴定后有气泡
滴定前滴定管尖嘴部分无气泡,滴定后有气泡
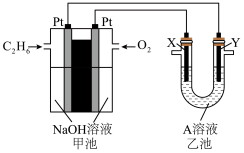
Ⅱ.电化学在化学工业中有着广泛应用。根据图示电化学装置,回答下列问题:_______ 极(填  或
或  ),电解一段时间后
),电解一段时间后 溶液中铅离子浓度
溶液中铅离子浓度_______ 填“减小”“不变”或“增大”)。
(6)乙池中,若 都是石墨,
都是石墨, 是足量
是足量 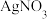 溶液,体积为
溶液,体积为 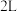 ,电解一段时间后,甲池消耗
,电解一段时间后,甲池消耗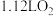 (标准状况下),则乙池溶液的
(标准状况下),则乙池溶液的  为
为_______ (忽略溶液体积的变化)。
 元素含量的测定方法之一为:利用
元素含量的测定方法之一为:利用 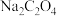 将处理后的样品中的
将处理后的样品中的  沉淀,过滤洗涤,然后将所得
沉淀,过滤洗涤,然后将所得 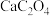 固体溶于过量的强酸,最后使用已知浓度的
固体溶于过量的强酸,最后使用已知浓度的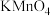 溶液通过滴定来测定溶液中
溶液通过滴定来测定溶液中  的含量。针对该实验中的滴定过程,回答以下问题:
的含量。针对该实验中的滴定过程,回答以下问题:(1)在使用滴定管前,首先要进行的操作是
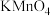 溶液应该用
溶液应该用 (2)滴定过程中发生反应的离子方程式为
(3)滴定终点的现象为
(4)以下操作会导致测定结果偏低的是
 装入
装入 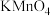 溶液前未润洗滴定管
溶液前未润洗滴定管  滴定结束后俯视读数
滴定结束后俯视读数 .锥形瓶装待测液前未干燥
.锥形瓶装待测液前未干燥  滴定前滴定管尖嘴部分无气泡,滴定后有气泡
滴定前滴定管尖嘴部分无气泡,滴定后有气泡Ⅱ.电化学在化学工业中有着广泛应用。根据图示电化学装置,回答下列问题:
 或
或  ),电解一段时间后
),电解一段时间后 溶液中铅离子浓度
溶液中铅离子浓度(6)乙池中,若
 都是石墨,
都是石墨, 是足量
是足量 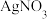 溶液,体积为
溶液,体积为 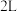 ,电解一段时间后,甲池消耗
,电解一段时间后,甲池消耗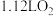 (标准状况下),则乙池溶液的
(标准状况下),则乙池溶液的  为
为
您最近一年使用:0次
解题方法
5 . 四钼酸铵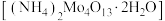 是钼深加工的重要中间产品。一种以钼精矿(主要含)
是钼深加工的重要中间产品。一种以钼精矿(主要含) ,还有Cu、Fe的化合物及
,还有Cu、Fe的化合物及 等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
(1)钼元素位于第五周期,与铬同族,则其价电子排布式为_____ 。
(2)焙烧渣中的 在“碱浸”时转化为
在“碱浸”时转化为 ,反应的离子方程式为
,反应的离子方程式为_____ 。
(3)“净化”时加入 溶液,是为了除去残留的
溶液,是为了除去残留的 和
和 。研究表明,该溶液中
。研究表明,该溶液中 和pH的关系为:
和pH的关系为: ,若控制溶液的pH=3.9,此时溶液中
,若控制溶液的pH=3.9,此时溶液中 的浓度为
的浓度为_____ (已知FeS的 )。
)。
(4)“沉淀”时生成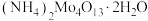 的离子方程式为
的离子方程式为_____ 。
(5)从 溶液到
溶液到 晶体的“一系列操作”为
晶体的“一系列操作”为_____ 、_____ 、过滤、洗涤、干燥。
(6)该流程中产生的工业废气 和
和 可以回收利用,实验原理如图。装置a中溶液的作用是
可以回收利用,实验原理如图。装置a中溶液的作用是_____ ,装置b电解过程的阴极反应式为_____ 。
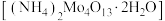 是钼深加工的重要中间产品。一种以钼精矿(主要含)
是钼深加工的重要中间产品。一种以钼精矿(主要含) ,还有Cu、Fe的化合物及
,还有Cu、Fe的化合物及 等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下: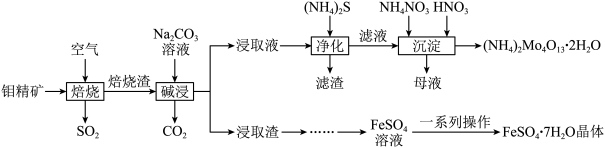
(1)钼元素位于第五周期,与铬同族,则其价电子排布式为
(2)焙烧渣中的
 在“碱浸”时转化为
在“碱浸”时转化为 ,反应的离子方程式为
,反应的离子方程式为(3)“净化”时加入
 溶液,是为了除去残留的
溶液,是为了除去残留的 和
和 。研究表明,该溶液中
。研究表明,该溶液中 和pH的关系为:
和pH的关系为: ,若控制溶液的pH=3.9,此时溶液中
,若控制溶液的pH=3.9,此时溶液中 的浓度为
的浓度为 )。
)。(4)“沉淀”时生成
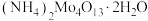 的离子方程式为
的离子方程式为(5)从
 溶液到
溶液到 晶体的“一系列操作”为
晶体的“一系列操作”为(6)该流程中产生的工业废气
 和
和 可以回收利用,实验原理如图。装置a中溶液的作用是
可以回收利用,实验原理如图。装置a中溶液的作用是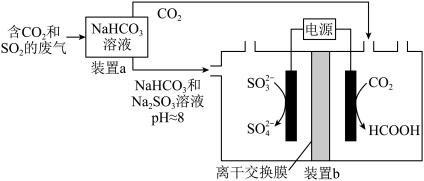
您最近一年使用:0次
解题方法
6 . 铜是人类发现最早并广泛使用的一种金属, 、
、 和
和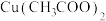 等铜盐在生产、生活和科研中应用广泛,回答下列问题:
等铜盐在生产、生活和科研中应用广泛,回答下列问题:
(1)Cu原子位于元素周期表的_____ 区,此区元素的价电子层结构特点是_____ 。
(2)S、O、N三种元素的第一电离能由大到小为_____ 。
(3) 的中心原子杂化类型是
的中心原子杂化类型是_____ , 的空间结构为
的空间结构为_____ 。
(4)已知 在
在 的催化下,可与
的催化下,可与 反应得到
反应得到 。酸性:
。酸性:
_____ 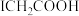 (填“>”或“<”),原因为
(填“>”或“<”),原因为_____ 。
(5)同学们对 的性质进行了探究,已知:
的性质进行了探究,已知: 。
。
现取20.00mL一定浓度的 溶液,向其中加入足量的KI溶液,得到含有碘元素的沉淀,且反应后所得溶液加入淀粉呈蓝色,则发生反应的离子方程式为
溶液,向其中加入足量的KI溶液,得到含有碘元素的沉淀,且反应后所得溶液加入淀粉呈蓝色,则发生反应的离子方程式为_____ ,再用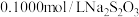 标准溶液滴定至溶液蓝色褪去,消耗
标准溶液滴定至溶液蓝色褪去,消耗 溶液25.00mL,则该
溶液25.00mL,则该 溶液的浓度为
溶液的浓度为_____ mol/L。
 、
、 和
和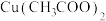 等铜盐在生产、生活和科研中应用广泛,回答下列问题:
等铜盐在生产、生活和科研中应用广泛,回答下列问题:(1)Cu原子位于元素周期表的
(2)S、O、N三种元素的第一电离能由大到小为
(3)
 的中心原子杂化类型是
的中心原子杂化类型是 的空间结构为
的空间结构为(4)已知
 在
在 的催化下,可与
的催化下,可与 反应得到
反应得到 。酸性:
。酸性:
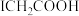 (填“>”或“<”),原因为
(填“>”或“<”),原因为(5)同学们对
 的性质进行了探究,已知:
的性质进行了探究,已知: 。
。现取20.00mL一定浓度的
 溶液,向其中加入足量的KI溶液,得到含有碘元素的沉淀,且反应后所得溶液加入淀粉呈蓝色,则发生反应的离子方程式为
溶液,向其中加入足量的KI溶液,得到含有碘元素的沉淀,且反应后所得溶液加入淀粉呈蓝色,则发生反应的离子方程式为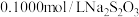 标准溶液滴定至溶液蓝色褪去,消耗
标准溶液滴定至溶液蓝色褪去,消耗 溶液25.00mL,则该
溶液25.00mL,则该 溶液的浓度为
溶液的浓度为
您最近一年使用:0次
解题方法
7 . 雾霾主要成分为灰尘、 、
、 、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
Ⅰ.以氨为脱硝剂时,可将 还原为
还原为 ,副产物为
,副产物为 。
。
(1)已知:①
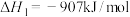
②
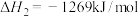
写出氨与NO(g)脱硝反应的热化学反应方程式:_____ 。
(2) 分子中心原子的杂化方式是
分子中心原子的杂化方式是_____ ,其中氮原子和氢原子的价电子排布图分别为_____ 、_____ (填标号)。 可与
可与 形成
形成 ,
, 中H-O-H键角比
中H-O-H键角比 中的
中的_____ (填“大”或“小”),原因为_____ 。
Ⅱ.臭氧也是理想的烟气脱硝剂,其脱硝反应之一为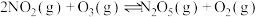
 。某温度时,在固定体积为1L的刚性密闭容器中充入
。某温度时,在固定体积为1L的刚性密闭容器中充入 和
和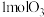 发生反应,25min达到平衡时
发生反应,25min达到平衡时 的浓度为0.5mol/L。
的浓度为0.5mol/L。
(4)该温度下,0~25分钟 的平均反应速率为
的平均反应速率为_____ 。
(5)下列说法正确的是_____ (填标号)。
a.25min后,充入氦气, 平衡转化率增大
平衡转化率增大
b.25min时, 的平衡转化率为25%
的平衡转化率为25%
c.0,是含有极性键的极性分子
d.再充入 和
和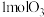 ,达到新平衡时,混合气体的平均相对分子质量增大
,达到新平衡时,混合气体的平均相对分子质量增大
(6)已知: 通常状况下呈无色柱状晶体,它由两种离子构成,其中阴离子为
通常状况下呈无色柱状晶体,它由两种离子构成,其中阴离子为 ,则阳离子的空间结构为
,则阳离子的空间结构为_____ 。
 、
、 、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。Ⅰ.以氨为脱硝剂时,可将
 还原为
还原为 ,副产物为
,副产物为 。
。(1)已知:①

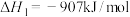
②

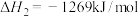
写出氨与NO(g)脱硝反应的热化学反应方程式:
(2)
 分子中心原子的杂化方式是
分子中心原子的杂化方式是a.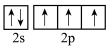 b.
b.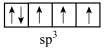 c.
c.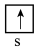 d.
d.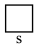
 可与
可与 形成
形成 ,
, 中H-O-H键角比
中H-O-H键角比 中的
中的Ⅱ.臭氧也是理想的烟气脱硝剂,其脱硝反应之一为
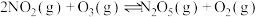
 。某温度时,在固定体积为1L的刚性密闭容器中充入
。某温度时,在固定体积为1L的刚性密闭容器中充入 和
和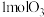 发生反应,25min达到平衡时
发生反应,25min达到平衡时 的浓度为0.5mol/L。
的浓度为0.5mol/L。(4)该温度下,0~25分钟
 的平均反应速率为
的平均反应速率为(5)下列说法正确的是
a.25min后,充入氦气,
 平衡转化率增大
平衡转化率增大b.25min时,
 的平衡转化率为25%
的平衡转化率为25%c.0,是含有极性键的极性分子
d.再充入
 和
和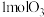 ,达到新平衡时,混合气体的平均相对分子质量增大
,达到新平衡时,混合气体的平均相对分子质量增大(6)已知:
 通常状况下呈无色柱状晶体,它由两种离子构成,其中阴离子为
通常状况下呈无色柱状晶体,它由两种离子构成,其中阴离子为 ,则阳离子的空间结构为
,则阳离子的空间结构为
您最近一年使用:0次
解题方法
8 . 研究对 、
、 、
、 等气体的处理对建设生态文明具有重要意义,回答下列问题。
等气体的处理对建设生态文明具有重要意义,回答下列问题。
(1)已知在一定温度下,某2 L恒容密闭容器中,7 mol 与铁粉发生反应:
与铁粉发生反应: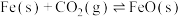
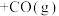 ,反应中有关气体的物质的量随时间变化关系如下图:
,反应中有关气体的物质的量随时间变化关系如下图: 浓度变化表示的化学反应速率为
浓度变化表示的化学反应速率为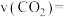
_______ ,固体质量增加了_______ g, 的转化率为
的转化率为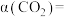
_______ (保留三位有效数字)。若此时平衡总压强为a kPa,则该反应的压强平衡常数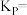
_______ (化为最简分数)。
②2 min时,若只改变温度,曲线变化如图,3 min再次达平衡,则该反应为_______ 反应(填“吸热”或“放热”)。
③5 min时再充入一定量的CO,表示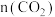 变化的曲线是
变化的曲线是_______ (填图中字母)。
(2)已知: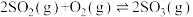
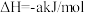 ;
;

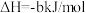 。
。
①则 的
的
_______ 。
②在一定条件下,将 和
和 按体积比1∶1充入恒容密闭容器中,下列能说明该反应达到平衡状态的是
按体积比1∶1充入恒容密闭容器中,下列能说明该反应达到平衡状态的是_______ (填字母)。
A.混合气体的总物质的量保持不变
B.混合气体的密度保持不变
C. 和
和 的物质的量之比保持不变
的物质的量之比保持不变
D.每生成1 mol 的同时消耗1 mol
的同时消耗1 mol
 、
、 、
、 等气体的处理对建设生态文明具有重要意义,回答下列问题。
等气体的处理对建设生态文明具有重要意义,回答下列问题。(1)已知在一定温度下,某2 L恒容密闭容器中,7 mol
 与铁粉发生反应:
与铁粉发生反应: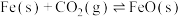
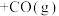 ,反应中有关气体的物质的量随时间变化关系如下图:
,反应中有关气体的物质的量随时间变化关系如下图: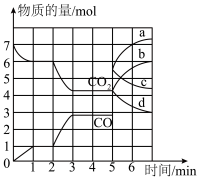
 浓度变化表示的化学反应速率为
浓度变化表示的化学反应速率为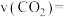
 的转化率为
的转化率为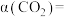
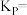
②2 min时,若只改变温度,曲线变化如图,3 min再次达平衡,则该反应为
③5 min时再充入一定量的CO,表示
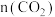 变化的曲线是
变化的曲线是(2)已知:
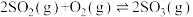
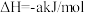 ;
;
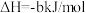 。
。①则
 的
的
②在一定条件下,将
 和
和 按体积比1∶1充入恒容密闭容器中,下列能说明该反应达到平衡状态的是
按体积比1∶1充入恒容密闭容器中,下列能说明该反应达到平衡状态的是A.混合气体的总物质的量保持不变
B.混合气体的密度保持不变
C.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变D.每生成1 mol
 的同时消耗1 mol
的同时消耗1 mol
您最近一年使用:0次
解题方法
9 . 工业上处理铜冶金污水(含 、
、 、
、 、
、 、
、 )的部分流程如下,回答下列问题。
)的部分流程如下,回答下列问题。
②带温下,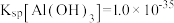 ,
,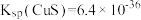 ,
, 。
。
(1)污水里加入双氧水的目的是_______ 。常温下,当溶液中离子浓度 时认为该离子沉淀完全,当
时认为该离子沉淀完全,当 完全沉淀时,则理论上pH的最小值为
完全沉淀时,则理论上pH的最小值为_______ ,“沉渣Ⅰ”的主要成分有_______ (填化学式)。
(2) 溶液呈碱性,其主要原因是
溶液呈碱性,其主要原因是____ (用离子方程式回答)。 溶液中
溶液中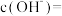
____ (用化学符号完成等式)。
(3)“沉淀池Ⅱ”中,当 和
和 完全沉淀时,溶液中
完全沉淀时,溶液中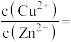
_______ 。
 、
、 、
、 、
、 、
、 )的部分流程如下,回答下列问题。
)的部分流程如下,回答下列问题。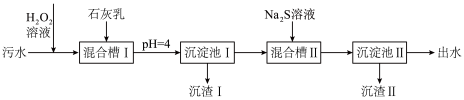
| 物质 |  |  |  |  |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 | 3.5 |
| 完全沉淀pH | 3.2 | 6.7 | 8.2 |
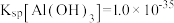 ,
,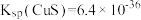 ,
, 。
。(1)污水里加入双氧水的目的是
 时认为该离子沉淀完全,当
时认为该离子沉淀完全,当 完全沉淀时,则理论上pH的最小值为
完全沉淀时,则理论上pH的最小值为(2)
 溶液呈碱性,其主要原因是
溶液呈碱性,其主要原因是 溶液中
溶液中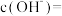
(3)“沉淀池Ⅱ”中,当
 和
和 完全沉淀时,溶液中
完全沉淀时,溶液中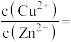
您最近一年使用:0次
10 . 乙二酸( )俗名草酸,是一种二元弱酸,回答下列问题:
)俗名草酸,是一种二元弱酸,回答下列问题:
(1)①写出草酸的第一步电离方程式:_______ 。
②下列措施能够使草酸溶液中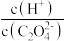 增大的是
增大的是_______ (填字母)。
A.加入 固体 B.通入HCl气体 C.加入NaOH固体 D.加入
固体 B.通入HCl气体 C.加入NaOH固体 D.加入 固体
固体
③常温下, 的
的 溶液中,水电离产生的
溶液中,水电离产生的 浓度
浓度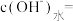
_______ 。
④草酸的两步电离平衡常数为 、
、 ,改变
,改变 草酸溶液的pH,其平衡体系中含碳元素微粒物质的量分数与pH关系如图,则
草酸溶液的pH,其平衡体系中含碳元素微粒物质的量分数与pH关系如图,则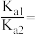
_______ 。 溶液对某草酸溶液进行滴定实验以测定它的准确浓度。
溶液对某草酸溶液进行滴定实验以测定它的准确浓度。
①滴定过程中发生反应的离子方程式为_____ ,滴定终点的颜色变化为溶液由______ 变为______ 。
②假设每次所取草酸体积均为V mL, 标准液浓度为
标准液浓度为 ,三次实验结果记录如下:
,三次实验结果记录如下:
第一次实验中记录消耗 溶液的体积为xmL多于后两次,且差值较大,其原因可能是
溶液的体积为xmL多于后两次,且差值较大,其原因可能是_______ (填字母)。
A.俯视读取滴定终点
B.盛装草酸溶液的滴定管只用蒸馏水清洗,未用草酸溶液润洗
C.滴定前滴定管尖嘴有气泡,滴定结束无气泡
D.锥形瓶预先用草酸润洗过
③据②所得数据,写出计算该草酸溶液的物质的量浓度的表达式
_______  (需化简)。
(需化简)。
 )俗名草酸,是一种二元弱酸,回答下列问题:
)俗名草酸,是一种二元弱酸,回答下列问题:(1)①写出草酸的第一步电离方程式:
②下列措施能够使草酸溶液中
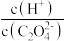 增大的是
增大的是A.加入
 固体 B.通入HCl气体 C.加入NaOH固体 D.加入
固体 B.通入HCl气体 C.加入NaOH固体 D.加入 固体
固体③常温下,
 的
的 溶液中,水电离产生的
溶液中,水电离产生的 浓度
浓度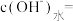
④草酸的两步电离平衡常数为
 、
、 ,改变
,改变 草酸溶液的pH,其平衡体系中含碳元素微粒物质的量分数与pH关系如图,则
草酸溶液的pH,其平衡体系中含碳元素微粒物质的量分数与pH关系如图,则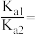
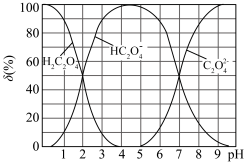
 溶液对某草酸溶液进行滴定实验以测定它的准确浓度。
溶液对某草酸溶液进行滴定实验以测定它的准确浓度。①滴定过程中发生反应的离子方程式为
②假设每次所取草酸体积均为V mL,
 标准液浓度为
标准液浓度为 ,三次实验结果记录如下:
,三次实验结果记录如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | x | y | z |
 溶液的体积为xmL多于后两次,且差值较大,其原因可能是
溶液的体积为xmL多于后两次,且差值较大,其原因可能是A.俯视读取滴定终点
B.盛装草酸溶液的滴定管只用蒸馏水清洗,未用草酸溶液润洗
C.滴定前滴定管尖嘴有气泡,滴定结束无气泡
D.锥形瓶预先用草酸润洗过
③据②所得数据,写出计算该草酸溶液的物质的量浓度的表达式

 (需化简)。
(需化简)。
您最近一年使用:0次



