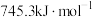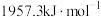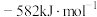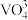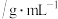名校
1 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。
回答下列问题:
(1) 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有_____ (填序号)。
a.金属键 b.离子键 c.配位键 d.氢键
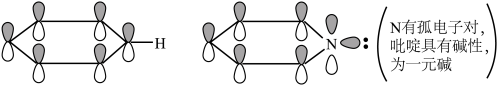
(2)下列关于胍(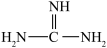 )的说法正确的是
)的说法正确的是________ (填序号)。
a.胍中C的杂化方式与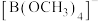 中B的相同
中B的相同
b.与 互为等电子体
互为等电子体
c.有大 键:
键: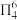
d.为一元碱
(3) 酸性条件下的水解产物是
酸性条件下的水解产物是__________ 和__________ (均写结构简式)。
(4)化合物A(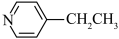 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
①化合物A最多有__________ 个碳原子共平面。
②化合物A的碱性比吡啶__________ (填“强”或“弱”)。
③化合物A的六元环芳香同分异构体有__________ 种。
 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。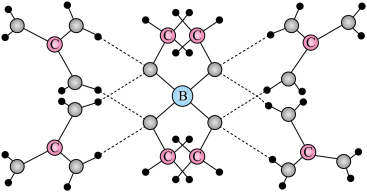
苯( | 吡啶( | |
重原子数 | 6 |
|
价电子数 |
|
|
关系 | 互为等电子体 | |
| ||
共同特点 | 有大 | |
具有芳香性 | ||
(1)
 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有a.金属键 b.离子键 c.配位键 d.氢键
(2)下列关于胍(
 )的说法正确的是
)的说法正确的是a.胍中C的杂化方式与
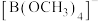 中B的相同
中B的相同b.与
 互为等电子体
互为等电子体c.有大
 键:
键:
d.为一元碱
(3)
 酸性条件下的水解产物是
酸性条件下的水解产物是(4)化合物A(
 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。①化合物A最多有
②化合物A的碱性比吡啶
③化合物A的六元环芳香同分异构体有
您最近一年使用:0次
名校
2 . 过氧乙酸(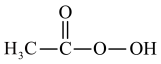 )在卫生医疗、食品消毒及漂白等领域有广泛应用。实验室利用醋酸与双氧水共热,在固体酸的催化下制备过氧乙酸,其装置如下图所示。
)在卫生医疗、食品消毒及漂白等领域有广泛应用。实验室利用醋酸与双氧水共热,在固体酸的催化下制备过氧乙酸,其装置如下图所示。
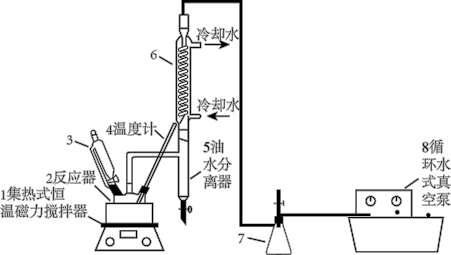
ⅰ.先向仪器2中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
ⅱ.待真空度达到反应要求时,通入冷却水,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水;
ⅲ.从仪器5定期放出水,待反应结束后分离反应器2中的混合物,得到粗产品。
回答下列问题:
(1)仪器2的名称是
(2)分离反应器2中的混合物得到粗产品,分离的方法是
(3)实验中加入乙酸丁酯的主要作用是
(4)过氧乙酸(含
 等)含量的测定:取一定体积的样品
等)含量的测定:取一定体积的样品 ,分成6等份,用过量
,分成6等份,用过量 还原,以
还原,以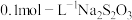 溶液滴定
溶液滴定 (
( ),重复2次,平均消耗量为
),重复2次,平均消耗量为 。再以
。再以 的酸性高锰酸钾溶液滴定样品(滴定过程中
的酸性高锰酸钾溶液滴定样品(滴定过程中 不与过氧乙酸反应),重复2次,平均消耗量为
不与过氧乙酸反应),重复2次,平均消耗量为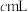 。涉及下列反应:
。涉及下列反应:ⅰ.

ⅱ.
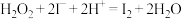
ⅲ.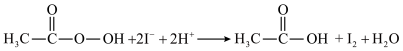
 溶液滴定
溶液滴定 时选用的指示剂是
时选用的指示剂是②用
 的酸性高锰酸钾溶液滴定样品,标志滴定终点的现象是
的酸性高锰酸钾溶液滴定样品,标志滴定终点的现象是③样品中的过氧乙酸的浓度为
 。(用含
。(用含 、
、 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
3 . 铜及其化合物在生活、生产中用途广泛。回答下列问题:
(1)基态铁原子的价层电子的轨道表示式为__________ ,其原子核外电子的空间运动状态有__________ 种。
(2)高温下CuO能转化为 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是__________ 。
(3)在水溶液中 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释__________ 。
(注:水合能指的是气态基态离子与水分子结合生成 水合离子时所释放的能量。)
水合离子时所释放的能量。)
(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。__________ ,加热时,M首先失去的组分分子空间结构名称为__________ 。
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为__________ 。晶胞参数分别为 ,
, 、
、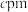 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为__________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
(1)基态铁原子的价层电子的轨道表示式为
(2)高温下CuO能转化为
 ,说明高温下
,说明高温下 比
比 稳定,原因是
稳定,原因是(3)在水溶液中
 则不如
则不如 稳定,因为
稳定,因为 在水溶液中可以
在水溶液中可以 的形式存在。请结合表中信息加以解释
的形式存在。请结合表中信息加以解释第一电离能 | 第二电离能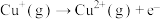 | 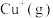 水合能( 水合能( ) ) | 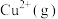 水合能( 水合能( ) ) |
|
|
|
|
 水合离子时所释放的能量。)
水合离子时所释放的能量。)(4)H、N、O与Cu能形成一种阳离子M,呈轴向狭长的八面体结构(如下图所示)。
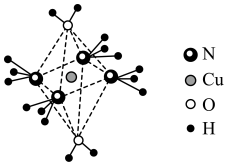
(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(铜原子)的分数坐标为 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 ,
, 、
、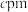 ,晶胞棱边夹角均为90°,该晶体的密度为
,晶胞棱边夹角均为90°,该晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
4 . 我国航天事业高速发展,火箭推进剂的研究一直是航天工业的热点课题。火箭推进剂燃料有肼( )、液氢等,常见氧化剂有
)、液氢等,常见氧化剂有 、液氧等。回答下列问题:
、液氧等。回答下列问题:
(1)已知下列反应的热化学方程式如下:
ⅰ.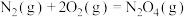
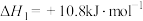
ⅱ.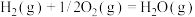
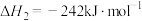
ⅲ.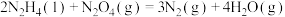
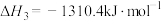
①则

__________  。
。
②反应ⅲ可自发进行的原因是__________ 。
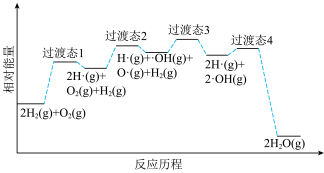
③火箭推进器内氢氧燃烧的简化反应历程如图所示:__________ 。
(2)利用甲烷和水蒸气催化制氢主要存在如下两个反应:
a:
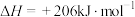
b:
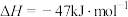
恒定压强为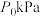 时,将物质的量之比为
时,将物质的量之比为 的
的 与
与 混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
①下列操作中,能提高 平衡转化率的是
平衡转化率的是__________ (填字母)。
A.提高 与
与 的投料比 B.移除CO
的投料比 B.移除CO
C.选择合适的催化剂 D.恒温恒压下通入Ar气
②已知 为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
__________  (列出计算式)。
(列出计算式)。
③平衡体系中 的物质的量分数随温度
的物质的量分数随温度 的变化如图,解释原因
的变化如图,解释原因__________ 。
 )、液氢等,常见氧化剂有
)、液氢等,常见氧化剂有 、液氧等。回答下列问题:
、液氧等。回答下列问题:(1)已知下列反应的热化学方程式如下:
ⅰ.
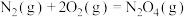
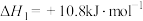
ⅱ.
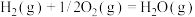
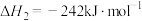
ⅲ.
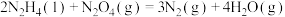
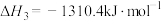
①则


 。
。②反应ⅲ可自发进行的原因是
③火箭推进器内氢氧燃烧的简化反应历程如图所示:
(2)利用甲烷和水蒸气催化制氢主要存在如下两个反应:
a:

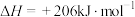
b:

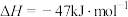
恒定压强为
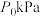 时,将物质的量之比为
时,将物质的量之比为 的
的 与
与 混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:
混合投入反应容器中,600℃时平衡体系中部分组分的物质的量分数如下表所示:物质 |
|
|
|
|
物质的量分数 | 0.04 | 0.32 | 0.50 | 0.08 |
 平衡转化率的是
平衡转化率的是A.提高
 与
与 的投料比 B.移除CO
的投料比 B.移除COC.选择合适的催化剂 D.恒温恒压下通入Ar气
②已知
 为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
为反应的压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的分压代替浓度;分压=总压×物质的量分数。600℃时反应a的压强平衡常数为
 (列出计算式)。
(列出计算式)。③平衡体系中
 的物质的量分数随温度
的物质的量分数随温度 的变化如图,解释原因
的变化如图,解释原因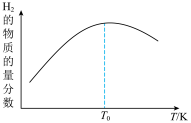
您最近一年使用:0次
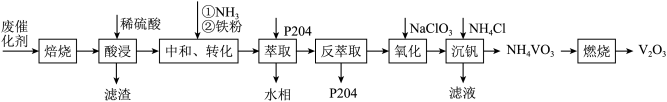
5 . 某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,
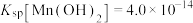


回答下列问题:
(1)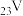 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中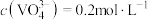 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,

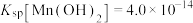


回答下列问题:
(1)
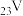 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是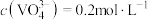 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。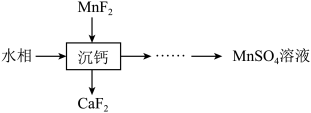
您最近一年使用:0次
名校
6 . 铋酸钠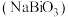 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,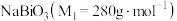 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;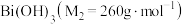 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题:_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
(3)装置B的作用为_______ 。
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是_______ 、过滤、洗涤、干燥。
(5) 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为_______ 。
(6)取上述 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的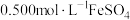 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为_______ ,假设终点时消耗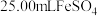 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为_______ %(结果保留小数点后一位)。
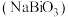 是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,
是分析化学中的重要试剂,可应用于钢铁分析中测定锰。某兴趣小组设计实验制取铋酸钠并探究其应用,其中,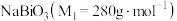 为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;
为淡黄色固体,难溶于冷水,遇沸水或酸则迅速分解;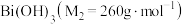 为白色固体,难溶于水。根据实验回答下列问题:
为白色固体,难溶于水。根据实验回答下列问题: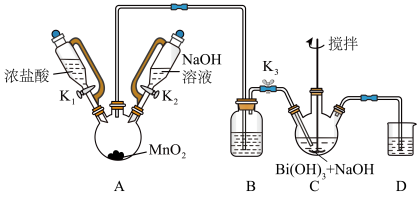
(2)装置C中发生反应的离子方程式为
(3)装置B的作用为
(4)反应结束后,为从装置C中获得尽可能多的产品的操作是
(5)
 在酸性介质中可用于
在酸性介质中可用于 的鉴定,已知
的鉴定,已知 被还原为
被还原为 ,其中氧化剂与还原剂的物质的量之比为
,其中氧化剂与还原剂的物质的量之比为(6)取上述
 样品
样品 ,加入稀硫酸和
,加入稀硫酸和 溶液使其完全溶解,稀释至
溶液使其完全溶解,稀释至 ,取出
,取出 溶液,然后用新配制的
溶液,然后用新配制的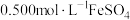 溶液进行滴定,滴定终点的颜色变化为
溶液进行滴定,滴定终点的颜色变化为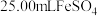 溶液。则该样品中
溶液。则该样品中 纯度为
纯度为
您最近一年使用:0次
名校
解题方法
7 . 碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上常以碲铜废料(主要成分是 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下: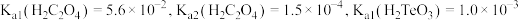 ,
,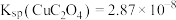 。
。
(1) 中碲元素的化合价为
中碲元素的化合价为_______ 。碲在元素周期表中的位置为_______ 。
(2)“氧化酸浸”得到 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)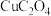 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为_______ 。(保留两位有效数字){已知:反应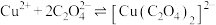 的平衡常数
的平衡常数 }
}
(4)“还原”在 50 ℃条件下进行: ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为_______ 。
(5)“还原”时, 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有_______ 。
(6)将一定质量的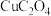 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为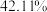 ,则剩余固体的化学式为
,则剩余固体的化学式为_______ 。
 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下:
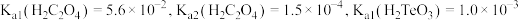 ,
, 。
。(1)
 中碲元素的化合价为
中碲元素的化合价为(2)“氧化酸浸”得到
 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)
 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为 的平衡常数
的平衡常数 }
}(4)“还原”在 50 ℃条件下进行:
 ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为(5)“还原”时,
 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有(6)将一定质量的
 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为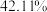 ,则剩余固体的化学式为
,则剩余固体的化学式为
您最近一年使用:0次
名校
8 . 尿素是一种重要化工生产原料。工业上以液氨和二氧化碳为原料,在高温高压条件下直接合成尿素,主要反应如下:
①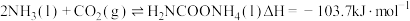
②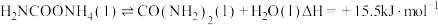
回答下列问题:
(1)
_______  。
。
(2)在 和
和 时
时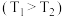 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: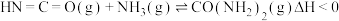 。
。
平衡时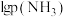 与
与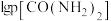 的关系如图所示,
的关系如图所示,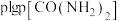 为物质的分压(单位为
为物质的分压(单位为 ),若
),若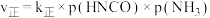 ,
,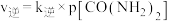 。
。 时,
时,
_______ 。 时此反应的标准平衡常数
时此反应的标准平衡常数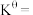
_______ 。{已知:分压 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: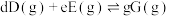 ,其中
,其中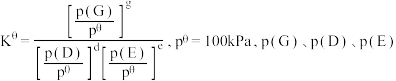 为各组分的平衡分压}
为各组分的平衡分压}_______ 。
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源_______ 相连,其反应方程式为_______ 。
①
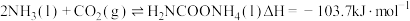
②
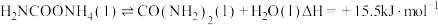
回答下列问题:
(1)

 。
。(2)在
 和
和 时
时 ,向恒容容器中投入等物质的量的两种反应物,发生反应:
,向恒容容器中投入等物质的量的两种反应物,发生反应: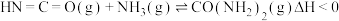 。
。平衡时
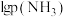 与
与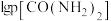 的关系如图所示,
的关系如图所示,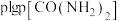 为物质的分压(单位为
为物质的分压(单位为 ),若
),若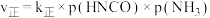 ,
,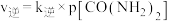 。
。 时,
时,
 时此反应的标准平衡常数
时此反应的标准平衡常数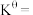
 总压
总压 该组分物质的量分数,对于反应:
该组分物质的量分数,对于反应: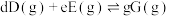 ,其中
,其中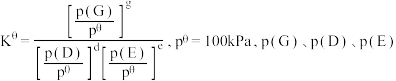 为各组分的平衡分压}
为各组分的平衡分压}
(4)电化学合成尿素为实现碳、氮中和与减轻环境污染提供了一种很有前景的解决方案。某碱性电化学合成系统如图所示,该系统中,合成尿素的一极与电源
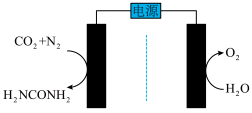
您最近一年使用:0次
名校
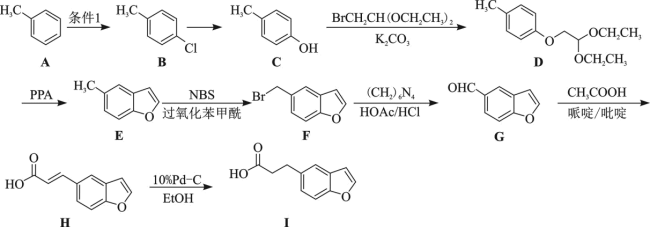
9 . 有机物I是制备治疗失眠症药物雷美替胺的中间体,可由甲苯经以下路线合成:
(1)C的名称为__________ ;F所含非含氧官能团的名称为__________ 。
(2)条件1是__________ ; 的反应类型是
的反应类型是__________ 。
(3)B在高温高压下与足量的氢氧化钠溶液反应的化学方程式为__________ 。
(4)1molE与 发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有
发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有__________ 种(不考虑立体异构);
①含有苯环且再无其它的环
②遇 溶液发生显色反应
溶液发生显色反应
(5)G生成H经历了加成反应和消去反应,反应过程如图所示:__________ 。
(1)C的名称为
(2)条件1是
 的反应类型是
的反应类型是(3)B在高温高压下与足量的氢氧化钠溶液反应的化学方程式为
(4)1molE与
 发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有
发生加成反应得到K,K的同分异构体中同时符合以下两个条件的有①含有苯环且再无其它的环
②遇
 溶液发生显色反应
溶液发生显色反应(5)G生成H经历了加成反应和消去反应,反应过程如图所示:

您最近一年使用:0次
名校
解题方法
10 . 5-硝基水杨酸具有抑制炎症和治疗溃疡性结肠炎的作用,可由水杨酸通过硝化反应制备,其反应为:
Ⅰ、产品合成:将水杨酸13.8g(0.1mol)和水(15mL)加入下图反应装置中,在搅拌下缓缓滴加68%硝酸(18mL)和浓硫酸(1.8mL)组成的混酸液。逐渐升温至70-80℃,并在此温度下保温回流2h。
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为__________(填标号)。
(2)在70-80℃反应时温度计水银球置于__________ (填“a”或“b”)处。
(3)硝化步骤中制取“混酸液”的具体操作是__________ 。
(4)合成过程中需要防暴沸却不需要额外添加沸石的原因是______________________________ 。
(5)“操作1”的名称是__________ 。
(6)5-硝基水杨酸的产率为__________ (保留三位有效数字)。
(7)硝化反应是硝酸在浓硫酸作用下,硝酸质子化后失水,产生硝酰正离子( ),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
已知:羧基是吸电子基团,羟基是推电子基团。
则水杨酸中有助于发生硝化反应的基团是____________________ 。
名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度 | 溶解性 |
水杨酸 | 138 | 158-161 | 336.3 | 1.375 | 微溶于冷水,易溶于热水、乙醇、乙醚和丙酮 |
5-硝基水杨酸 | 183 | 229-233 | 399.1 | 1.6 | 不溶于冷水,微溶于热水,易溶于乙醇、乙醚 |
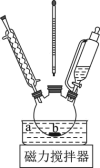
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为__________(填标号)。
| A.100mL | B.250mL | C.500mL | D.1000mL |
(3)硝化步骤中制取“混酸液”的具体操作是
(4)合成过程中需要防暴沸却不需要额外添加沸石的原因是
(5)“操作1”的名称是
(6)5-硝基水杨酸的产率为
(7)硝化反应是硝酸在浓硫酸作用下,硝酸质子化后失水,产生硝酰正离子(
 ),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。
),硝酰正离子进攻苯环形成中间体,再失去一个质子得到硝基苯。已知:羧基是吸电子基团,羟基是推电子基团。
则水杨酸中有助于发生硝化反应的基团是
您最近一年使用:0次

 )
)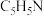 )
)


 (
(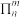 ,其中
,其中 为形成大
为形成大