名校
解题方法
1 . 废电池粉[锂、铁、磷、铜、铝和碳(碳粉)的质量分数分别为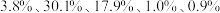 和
和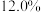 ]回收处理的工艺流程如下:
]回收处理的工艺流程如下: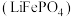 转化为难溶于水
转化为难溶于水 和可溶于水硫酸锂,写出该反应的化学方程式:
和可溶于水硫酸锂,写出该反应的化学方程式:______________ 。哪些途径可以提高转化的效率(写两条):______________ 。
(2)“净化”步骤可以去除滤液中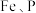 等元素,沉渣1中含
等元素,沉渣1中含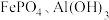 、
、_______ 。沉渣2的主要成分为_______ 。
(3)“电解”可以将溶液中的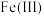 转化为
转化为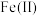 ,溶液中
,溶液中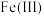 完全转化为
完全转化为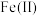 的标志是
的标志是______________ 。甲醇在阳极发生反应生成甲醛,阳极电极反应方程式为_______ 。在电解完成后向溶液中加入 溶液可以将溶液中的
溶液可以将溶液中的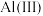 沉淀。
沉淀。
(4)称取一定量的二水磷酸铁,用硝酸溶解后再用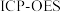 进行分析,得到部分杂质的质量分数
进行分析,得到部分杂质的质量分数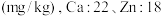 ,评价该制备过程
,评价该制备过程_______ (填“是”或“否”)符合均满足 《电池用磷酸铁》的Ⅱ型标准
《电池用磷酸铁》的Ⅱ型标准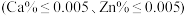 。
。
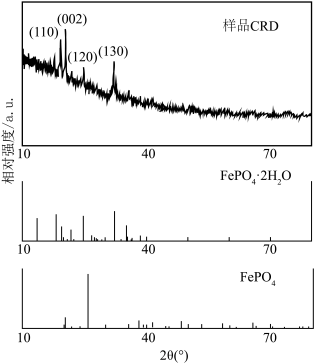
(5) 衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、
衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、 和
和 的标准卡片的
的标准卡片的 衍射实验图谱,结合图像内容判断获的样品
衍射实验图谱,结合图像内容判断获的样品_______ (填“是”或“否”) 。
。
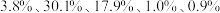 和
和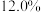 ]回收处理的工艺流程如下:
]回收处理的工艺流程如下: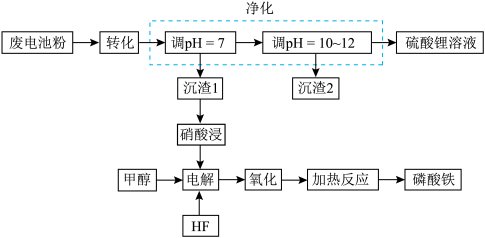
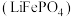 转化为难溶于水
转化为难溶于水 和可溶于水硫酸锂,写出该反应的化学方程式:
和可溶于水硫酸锂,写出该反应的化学方程式:(2)“净化”步骤可以去除滤液中
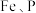 等元素,沉渣1中含
等元素,沉渣1中含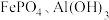 、
、(3)“电解”可以将溶液中的
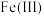 转化为
转化为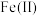 ,溶液中
,溶液中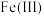 完全转化为
完全转化为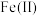 的标志是
的标志是 溶液可以将溶液中的
溶液可以将溶液中的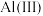 沉淀。
沉淀。(4)称取一定量的二水磷酸铁,用硝酸溶解后再用
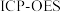 进行分析,得到部分杂质的质量分数
进行分析,得到部分杂质的质量分数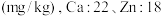 ,评价该制备过程
,评价该制备过程 《电池用磷酸铁》的Ⅱ型标准
《电池用磷酸铁》的Ⅱ型标准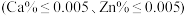 。
。(5)
 衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、
衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、 和
和 的标准卡片的
的标准卡片的 衍射实验图谱,结合图像内容判断获的样品
衍射实验图谱,结合图像内容判断获的样品 。
。
您最近一年使用:0次
名校
2 . 我国科学家发现化合物J对消除由蜈蚣叮咬产生的严重临床症状有良好效果.J的两条合成路线如图所示.回答下列问题: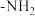 易被氧化。
易被氧化。
(1)A中官能团的名称为_______ 。
(2) 的化学方程式为:
的化学方程式为:______________ 。
(3)反应中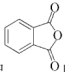 的作用是
的作用是______________ 。
(4)B有多种同分异构体,写出任意一种同时满足下列条件的M的结构简式:___________ 。
①含有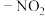 的芳香族化合物;
的芳香族化合物;
②能发生水解反应且水解产物之一含有醛基;
③苯环上一氯代物有2种
(5) 的反应类型是
的反应类型是______________ 。
(6)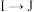 的反应还可能有副产物,请写出其中一种的结构简式:
的反应还可能有副产物,请写出其中一种的结构简式:______________ 。
(7)以苯胺(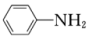 )和乙二酸
)和乙二酸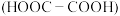 为起始原料,可以制备
为起始原料,可以制备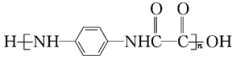 。选用必要的试剂完成合成路线
。选用必要的试剂完成合成路线_____________ 。
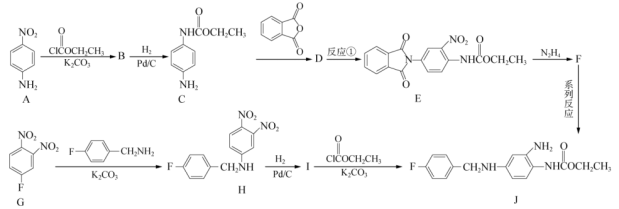
已知:i.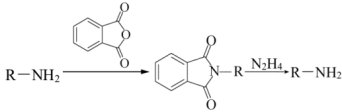 (R代表烃基);
(R代表烃基);
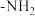 易被氧化。
易被氧化。(1)A中官能团的名称为
(2)
 的化学方程式为:
的化学方程式为:(3)反应中
 的作用是
的作用是(4)B有多种同分异构体,写出任意一种同时满足下列条件的M的结构简式:
①含有
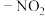 的芳香族化合物;
的芳香族化合物;②能发生水解反应且水解产物之一含有醛基;
③苯环上一氯代物有2种
(5)
 的反应类型是
的反应类型是(6)
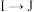 的反应还可能有副产物,请写出其中一种的结构简式:
的反应还可能有副产物,请写出其中一种的结构简式:(7)以苯胺(
 )和乙二酸
)和乙二酸 为起始原料,可以制备
为起始原料,可以制备 。选用必要的试剂完成合成路线
。选用必要的试剂完成合成路线
您最近一年使用:0次
3 . 丙烯是一种重要的化工原料。利用丙烷脱氢制备丙烯的原理为:
直接脱氢: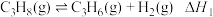
回答下列问题:
(1)各化学键的键能如表所示,则
__________  。
。
(2)计算机模拟直接脱氢的反应历程如图所示:__________ (填“>”“<”或“=”)第二步。
②依据该历程图推测丙烷脱氢可能会产生的副产物为__________ (填分子式)。
(3)一种提高丙烷转化率的催化剂—膜系统,能让部分氢气透过膜后与反应体系分离,其工作原理如图所示:__________ 。
②在T、p0条件下, 丙烷通入无膜反应器,丙烷的平衡转化率为
丙烷通入无膜反应器,丙烷的平衡转化率为 ,该反应的压强平衡常数Kp=
,该反应的压强平衡常数Kp=__________ ;在相同条件下,若换成如图所示有膜反应器,丙烷的平衡转化率为 ,则相同时间内出口
,则相同时间内出口 和出口
和出口 的氢气质量之比为
的氢气质量之比为__________ 。
(4)丙烯还可通过丙烷氧化脱氢的方法制备,其原理为:
氧化脱氢: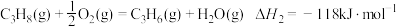
相比直接脱氢,氧化脱氢制备丙烯的优点为__________ ,缺点为__________ (各写1点即可)。
直接脱氢:
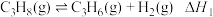
回答下列问题:
(1)各化学键的键能如表所示,则

 。
。| 化学键 | C-H | C-C(π键) | H-H |
键能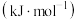 | 413 | 271 | 436 |
(2)计算机模拟直接脱氢的反应历程如图所示:
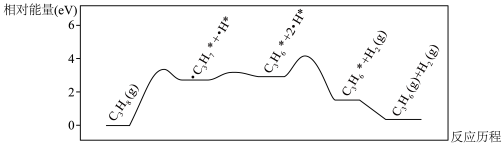
②依据该历程图推测丙烷脱氢可能会产生的副产物为
(3)一种提高丙烷转化率的催化剂—膜系统,能让部分氢气透过膜后与反应体系分离,其工作原理如图所示:
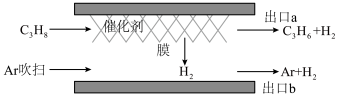
②在T、p0条件下,
 丙烷通入无膜反应器,丙烷的平衡转化率为
丙烷通入无膜反应器,丙烷的平衡转化率为 ,该反应的压强平衡常数Kp=
,该反应的压强平衡常数Kp= ,则相同时间内出口
,则相同时间内出口 和出口
和出口 的氢气质量之比为
的氢气质量之比为(4)丙烯还可通过丙烷氧化脱氢的方法制备,其原理为:
氧化脱氢:
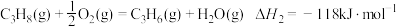
相比直接脱氢,氧化脱氢制备丙烯的优点为
您最近一年使用:0次
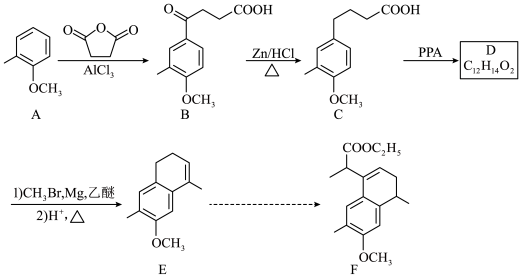
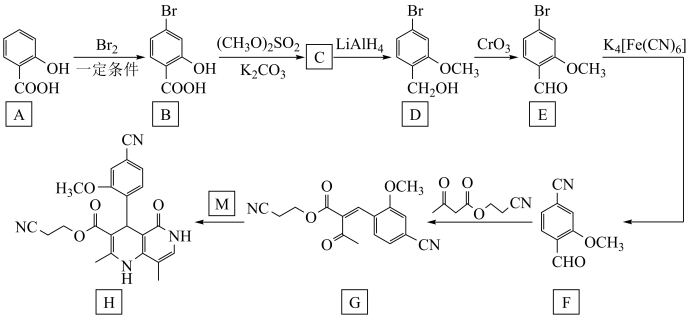
4 . 化合物F是合成药物的重要中间体,其合成路线如图所示。
(1)B→C的反应类型是__________ 。
(2)C中官能团的名称是__________ 。
(3)D的结构简式为__________ 。
(4)F中有__________ 个手性碳原子。
(5)A的同分异构体中,遇 溶液显色的共有
溶液显色的共有__________ 种。
(6)以苯、乙烯和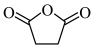 为含碳原料,利用上述原理,合成化合物
为含碳原料,利用上述原理,合成化合物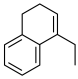 。
。
①相关步骤涉及到烯烃制卤代烃的反应,其化学方程式为__________ 。
②最后一步转化中与卤代烃反应的有机物的结构简式为__________ 。
已知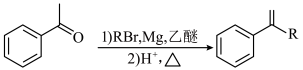
(1)B→C的反应类型是
(2)C中官能团的名称是
(3)D的结构简式为
(4)F中有
(5)A的同分异构体中,遇
 溶液显色的共有
溶液显色的共有(6)以苯、乙烯和
 为含碳原料,利用上述原理,合成化合物
为含碳原料,利用上述原理,合成化合物 。
。①相关步骤涉及到烯烃制卤代烃的反应,其化学方程式为
②最后一步转化中与卤代烃反应的有机物的结构简式为
您最近一年使用:0次
解题方法
5 . 实现废钨——镍型加氢催化剂(主要成分为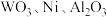 ,还含有
,还含有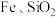 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。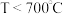 ,纯碱不与
,纯碱不与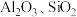 反应。
反应。
ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)28Ni位于元素周期表的第__________ 周期、__________ 族。
(2)“氧化”的目的为__________ 和将金属单质氧化至相应价态。
(3)“钠化焙烧”中生成 的化学方程式为
的化学方程式为__________ 。
(4)“酸化沉钨”后过滤,所得滤饼的主要成分为__________ (填化学式)。
(5)“调 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为__________ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
“一系列操作”依次是__________ 、及时过滤、洗涤、干燥。
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为__________ 。
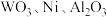 ,还含有
,还含有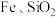 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。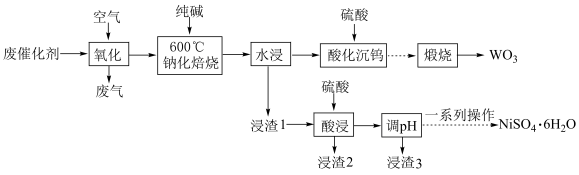
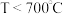 ,纯碱不与
,纯碱不与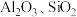 反应。
反应。ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的
 范围如下:
范围如下:| 金属离子 | Ni2+ | Al3+ | Fe3+ |
| 开始沉淀时的pH | 6.9 | 3.4 | 1.5 |
| 沉淀完全时的pH | 8.9 | 4.7 | 2.8 |
(1)28Ni位于元素周期表的第
(2)“氧化”的目的为
(3)“钠化焙烧”中生成
 的化学方程式为
的化学方程式为(4)“酸化沉钨”后过滤,所得滤饼的主要成分为
(5)“调
 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
| 温度 | 低于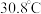 |  | 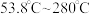 | 高于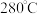 |
| 晶体形态 |  |  | 多种结晶水合物 |  |
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 环己烯( )是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。
)是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。


氧化脱氢:


回答下列问题:
(1)已知几种化学键的键能数据如下表所示。
| 化学键 | H-H | C-H | C-C |  |
键能/(kJ | 436 | 413 | 348 | 615 |
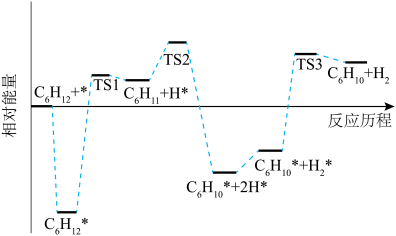
①
 的焓变小于零的原是
的焓变小于零的原是②
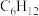 脱氢的速率
脱氢的速率 *脱氢的速率。
*脱氢的速率。③环己烷脱氢制备环己烯的副产物可能有
④在恒容密闭容器中充入一定量的环己烷,其初始压强为p
 ,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ=
,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ= ,Kθ=
,Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。(3)在压强恒为
 的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为
的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为 
您最近一年使用:0次
解题方法
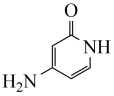
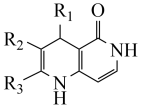
7 . 有机物H是一种用于治疗慢性肾病的药物,其合成路线如下: R1CH2OH
R1CH2OH
回答下列问题:
(1)A的化学名称是_______ 。
(2)C中发生还原反应的官能团的名称是_______ ,D中发生氧化反应的官能团的名称是_______ 。
(3)E与新制的Cu(OH)2反应的化学方程式为_______ 。
(4)F分子中可能共平面的碳原子数最多为_______ 。
(5)F→G涉及两步反应,已知第一步反应为加成反应,则第二步反应为_______ 。
(6)M的结构简式为_______ 。
(7)F有多种同分异构体,同时满足下列条件的F的同分异构体共有____ 种(不考虑立体异构)。
a.分子结构中含有-NH2和苯环(无其他环)。
b.能与NaHCO3溶液发生反应产生气体。
已知:①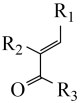 +
+ →
→
 R1CH2OH
R1CH2OH回答下列问题:
(1)A的化学名称是
(2)C中发生还原反应的官能团的名称是
(3)E与新制的Cu(OH)2反应的化学方程式为
(4)F分子中可能共平面的碳原子数最多为
(5)F→G涉及两步反应,已知第一步反应为加成反应,则第二步反应为
(6)M的结构简式为
(7)F有多种同分异构体,同时满足下列条件的F的同分异构体共有
a.分子结构中含有-NH2和苯环(无其他环)。
b.能与NaHCO3溶液发生反应产生气体。
您最近一年使用:0次
解题方法
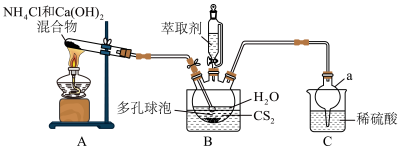
8 . 硫脲 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为__________ 。
(2)从结构角度分析,硫脲可溶于水的原因是__________ 。
(3)多孔球泡的作用是__________ 。
(4)B中反应完全的标志是__________ 。
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为__________ (填标号)。
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:
取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为__________ 。
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成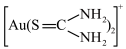 ,反应的离子方程式为
,反应的离子方程式为_______ 。溶解金的过程伴随着溶液变红的现象,原因可能为硫脲发生异构化生成__________ (填化学式)。
 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为
(2)从结构角度分析,硫脲可溶于水的原因是
(3)多孔球泡的作用是
(4)B中反应完全的标志是
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:

取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成
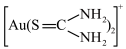 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
9 . 环己酮(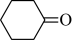 )是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
)是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
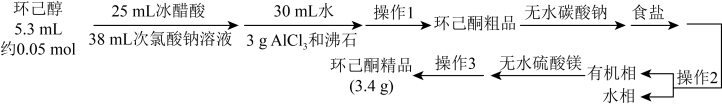
①环己酮的密度比水的密度小,能与水形成恒沸混合物,沸点为95℃。
②31℃时,环己酮在水中的溶解度为2.4 g。
回答下列问题:
(1)环己醇与次氯酸钠溶液反应的离子方程式为
(2)“操作1”和“操作3”是蒸馏,其蒸馏装置中用到的冷凝管是
A.  B.
B.  C.
C. 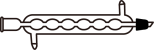
(4)实验中加入无水硫酸镁的目的是
(5)制备环己酮粗品时:
①加入次氯酸钠溶液后,用淀粉-碘化钾试纸检验,试纸应呈蓝色,否则应再补加次氯酸钠溶液,其目的是
②次氯酸钠溶液的浓度可用间接碘量法测定。用移液管移取10.00mL次氯酸钠溶液于500mL容量瓶中,加蒸馏水至刻度线,摇匀后移取25.00mL该溶液于250mL锥形瓶中,加入50mL0.1 mol·L-1盐酸和2g碘化钾,用0.1mol·L-1硫代硫酸钠标准溶液滴定析出的碘。在滴定接近终点时加入1mL0.2%淀粉溶液。析出碘的反应的离子方程式为
(6)本实验环己酮的产率最接近_______(填字母)。
| A.50% | B.60% | C.70% | D.80% |
您最近一年使用:0次
名校
10 . 硫及其化合物在生产、生活中有广泛应用。
Ⅰ.羰基硫(COS)是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。以FeOOH固体作催化剂, 分别与CO、
分别与CO、 反应制备COS的反应如下:
反应制备COS的反应如下:
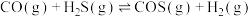 ;
;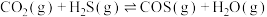
(1)COS的电子式为___________ 。
(2)一定温度下,在恒容密闭容器中充入1mol CO,1mol 、2mol
、2mol  气体,加入适量的FeOOH,发生上述反应。下列叙述正确的是___________(填字母)。
气体,加入适量的FeOOH,发生上述反应。下列叙述正确的是___________(填字母)。
Ⅱ.利用 和
和 反应制备
反应制备 。
。
已知: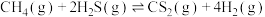 分以下两步进行:
分以下两步进行:
(a)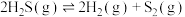
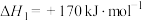
(b)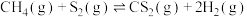
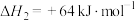
(3)一定温度下,保持总压强为100kPa,向反应器中充入 和Ar,发生反应a,测得
和Ar,发生反应a,测得 平衡转化率与温度、投料比
平衡转化率与温度、投料比 [
[ ]的关系如图1所示。
]的关系如图1所示。 增大,
增大, 平衡转化率增大的原因是
平衡转化率增大的原因是___________ 。 温度下,该反应的平衡常数
温度下,该反应的平衡常数
___________ kPa(结果保留2位小数)。
提示:用分压计算的平衡常数叫压强平衡常数 ,分压等于总压×物质的量分数。
,分压等于总压×物质的量分数。
(4)投料体积比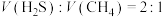 ,并用
,并用 稀释。常压下,不同温度下反应相同时间后,测得
稀释。常压下,不同温度下反应相同时间后,测得 和
和 体积分数如图2所示。
体积分数如图2所示。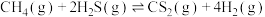 能自发进行的条件是
能自发进行的条件是___________ (填字母)。
A.较低温度 B.较高温度 C.任何温度
②在950℃,常压下,保持通入的 体积分数不变,提高投料比
体积分数不变,提高投料比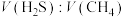 ,
, 的转化率不变,其原因是
的转化率不变,其原因是___________ 。
③其他条件不变,在950~1150℃范围内, (g)的体积分数随温度变化趋势符合图像
(g)的体积分数随温度变化趋势符合图像___________ (填字母),请说明理由:___________ 。
Ⅰ.羰基硫(COS)是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。以FeOOH固体作催化剂,
 分别与CO、
分别与CO、 反应制备COS的反应如下:
反应制备COS的反应如下: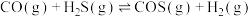 ;
;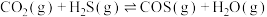
(1)COS的电子式为
(2)一定温度下,在恒容密闭容器中充入1mol CO,1mol
 、2mol
、2mol  气体,加入适量的FeOOH,发生上述反应。下列叙述正确的是___________(填字母)。
气体,加入适量的FeOOH,发生上述反应。下列叙述正确的是___________(填字母)。| A.气体总压强不变时达到平衡状态 |
| B.平衡时混合气体中COS体积分数最大值为50% |
C.达到平衡时再充入 , , 的平衡转化率增大 的平衡转化率增大 |
| D.其他条件相同,使用纳米FeOOH比微米的反应速率大 |
Ⅱ.利用
 和
和 反应制备
反应制备 。
。已知:
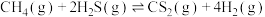 分以下两步进行:
分以下两步进行:(a)
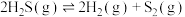
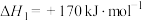
(b)
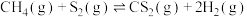
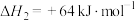
(3)一定温度下,保持总压强为100kPa,向反应器中充入
 和Ar,发生反应a,测得
和Ar,发生反应a,测得 平衡转化率与温度、投料比
平衡转化率与温度、投料比 [
[ ]的关系如图1所示。
]的关系如图1所示。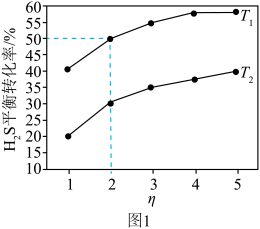
 增大,
增大, 平衡转化率增大的原因是
平衡转化率增大的原因是 温度下,该反应的平衡常数
温度下,该反应的平衡常数
提示:用分压计算的平衡常数叫压强平衡常数
 ,分压等于总压×物质的量分数。
,分压等于总压×物质的量分数。(4)投料体积比
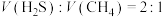 ,并用
,并用 稀释。常压下,不同温度下反应相同时间后,测得
稀释。常压下,不同温度下反应相同时间后,测得 和
和 体积分数如图2所示。
体积分数如图2所示。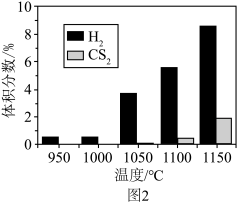
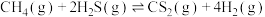 能自发进行的条件是
能自发进行的条件是A.较低温度 B.较高温度 C.任何温度
②在950℃,常压下,保持通入的
 体积分数不变,提高投料比
体积分数不变,提高投料比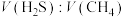 ,
, 的转化率不变,其原因是
的转化率不变,其原因是③其他条件不变,在950~1150℃范围内,
 (g)的体积分数随温度变化趋势符合图像
(g)的体积分数随温度变化趋势符合图像A. 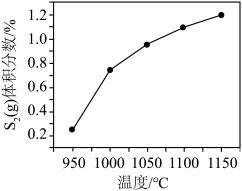 B.
B.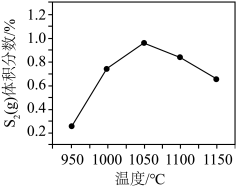
C. 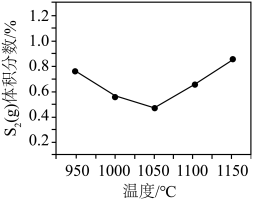 D.
D.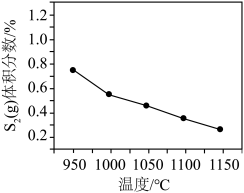
您最近一年使用:0次
7日内更新
|
201次组卷
|
2卷引用:湖北省T8联盟2024届高三下学期压轴考试(二模)化学试题



