真题
解题方法
1 . 铍用于宇航器件的构筑。一种从其铝硅酸盐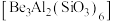 中提取铍的路径为:
中提取铍的路径为: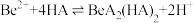
回答下列问题:
(1)基态 的轨道表示式为
的轨道表示式为_______ 。
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是_______ 。
(3)“萃取分液”的目的是分离 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是_______ 。
(4)写出反萃取生成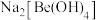 的化学方程式
的化学方程式_______ 。“滤液2”可以进入_______ 步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_______ 。
(6) 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为_______ 。
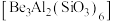 中提取铍的路径为:
中提取铍的路径为: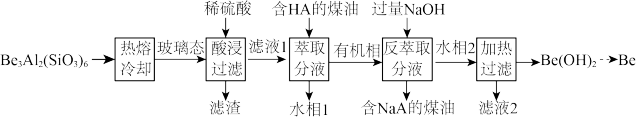
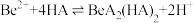
回答下列问题:
(1)基态
 的轨道表示式为
的轨道表示式为(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3)“萃取分液”的目的是分离
 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是(4)写出反萃取生成
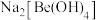 的化学方程式
的化学方程式(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6)
 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为
您最近一年使用:0次
真题
解题方法
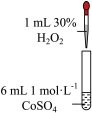
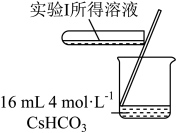
2 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、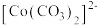 为红色、
为红色、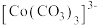 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
(1)配制 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明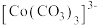 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、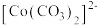 为红色、
为红色、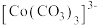 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b.  c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是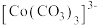 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
真题
3 . 用 和焦炭为原料,经反应I、Ⅱ得到
和焦炭为原料,经反应I、Ⅱ得到 ,再制备乙炔是我国科研人员提出的绿色环保新路线。
,再制备乙炔是我国科研人员提出的绿色环保新路线。
反应I: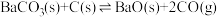
反应Ⅱ: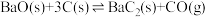
回答下列问题:
(1)写出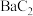 与水反应的化学方程式
与水反应的化学方程式_______ 。
(2)已知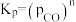 、
、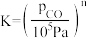 (n是
(n是 的化学计量系数)。反应、Ⅱ的
的化学计量系数)。反应、Ⅱ的 与温度的关系曲线见图1。
与温度的关系曲线见图1。 在
在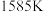 的
的
_______ 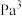 。
。
②保持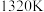 不变,假定恒容容器中只发生反应I,达到平衡时
不变,假定恒容容器中只发生反应I,达到平衡时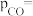
_______  ,若将容器体积压缩到原来的
,若将容器体积压缩到原来的 ,重新建立平衡后
,重新建立平衡后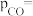
_______  。
。
(3)恒压容器中,焦炭与 的物质的量之比为
的物质的量之比为 ,
, 为载气。
为载气。 和
和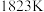 下,
下,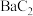 产率随时间的关系曲线依实验数据拟合得到图2(不考虑接触面积的影响)。
产率随时间的关系曲线依实验数据拟合得到图2(不考虑接触面积的影响)。 ,缓慢加热至
,缓慢加热至 时,实验表明
时,实验表明 已全部消耗,此时反应体系中含
已全部消耗,此时反应体系中含 物种为
物种为_______ 。
②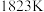 下,反应速率的变化特点为
下,反应速率的变化特点为_______ ,其原因是_______ 。
 和焦炭为原料,经反应I、Ⅱ得到
和焦炭为原料,经反应I、Ⅱ得到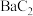 ,再制备乙炔是我国科研人员提出的绿色环保新路线。
,再制备乙炔是我国科研人员提出的绿色环保新路线。反应I:
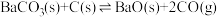
反应Ⅱ:
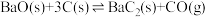
回答下列问题:
(1)写出
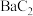 与水反应的化学方程式
与水反应的化学方程式(2)已知
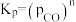 、
、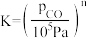 (n是
(n是 的化学计量系数)。反应、Ⅱ的
的化学计量系数)。反应、Ⅱ的 与温度的关系曲线见图1。
与温度的关系曲线见图1。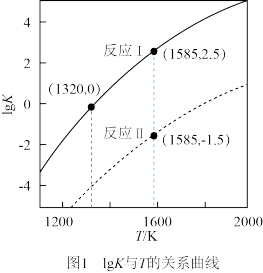
 在
在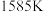 的
的
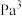 。
。②保持
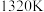 不变,假定恒容容器中只发生反应I,达到平衡时
不变,假定恒容容器中只发生反应I,达到平衡时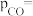
 ,若将容器体积压缩到原来的
,若将容器体积压缩到原来的 ,重新建立平衡后
,重新建立平衡后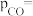
 。
。(3)恒压容器中,焦炭与
 的物质的量之比为
的物质的量之比为 ,
, 为载气。
为载气。 和
和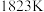 下,
下,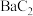 产率随时间的关系曲线依实验数据拟合得到图2(不考虑接触面积的影响)。
产率随时间的关系曲线依实验数据拟合得到图2(不考虑接触面积的影响)。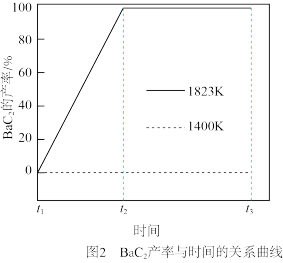
 ,缓慢加热至
,缓慢加热至 时,实验表明
时,实验表明 已全部消耗,此时反应体系中含
已全部消耗,此时反应体系中含 物种为
物种为②
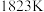 下,反应速率的变化特点为
下,反应速率的变化特点为
您最近一年使用:0次
名校
4 . 以富含淀粉或纤维素的农林产品为原料,制备生活中的某些有机物。
(1)葡萄糖的分子式为_______ ,乳酸分子中的官能团的名称为_______ 。
(2)下列说法正确的是_______。
(3)G在一定条件下可转化为F,则该反应的反应类型是_______ 。
(4)久置的M自身会发生聚合反应得到弹性较好的聚合物,请写出该聚合物的结构简式:_______ 。
(5)写出“F→G”、“E+F→M”两个反应的化学方程式(有机物用结构简式表示)
“F→G”:_______
“E+F→M”:_______
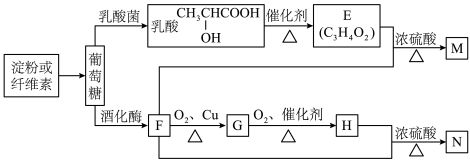
(1)葡萄糖的分子式为
(2)下列说法正确的是_______。
| A.淀粉和纤维素互为同分异构体 |
| B.E和H属于同系物、M和N也属于同系物 |
| C.E、F和G均能使酸性高锰酸钾溶液褪色 |
| D.乳酸、F和H均能与钠、氢氧化钠溶液发生反应 |
(3)G在一定条件下可转化为F,则该反应的反应类型是
(4)久置的M自身会发生聚合反应得到弹性较好的聚合物,请写出该聚合物的结构简式:
(5)写出“F→G”、“E+F→M”两个反应的化学方程式(有机物用结构简式表示)
“F→G”:
“E+F→M”:
您最近一年使用:0次
名校
5 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。
回答下列问题:
(1) 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有_____ (填序号)。
a.金属键 b.离子键 c.配位键 d.氢键
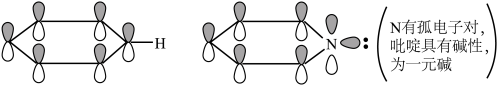
(2)下列关于胍(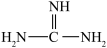 )的说法正确的是
)的说法正确的是________ (填序号)。
a.胍中C的杂化方式与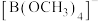 中B的相同
中B的相同
b.与 互为等电子体
互为等电子体
c.有大 键:
键: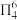
d.为一元碱
(3) 酸性条件下的水解产物是
酸性条件下的水解产物是__________ 和__________ (均写结构简式)。
(4)化合物A(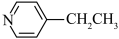 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
①化合物A最多有__________ 个碳原子共平面。
②化合物A的碱性比吡啶__________ (填“强”或“弱”)。
③化合物A的六元环芳香同分异构体有__________ 种。
 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 所有原子共平面。
所有原子共平面。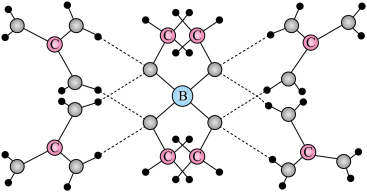
苯( | 吡啶( | |
重原子数 | 6 |
|
价电子数 |
|
|
关系 | 互为等电子体 | |
| ||
共同特点 | 有大 | |
具有芳香性 | ||
(1)
 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有a.金属键 b.离子键 c.配位键 d.氢键
(2)下列关于胍(
 )的说法正确的是
)的说法正确的是a.胍中C的杂化方式与
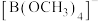 中B的相同
中B的相同b.与
 互为等电子体
互为等电子体c.有大
 键:
键:
d.为一元碱
(3)
 酸性条件下的水解产物是
酸性条件下的水解产物是(4)化合物A(
 )具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。
)具有碱性和芳香性,吡啶类化合物的碱性随N原子电子云密度的增大而增强。①化合物A最多有
②化合物A的碱性比吡啶
③化合物A的六元环芳香同分异构体有
您最近一年使用:0次
名校
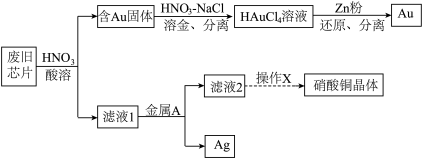
6 . 废旧芯片中常含有大量的单质Si和少量的Au、Ag、Cu等金属。某化学兴趣小组设计了如下图所示方法回收废旧芯片中的Au、Ag并制取硝酸铜晶体[Cu(NO3)2·6H2O]。 。
。
请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:_______ 、_______ 。
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式_______ 。
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式_______ 。
(4)金属A的名称是_______ 。
(5)操作X包括了_______ 过滤、洗涤、晾干。
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比_______ 。
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是_______ 。
 。
。请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式
(4)金属A的名称是
(5)操作X包括了
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO
 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是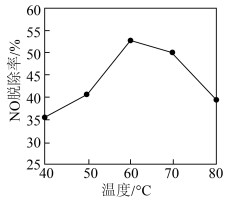
您最近一年使用:0次
名校
7 . 过氧乙酸(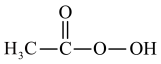 )在卫生医疗、食品消毒及漂白等领域有广泛应用。实验室利用醋酸与双氧水共热,在固体酸的催化下制备过氧乙酸,其装置如下图所示。
)在卫生医疗、食品消毒及漂白等领域有广泛应用。实验室利用醋酸与双氧水共热,在固体酸的催化下制备过氧乙酸,其装置如下图所示。
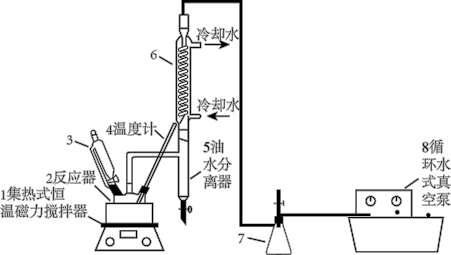
ⅰ.先向仪器2中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
ⅱ.待真空度达到反应要求时,通入冷却水,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水;
ⅲ.从仪器5定期放出水,待反应结束后分离反应器2中的混合物,得到粗产品。
回答下列问题:
(1)仪器2的名称是
(2)分离反应器2中的混合物得到粗产品,分离的方法是
(3)实验中加入乙酸丁酯的主要作用是
(4)过氧乙酸(含
 等)含量的测定:取一定体积的样品
等)含量的测定:取一定体积的样品 ,分成6等份,用过量
,分成6等份,用过量 还原,以
还原,以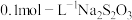 溶液滴定
溶液滴定 (
( ),重复2次,平均消耗量为
),重复2次,平均消耗量为 。再以
。再以 的酸性高锰酸钾溶液滴定样品(滴定过程中
的酸性高锰酸钾溶液滴定样品(滴定过程中 不与过氧乙酸反应),重复2次,平均消耗量为
不与过氧乙酸反应),重复2次,平均消耗量为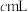 。涉及下列反应:
。涉及下列反应:ⅰ.

ⅱ.
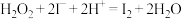
ⅲ.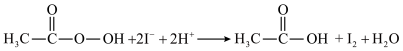
 溶液滴定
溶液滴定 时选用的指示剂是
时选用的指示剂是②用
 的酸性高锰酸钾溶液滴定样品,标志滴定终点的现象是
的酸性高锰酸钾溶液滴定样品,标志滴定终点的现象是③样品中的过氧乙酸的浓度为
 。(用含
。(用含 、
、 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
8 . 某学习小组为探究Mg与酸、碱、盐溶液的反应。完成如下实验:
回答下列问题:
(1)实验前除去镁表面氧化物的方法是______ 。
(2)实验Ⅰ的离子方程式为____________ 。
(3)经实验分析,实验Ⅲ中产生的气体为 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是____________ 。
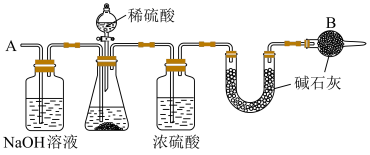
(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为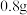 。
。____________ 。
②固体充分高温灼烧后,需要放在______ (填仪器名称)中冷却后才能称量。称量时______ (选填“是”“不是”)采用托盘天平称量。
(5)依据以上分析,实验Ⅲ中发生反应的方程式为____________ 。通过以上实验得出结论: 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
编号 | 操作 | 现象 |
Ⅰ | 将镁条放入 | 迅速放出大量气体,试管壁发热 |
Ⅱ | 将镁条放入pH为 | 无明显现象 |
Ⅲ | 将镁条放入pH为 | 放出气体,溶液中有白色沉淀生成 |
(1)实验前除去镁表面氧化物的方法是
(2)实验Ⅰ的离子方程式为
(3)经实验分析,实验Ⅲ中产生的气体为
 和
和 混合气体。产生
混合气体。产生 气体的原因是
气体的原因是(4)该组同学们比较实验Ⅱ、Ⅲ后,分析认为:实验Ⅲ能快速反应的原因,与溶液中白色沉淀有关。为探究其成分,设计了如下实验。
取出镁条,将沉淀过滤、洗涤、低温烘干,得到纯净固体
 。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在
。将一半固体放入锥形瓶中,按如图连接好装置。滴加稀硫酸到无气体放出为止,在 处通入足量空气。最后称量
处通入足量空气。最后称量 形管增重
形管增重 。将另一半固体高温灼烧,最后剩余固体氧化物为
。将另一半固体高温灼烧,最后剩余固体氧化物为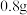 。
。
②固体充分高温灼烧后,需要放在
(5)依据以上分析,实验Ⅲ中发生反应的方程式为
 置换氢气与
置换氢气与 、温度、
、温度、 与溶液接触面积有关,在
与溶液接触面积有关,在 溶液中,生成的沉淀能破坏
溶液中,生成的沉淀能破坏 表面覆盖的
表面覆盖的 ,从而较快进行。
,从而较快进行。
您最近一年使用:0次
名校
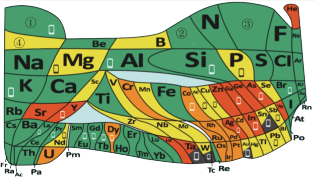
9 . 化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 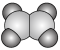 b.
b.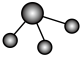 c.
c. 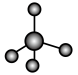 d.
d.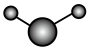
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
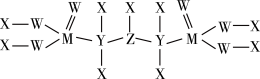
 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与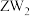 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
名校
10 . 请回答下列问题:
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
①制作冷敷袋常利用吸热的化学变化来实现,以下组合最能满足的是___________ 。(填字母)
A.冰 B.硝酸铵+水 C.硝酸铵+水合碳酸钠
②下列过程中的热量变化与冰袋一致的有___________ 。(填字母)
a. b.盐酸和镁条
b.盐酸和镁条
c.盐酸和碳酸氢钠 d. 和氯化铵
和氯化铵
e. 分解
分解
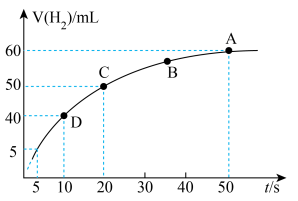
③某课外实验小组利用压强传感器、温度传感器、数据采集器和计算机等数字化实验设备,探究镁与一定量盐酸的反应速率,测得产生 的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为___________ ;在20s内用H+浓度表示的平均反应速率
___________ (20s时溶液体积为50mL,气体摩尔体积为25L/mol)。 ,是一个常见的放热反应。回答下列问题。
,是一个常见的放热反应。回答下列问题。
t℃时,向填充有催化剂、体积为2L的刚性容器中充入一定量的 和
和 合成氨,实验中测得
合成氨,实验中测得 随时间的变化如表所示:
随时间的变化如表所示:
①4-6min内 的平均反应速率
的平均反应速率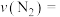
___________ 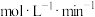
②下列情况能说明反应达到平衡状态的是___________ (填标号)。
A.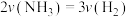 B.混合气体的平均相对分子质量不再变化
B.混合气体的平均相对分子质量不再变化
C. 体积分数不再变化 D.混合气体的密度保持不变
体积分数不再变化 D.混合气体的密度保持不变
③如表列出了在不同温度和压强下,反应达到平衡时 的百分含量
的百分含量 。
。
从表中数据得出,合成氨最优的条件是___________ 。
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
①制作冷敷袋常利用吸热的化学变化来实现,以下组合最能满足的是
A.冰 B.硝酸铵+水 C.硝酸铵+水合碳酸钠
②下列过程中的热量变化与冰袋一致的有
a.
 b.盐酸和镁条
b.盐酸和镁条c.盐酸和碳酸氢钠 d.
 和氯化铵
和氯化铵e.
 分解
分解③某课外实验小组利用压强传感器、温度传感器、数据采集器和计算机等数字化实验设备,探究镁与一定量盐酸的反应速率,测得产生
 的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
 ,是一个常见的放热反应。回答下列问题。
,是一个常见的放热反应。回答下列问题。t℃时,向填充有催化剂、体积为2L的刚性容器中充入一定量的
 和
和 合成氨,实验中测得
合成氨,实验中测得 随时间的变化如表所示:
随时间的变化如表所示:①4-6min内
 的平均反应速率
的平均反应速率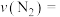
| 时间/min | 2 | 4 | 6 | 8 | 10 | 12 |
 / / | 0.04 | 0.10 | 0.14 | 0.16 | 0.16 | 0.16 |
A.
 B.混合气体的平均相对分子质量不再变化
B.混合气体的平均相对分子质量不再变化C.
 体积分数不再变化 D.混合气体的密度保持不变
体积分数不再变化 D.混合气体的密度保持不变③如表列出了在不同温度和压强下,反应达到平衡时
 的百分含量
的百分含量 。
。压强/MPa % %温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.5 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
您最近一年使用:0次


 )
)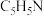 )
)
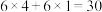


 (
( ,其中
,其中 为形成大
为形成大 稀硫酸中
稀硫酸中 的
的 溶液中
溶液中

