名校
1 . 依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
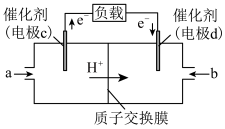
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次
2 . 以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。其主要工艺流程如图所示:

已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
(1)已知CuFeS2中金属元素均为+2价,则S元素的价态为_____ ,在反应Ⅰ中通入O2的主要目的是将Fe2+氧化成Fe3+,写出O2将Fe2+氧化成Fe3+的离子方程式_____ 。
(2)反应Ⅱ中加入的试剂a为CuO固体,其目的是消耗溶液中的H+,使溶液的pH升高到某一数值m,试根据上述表格中提供的相关数据,推导m的取值范围_____ (用“<”或“≤”表示)。
(3)反应Ⅳ中加入的试剂c为_____ (填写试剂名称)。
(4)反应Ⅲ、Ⅴ中加入的试剂b为铁粉,其目的分别为_____ 。
(5)操作X的名称为_____ ,如何检验“滤液”中是否存在Fe3+_____ 。

已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)反应Ⅱ中加入的试剂a为CuO固体,其目的是消耗溶液中的H+,使溶液的pH升高到某一数值m,试根据上述表格中提供的相关数据,推导m的取值范围
(3)反应Ⅳ中加入的试剂c为
(4)反应Ⅲ、Ⅴ中加入的试剂b为铁粉,其目的分别为
(5)操作X的名称为
您最近一年使用:0次
名校
3 . A~I是常见有机物,其中A是乙烯,E的分子式为C4H8O2,H为有香味的油状物质。
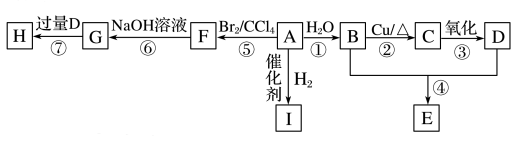
已知:BrCH2CH2Br+2NaOH HOCH2CH2OH+2NaBr
HOCH2CH2OH+2NaBr
(1)B的分子式为_____ ,F的名称为_____ ,C中官能团的名称为_____ ,过程①的反应类型为_____ 。
(2)写出下列反应的化学方程式:过程②_____ ,过程⑦_____ 。
(3)等质量的A、I完全燃烧,消耗O2的量更大的是_____ (写结构简式)。
(4)I的某同系物中有6个C原子,则其同分异构体有_____ 种。

已知:BrCH2CH2Br+2NaOH
 HOCH2CH2OH+2NaBr
HOCH2CH2OH+2NaBr(1)B的分子式为
(2)写出下列反应的化学方程式:过程②
(3)等质量的A、I完全燃烧,消耗O2的量更大的是
(4)I的某同系物中有6个C原子,则其同分异构体有
您最近一年使用:0次
2023-05-06更新
|
768次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题
名校
解题方法
4 . 将CO2与H2反应转化为甲醇(CH3OH)是变废为宝的好方法,其原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。

(1)在0~3min内用CO2表示该反应的速率是_____ 。(保留2位有效数字)。该反应达到最大限度时H2的转化率_____ ,此时CH3OH在平衡混合物中的体积分数为_____ (均用百分数表示,且保留3位有效数字)。
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是_____ 。
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是_____ 。
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:
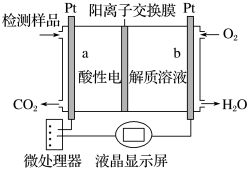
a电极发生的电极反应式为_____ 。
 CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
(1)在0~3min内用CO2表示该反应的速率是
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:

a电极发生的电极反应式为
您最近一年使用:0次
2023-05-06更新
|
248次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题
名校
5 . 浓硫酸有多种化学性质,如吸水性、脱水性、强氧化性、酸性等。
Ⅰ.甲同学用浓硫酸与木炭的反应探究浓硫酸的强氧化性。已知在加热条件下浓硫酸与木炭可发生化学反应,为了检验反应的产物,某同学用以下装置进行试验。请据此回答下列问题:
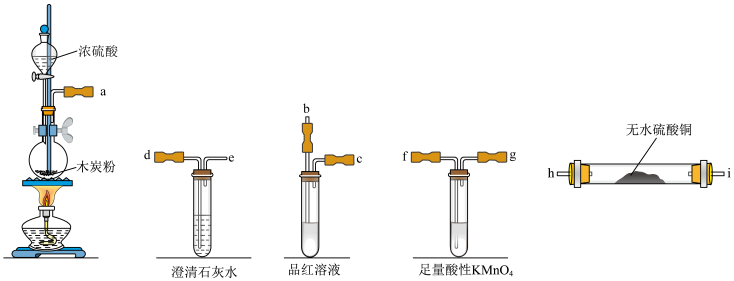
(1)为了完成实验,请将装置的接口按顺序连接(气流方向从左到右):______ 。
(2)实验过程中发现无水硫酸铜固体变为蓝色,品红溶液褪色,由此可知有水和SO2生成,利用氧化还原反应的规律推测还应该有CO2生成,证明有CO2气体生成的实验现象是______ 。
(3)依据上面的结论,写出木炭与浓硫酸反应的化学方程式______ 。
Ⅱ.乙同学用A制备SO2,并进一步制备抗氧化剂Na2S2O5,实验前已除尽装置内的空气。
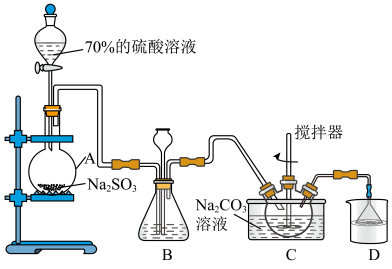
(4)制取二氧化硫选用70%浓硫酸,体现了硫酸的______ 性。
(5)装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用______ 。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
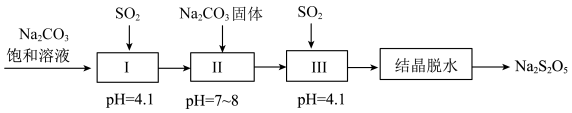
(6)如图流程为焦亚硫酸钠(Na2S2O5)的制备。若步骤Ⅰ中通入足量的SO2,则该步骤反应的离子方程式为_____ 。
Ⅰ.甲同学用浓硫酸与木炭的反应探究浓硫酸的强氧化性。已知在加热条件下浓硫酸与木炭可发生化学反应,为了检验反应的产物,某同学用以下装置进行试验。请据此回答下列问题:

(1)为了完成实验,请将装置的接口按顺序连接(气流方向从左到右):
(2)实验过程中发现无水硫酸铜固体变为蓝色,品红溶液褪色,由此可知有水和SO2生成,利用氧化还原反应的规律推测还应该有CO2生成,证明有CO2气体生成的实验现象是
(3)依据上面的结论,写出木炭与浓硫酸反应的化学方程式
Ⅱ.乙同学用A制备SO2,并进一步制备抗氧化剂Na2S2O5,实验前已除尽装置内的空气。

(4)制取二氧化硫选用70%浓硫酸,体现了硫酸的
(5)装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(6)如图流程为焦亚硫酸钠(Na2S2O5)的制备。若步骤Ⅰ中通入足量的SO2,则该步骤反应的离子方程式为

您最近一年使用:0次
名校
解题方法
6 . 几种主族元素在周期表中的位置如下
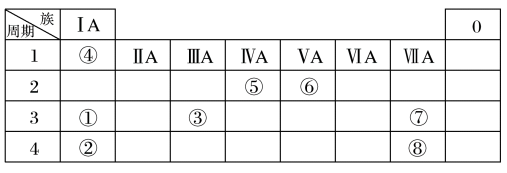
根据上表回答下列问题:
(1)⑥元素的最简单气态氢化物的电子式是_______ 。
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_______ ,该元素在周期表中的位置是_______ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式),①与水反应的化学方程式为_______ 。
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:_______ 。
下列表述中能证明这一事实的是_______ (填字母,下同)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
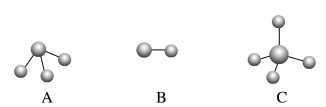
(6)④与⑤元素形成的分子可能是_______ 。

根据上表回答下列问题:
(1)⑥元素的最简单气态氢化物的电子式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:
下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(6)④与⑤元素形成的分子可能是

您最近一年使用:0次
7 . 回答下列问题:
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示:
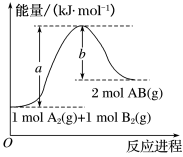
①该反应的ΔH_______ 0(填“大于”“小于”或“等于”)。
②反应物的总键能为_______ 。
③写出该反应的热化学方程式_______ 。
(2)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ·mol-1
上述反应热效应之间的关系式为ΔH4=_______ ,联氨和N2O4可作为火箭推进剂的主要原因为_______ 。(至少答两条)
合成氨工业在工农业生产、生活中有着重要作用。反应原理为3H2(g)+N2(g)⇌2NH3(g) ΔH<0。
(3)在T℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是_______ (填序号)。
a.容器内的压强不再随时间变化 b.3v(N2)=v(H2)
c.3v正(H2)=2v逆(NH3) d.混合气体的密度保持不变
②上述反应达到平衡后,其他条件不变,升高温度,v逆_______ (填“增大”“不变”或“减小”),v正和v逆的关系为v正_______ v逆(填“>”“=”或“<”),最后二者相等。
(4)在T℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是_______ 。

a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示:

①该反应的ΔH
②反应物的总键能为
③写出该反应的热化学方程式
(2)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ·mol-1
上述反应热效应之间的关系式为ΔH4=
合成氨工业在工农业生产、生活中有着重要作用。反应原理为3H2(g)+N2(g)⇌2NH3(g) ΔH<0。
(3)在T℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是
a.容器内的压强不再随时间变化 b.3v(N2)=v(H2)
c.3v正(H2)=2v逆(NH3) d.混合气体的密度保持不变
②上述反应达到平衡后,其他条件不变,升高温度,v逆
(4)在T℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是

a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
您最近一年使用:0次
8 . 某实验小组为探究钠与CO2的反应,设计如下装置。请回答下列问题:
I.实验室用大理石与稀盐酸反应制备CO2
(1)应选用下列装置中的_______ (填序号),乙装置中仪器A的名称是_______
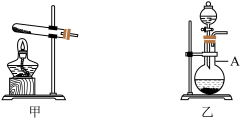
II.钠与CO2反应
查阅资料:i.氯化钯溶液与CO反应产生黑色沉淀。
ii.钠与CO2发生反应可能有三种情况:
①4Na+3CO2 2Na2CO3+C;②4Na+CO2
2Na2CO3+C;②4Na+CO2 2Na2O+C;②2Na+2CO2
2Na2O+C;②2Na+2CO2 Na2CO3+CO
Na2CO3+CO
(2)图中按气流由左至右的顺序,导管口连接顺序为CO2混合气体→_______ (填接口字母)。

(3)装置丁中饱和NaHCO3溶液的作用是_______ (用离子方程式表示)。
(4)点燃装置甲中酒精灯之前,需要通一段时间CO2气体,其目的是_______ 。
(5)若装置乙中PdCl2溶液中没有黑色沉淀产生,说明上述反应_______ (填“①”、“②”或“③”)不可能发生。
(6)为了验证装置甲中钠与CO2反应的产物,设计如下实验步骤(假设金属钠反应完全),请填写下列表格。
I.实验室用大理石与稀盐酸反应制备CO2
(1)应选用下列装置中的
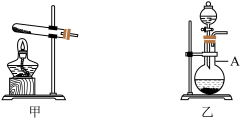
II.钠与CO2反应
查阅资料:i.氯化钯溶液与CO反应产生黑色沉淀。
ii.钠与CO2发生反应可能有三种情况:
①4Na+3CO2
 2Na2CO3+C;②4Na+CO2
2Na2CO3+C;②4Na+CO2 2Na2O+C;②2Na+2CO2
2Na2O+C;②2Na+2CO2 Na2CO3+CO
Na2CO3+CO(2)图中按气流由左至右的顺序,导管口连接顺序为CO2混合气体→

(3)装置丁中饱和NaHCO3溶液的作用是
(4)点燃装置甲中酒精灯之前,需要通一段时间CO2气体,其目的是
(5)若装置乙中PdCl2溶液中没有黑色沉淀产生,说明上述反应
(6)为了验证装置甲中钠与CO2反应的产物,设计如下实验步骤(假设金属钠反应完全),请填写下列表格。
| 实验步骤 | 实验操作及现象 | 实验结论 |
| ① | 取一定量装置甲中反应后的固体溶于足量水中,有黑色不溶固体,过滤 | 说明固体中含有碳 |
| ② | 说明固体中含有Na2CO3 | |
| ③ | 说明固体中含有Na2O |
您最近一年使用:0次
2022-12-27更新
|
310次组卷
|
2卷引用:湖北省武汉市第三中学2021-2022学年高一上学期10月月考化学试题
9 . Ⅰ.用覆铜板制作印刷电路板时,常用FeCl3溶液作腐蚀液。某兴趣小组在实验室进行了模拟。
(模拟实验Ⅰ)
向盛有4mL 0.2mol/L FeCl3溶液的试管中,加入一块铜片(Cu过量),反应一段时间后,溶液黄色褪去。
(分析解释)
(1)FeCl3与Cu反应的离子方程式是_______ 。
(2)为检验反应生成的Fe2+,最宜选择的试剂是_______ (填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液
(继续实验Ⅱ)
为验证上述实验中Fe3+是否完全反应,该小组同学取上层清液于另一支试管中,滴入3滴0.1mol/L KSCN溶液。结果发现,上层清液中立即产生白色沉淀,同时滴入处局部出现红色,振荡后红色立即消失。
(查阅资料)
为解释该异常现象产生的原因,同学们查阅资料得知:
①2CuCl2+4KSCN=2CuSCN↓+(SCN)2+4KCl
②CuSCN为白色固体,几乎不溶于水;
③(SCN)2与Cl2的性质相似。
(继续实验Ⅲ)
(分析解释)
(3)实验Ⅱ中白色沉淀的成分是_______ (填化学式)。
(4)请结合资料,用离子方程式解释实验Ⅱ中“滴入KSCN溶液处局部出现红色”的原因_______ 。
Ⅱ.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O +2H2O。请回答下列问题:
+2H2O。请回答下列问题:
(5)水热法制备Fe3O4纳米颗粒的反应中,被氧化的元素为_______ (填元素符号)。
(6)该反应的化学方程式中,x=_______ 。
(7)每生成1mol Fe3O4,反应转移的电子为_______ mol。
(模拟实验Ⅰ)
向盛有4mL 0.2mol/L FeCl3溶液的试管中,加入一块铜片(Cu过量),反应一段时间后,溶液黄色褪去。
(分析解释)
(1)FeCl3与Cu反应的离子方程式是
(2)为检验反应生成的Fe2+,最宜选择的试剂是
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液
(继续实验Ⅱ)
为验证上述实验中Fe3+是否完全反应,该小组同学取上层清液于另一支试管中,滴入3滴0.1mol/L KSCN溶液。结果发现,上层清液中立即产生白色沉淀,同时滴入处局部出现红色,振荡后红色立即消失。
(查阅资料)
为解释该异常现象产生的原因,同学们查阅资料得知:
①2CuCl2+4KSCN=2CuSCN↓+(SCN)2+4KCl
②CuSCN为白色固体,几乎不溶于水;
③(SCN)2与Cl2的性质相似。
(继续实验Ⅲ)
| 实验方案 | 现象 | |
| 步骤Ⅰ | 取4mL 0.2mol/L FeCl2溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 步骤Ⅱ | 取4mL 0.2mol/L CuCl2溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 |
(3)实验Ⅱ中白色沉淀的成分是
(4)请结合资料,用离子方程式解释实验Ⅱ中“滴入KSCN溶液处局部出现红色”的原因
Ⅱ.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O
 +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O +2H2O。请回答下列问题:
+2H2O。请回答下列问题:(5)水热法制备Fe3O4纳米颗粒的反应中,被氧化的元素为
(6)该反应的化学方程式中,x=
(7)每生成1mol Fe3O4,反应转移的电子为
您最近一年使用:0次
名校
解题方法
10 . 已知有以下物质相互转化,其中A为常见金属,C为碱。
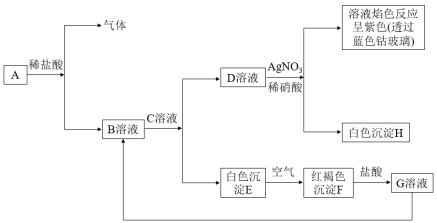
(1)写出E的化学式_______ ,H的化学式_______ 。
(2)①写出由E转变为F的化学方程式:_______ ,②检验G中阳离子的试剂_______ (写名称);并写出该反应的离子方程式:_______ 。
(3)写出向G溶液加入A的有关离子方程式:_______ 。
(4)写出A在一定条件下与水反应的化学方程式:_______ 。
(5)高铁酸钠(Na2FeO4)是一种新型、高效、多功能绿色水处理剂,制备反应为_______Fe(OH)3+_______NaClO+_______NaOH=_______Na2FeO4+_______NaCl+_______ 。请在
。请在 中填上适当的物质,并配平方程式
中填上适当的物质,并配平方程式_______ 。

(1)写出E的化学式
(2)①写出由E转变为F的化学方程式:
(3)写出向G溶液加入A的有关离子方程式:
(4)写出A在一定条件下与水反应的化学方程式:
(5)高铁酸钠(Na2FeO4)是一种新型、高效、多功能绿色水处理剂,制备反应为_______Fe(OH)3+_______NaClO+_______NaOH=_______Na2FeO4+_______NaCl+_______
 。请在
。请在 中填上适当的物质,并配平方程式
中填上适当的物质,并配平方程式
您最近一年使用:0次



