1 . 下图是部分短周期元素的常见化合价与原子序数的关系图: 在周期表中的位置是
在周期表中的位置是______________________ 。
(2)用电子式表示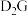 的形成过程为
的形成过程为_________________ 。
(3)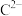 ,
,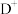 ,
,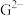 离子半径由大到小的顺序是
离子半径由大到小的顺序是______ (用离子符号表示)。
(4)某同学利用上图装置设计实验证明 ,
, ,
, 的非金属性强弱关系(已知硅酸难溶于水)。
的非金属性强弱关系(已知硅酸难溶于水)。______ (填化学式);溶液ⅲ为______ (填选项字母)。
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硅酸钠溶液
②装置丙中发生反应的离子方程式为_______________ 。
(5)将 投入
投入 的最高价氧化物对应的水化物中,其离子方程式为
的最高价氧化物对应的水化物中,其离子方程式为____________ 。

 在周期表中的位置是
在周期表中的位置是(2)用电子式表示
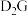 的形成过程为
的形成过程为(3)
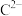 ,
,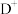 ,
,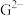 离子半径由大到小的顺序是
离子半径由大到小的顺序是(4)某同学利用上图装置设计实验证明
 ,
, ,
, 的非金属性强弱关系(已知硅酸难溶于水)。
的非金属性强弱关系(已知硅酸难溶于水)。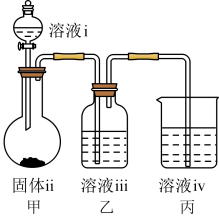
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硅酸钠溶液
②装置丙中发生反应的离子方程式为
(5)将
 投入
投入 的最高价氧化物对应的水化物中,其离子方程式为
的最高价氧化物对应的水化物中,其离子方程式为
您最近一年使用:0次
解题方法
2 . 某溶液呈酸性,可能含有: 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:
Ⅰ.取少量溶液,向其中加入过量 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。
Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。
(1)上述6种离子中,该溶液肯定存在的为____________ ,肯定不存在 的为______ ,不能 确定是否存在的为______ 。
(2)请设计实验检验原溶液中是否存在 ,写出操作方法、现象及结论
,写出操作方法、现象及结论___________ 。
(3)生成无色气体 的离子方程式为
的离子方程式为____________ 。
(4)步骤Ⅱ中发生反应的离子方程式为___________________ 。
 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:Ⅰ.取少量溶液,向其中加入过量
 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓
 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。(1)上述6种离子中,该溶液肯定存在的为
(2)请设计实验检验原溶液中是否存在
 ,写出操作方法、现象及结论
,写出操作方法、现象及结论(3)生成无色气体
 的离子方程式为
的离子方程式为(4)步骤Ⅱ中发生反应的离子方程式为
您最近一年使用:0次
名校
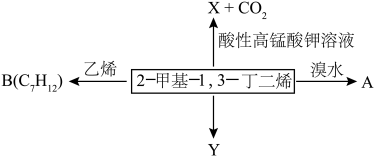
3 . 2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。已知:
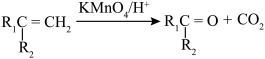
(1)2-甲基-1,3-丁二烯可以与氢气、溴水等发生加成反应。
①完全与氢气加成所得有机产物的名称____________ ;
②与溴水发生1,2-加成所得有机产物的结构简式为____________ 和_____________ ;
③与溴水发生1,4-加成反应的化学方程式为________________ 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________ 。
(3)Y(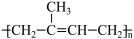 )是天然橡胶的主要成分。能发生的反应有
)是天然橡胶的主要成分。能发生的反应有_________ (填标号)。
A.加成反应 B.氧化反应 C.脱水反应
(4)某烃Z的相对分子质量为70,其分子式为_______________ ;Z的同分异构体(考虑顺反异构)有_______ 种。

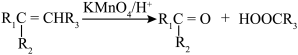

(1)2-甲基-1,3-丁二烯可以与氢气、溴水等发生加成反应。
①完全与氢气加成所得有机产物的名称
②与溴水发生1,2-加成所得有机产物的结构简式为
③与溴水发生1,4-加成反应的化学方程式为
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
(3)Y(
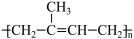 )是天然橡胶的主要成分。能发生的反应有
)是天然橡胶的主要成分。能发生的反应有A.加成反应 B.氧化反应 C.脱水反应
(4)某烃Z的相对分子质量为70,其分子式为
您最近一年使用:0次
名校
解题方法
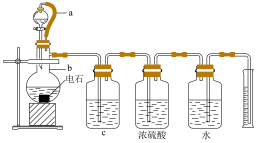
4 . 某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:_________ 。
(2)仪器b中发生反应的化学方程式为_________ ,实验过程中为了减缓水与电石的反应速率,可采取的措施是_________ (写一条即可)。
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①_______ (填“能”或“不能”)说明生成的气体全部为乙炔,原因是______ 。
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是______ (写一条即可)。
(4)为了安全,点燃乙炔前应_______ ,乙炔燃烧时的现象是____________ 。
(5)取mg电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为VmL,则电石中碳化钙的质量分数为______ (用含V和m的代数式表示,忽略导管中残留的水和气体中含有的水蒸气,所有气体均已换算成标准状况下)。
(2)仪器b中发生反应的化学方程式为
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是
(4)为了安全,点燃乙炔前应
(5)取mg电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为VmL,则电石中碳化钙的质量分数为
您最近一年使用:0次
5 . 草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
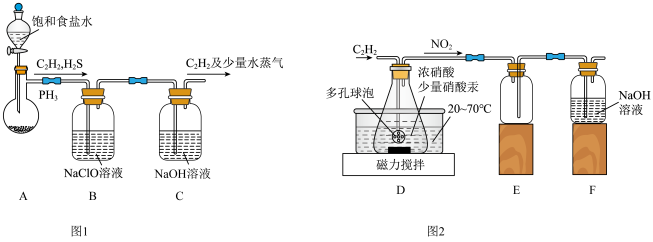
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。___________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为___________ 。该过程中,可能产生新的杂质气体Cl2,其原因是:___________ (用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是___________ 。
②装置D中生成H2C2O4的化学方程式为___________ 。
③从装置D中得到产品,还需经过___________ (填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是___________ 。
②产品中H2C2O4·2H2O的质量分数为___________ (列出含 m、c、V 的表达式)。
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是
②装置D中生成H2C2O4的化学方程式为
③从装置D中得到产品,还需经过
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是
②产品中H2C2O4·2H2O的质量分数为
您最近一年使用:0次
解题方法
6 . 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为___________ 。
(2)A与溴的四氯化碳溶液反应的化学方程式为___________ ,反应类型是___________ 。
(3)已知: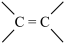

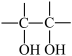 。
。
请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式:___________ 。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式:___________ 。
(5)在一定条件下,由A得到的高分子化合物的结构简式为___________ 。
(6)已知 有10种二氯取代物,则其六氯取代物有___________。
有10种二氯取代物,则其六氯取代物有___________。
(7)下图是立方烷的球棍模型,下列有关说法不正确的是___________。
(1)A的分子式为
(2)A与溴的四氯化碳溶液反应的化学方程式为
(3)已知:
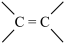

 。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式:
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式:
(5)在一定条件下,由A得到的高分子化合物的结构简式为
(6)已知
 有10种二氯取代物,则其六氯取代物有___________。
有10种二氯取代物,则其六氯取代物有___________。| A.6种 | B.8种 | C.10种 | D.12种 |
(7)下图是立方烷的球棍模型,下列有关说法不正确的是___________。

| A.它的一氯代物只有一种 |
| B.它的二氯代物有两种 |
| C.它的核磁共振氢谱图上只有一种峰 |
| D.它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
您最近一年使用:0次
7 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
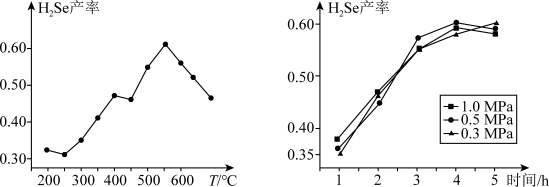
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
8 . 从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78,回答下列问题:
(1)A的电子式为_______ ,B的结构简式为_______ 。
(2)A能使溴的四氯化碳溶液褪色的化学反应方程式为_______ ,反应类型为_______ 。
(3)在碘水中加入B振荡静置后的现象是_______ 。
(4)B与浓硫酸和浓硝酸在 反应的化学反应方程式为
反应的化学反应方程式为______ ,反应类型为______ 。
(1)A的电子式为
(2)A能使溴的四氯化碳溶液褪色的化学反应方程式为
(3)在碘水中加入B振荡静置后的现象是
(4)B与浓硫酸和浓硝酸在
 反应的化学反应方程式为
反应的化学反应方程式为
您最近一年使用:0次
9 . 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(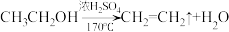 ),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:
),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)甲同学设计的实验___  填“能”或“不能”
填“能”或“不能” 验证乙烯与溴水发生了加成反应,其理由是
验证乙烯与溴水发生了加成反应,其理由是____  填字母
填字母 。
。
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯 D.使溴水褪色的物质,就是乙烯
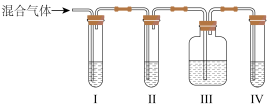
(2)乙同学推测此乙烯中必定含有一种杂质气体是_______ ,它与溴水反应的化学方程式是_______ ,在验证过程中必须全部除去。为此乙同学设计了如图所示的实验装置:_______ Ⅱ_______ Ⅲ_______ Ⅳ_______  选填序号
选填序号 。
。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液。
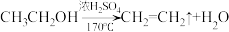 ),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:
),生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。请回答下列问题:(1)甲同学设计的实验
 填“能”或“不能”
填“能”或“不能” 验证乙烯与溴水发生了加成反应,其理由是
验证乙烯与溴水发生了加成反应,其理由是 填字母
填字母 。
。A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯 D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是
 选填序号
选填序号 。
。A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液。
您最近一年使用:0次
解题方法
10 . A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出)。_______ ;物质E的结构式为_______ ;反应①的化学方程式为_______ 。
(2)若A是常见的金属单质,D是气态非金属单质,F是液态非金属单质,反应①、②都在溶液中进行,写出A所含元素在周期表中的位置:____ ;物质C与等物质的量的Cl2在溶液中反应的离子方程式为_____ 。
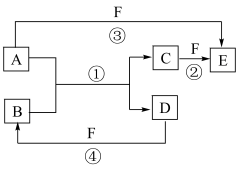
(2)若A是常见的金属单质,D是气态非金属单质,F是液态非金属单质,反应①、②都在溶液中进行,写出A所含元素在周期表中的位置:
您最近一年使用:0次



