名校
1 . 某同学用 与浓盐酸反应制备纯净的
与浓盐酸反应制备纯净的 的装置如图所示。回答下列问题:
的装置如图所示。回答下列问题:
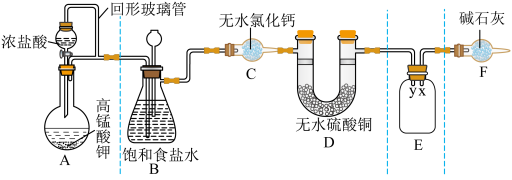
已知:
(1)装置A中盛放浓盐酸的仪器名称是
(2)E装置中导管(填“x”或“y”)
(3)装置F的作用有两个:一是
请写出氯气与碱石灰反应的化学方程式
(4)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH(即
三种微粒的物质的量分数随pH(即 )变化的关系如图所示。
)变化的关系如图所示。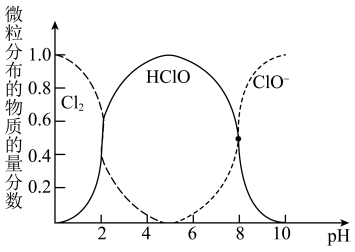
回答问题:①使用84消毒液时为增强消毒效果常调节4<pH<6,原因是
②通常购买的84消毒液pH在12左右,为增强消毒效果可向其中滴加
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(5)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为 ,计算此时所得溶液中NaClO的质量分数为
,计算此时所得溶液中NaClO的质量分数为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
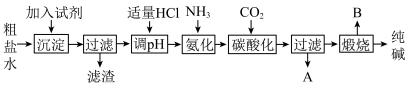
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
名校
3 . 硫的氧化物的排放是形成硫酸型酸雨的主要原因,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH +Ca2++2OH-+SO
+Ca2++2OH-+SO ⇌CaSO3↓+2NH3•H2O。
⇌CaSO3↓+2NH3•H2O。
(1)已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=________ (用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:
i.2CO(g)+SO2(g)⇌S(l)+2CO2(g)ΔH1═-37.0kJ•mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g)ΔH2=+45.4kJ•mol-1
(2)CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为________ 。
(3)在一定压强下,发生反应ii。平衡时,SO2的转化率α(SO2)与原料气投料比[ ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。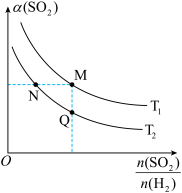 ①H2的转化率α(H2):M
①H2的转化率α(H2):M______ N(填“>”“<”或“=”)。
②逆反应速率:Q______ M(填“>”“<”或“=”)。
(4)T℃,向2L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①其他条件不变,6min时缩小容器容积,α(H2)________ (填“增大”“减小”或“不变)。
②该温度下,反应ii的平衡常数K=________ 。
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH
 +Ca2++2OH-+SO
+Ca2++2OH-+SO ⇌CaSO3↓+2NH3•H2O。
⇌CaSO3↓+2NH3•H2O。(1)已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=
Ⅱ.水煤气还原法
已知:
i.2CO(g)+SO2(g)⇌S(l)+2CO2(g)ΔH1═-37.0kJ•mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g)ΔH2=+45.4kJ•mol-1
(2)CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为
(3)在一定压强下,发生反应ii。平衡时,SO2的转化率α(SO2)与原料气投料比[
 ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。 ①H2的转化率α(H2):M
①H2的转化率α(H2):M②逆反应速率:Q
(4)T℃,向2L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应i和反应ii。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。
①其他条件不变,6min时缩小容器容积,α(H2)
②该温度下,反应ii的平衡常数K=
您最近一年使用:0次
名校
解题方法
4 . NiCl2是一种重要催化剂。某科研小组以废弃催化剂含Ni2+、Cu2+、Fe3+、Ca2+、Mg2+等)为原料,按下列流程回收NiCl2:6H2O晶体,回答下列问题。

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的主要成分是S和_________ (写化学式),生成S的离子方程式为_____ 。
(2)若用H2O2代替Cl2,试剂Y的使用量会减少,原因是________ 。
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度<10-5mol/L),滤液3中F—的浓度不小___ mol/L。
(4)操作A为______ 、过滤、洗涤、干燥。
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂将所得NiCl2•6H2O与SOCl2混合加热可制备无水NiCl2,反应的化学方程式为____ 。

已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的主要成分是S和
(2)若用H2O2代替Cl2,试剂Y的使用量会减少,原因是
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度<10-5mol/L),滤液3中F—的浓度不小
(4)操作A为
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂将所得NiCl2•6H2O与SOCl2混合加热可制备无水NiCl2,反应的化学方程式为
您最近一年使用:0次
名校
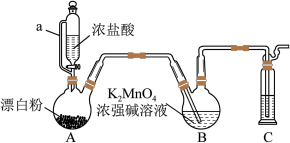
5 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO +2H2O═2MnO
+2H2O═2MnO +MnO2↓+4OH-
+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是_________ 装置C中的试剂为_________ ;装置A中制备Cl2的化学方程式为_________ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是_________ 。
(3)高锰酸钾还可以用电解法制备:
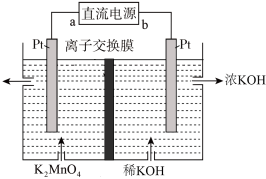
①电解时阳极的电极反应式是_________ 。
②该装置中的离子交换膜是_________ 离子交换膜(填“阴”或“阳”)。
(4)某化学学习小组测定某草酸溶液的浓度,并用所测草酸溶液测定某样品中高锰酸钾的纯度(已知:杂质不参与反应;KMnO4的摩尔质量为158g/mol),进行了如下实验:
步骤i.配制0.1000mol/L的标准氢氧化钠溶液;
步骤ii.取草酸溶液10.00mL,用0.1000mol/L的标准氢氧化钠溶液滴定,结果用去氢氧化钠溶液20.00mL;
步骤iii.取1.0g样品溶于水,滴入几滴稀硫酸酸化,用测定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液50.00mL。
①步骤ii中应选择_________ 作指示剂。
②样品中高锰酸钾的纯度为_________ 。
③本实验中,若第一次滴定时盛装氢氧化钠溶液的滴定管未润洗,会测得高锰酸钾纯度_________ (填“偏大”、“偏小”或“无影响”)。

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO
 +2H2O═2MnO
+2H2O═2MnO +MnO2↓+4OH-
+MnO2↓+4OH-回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是
(3)高锰酸钾还可以用电解法制备:

①电解时阳极的电极反应式是
②该装置中的离子交换膜是
(4)某化学学习小组测定某草酸溶液的浓度,并用所测草酸溶液测定某样品中高锰酸钾的纯度(已知:杂质不参与反应;KMnO4的摩尔质量为158g/mol),进行了如下实验:
步骤i.配制0.1000mol/L的标准氢氧化钠溶液;
步骤ii.取草酸溶液10.00mL,用0.1000mol/L的标准氢氧化钠溶液滴定,结果用去氢氧化钠溶液20.00mL;
步骤iii.取1.0g样品溶于水,滴入几滴稀硫酸酸化,用测定的草酸溶液进行滴定,达到滴定终点消耗草酸溶液50.00mL。
①步骤ii中应选择
②样品中高锰酸钾的纯度为
③本实验中,若第一次滴定时盛装氢氧化钠溶液的滴定管未润洗,会测得高锰酸钾纯度
您最近一年使用:0次
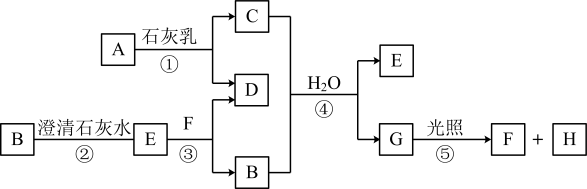
6 . 下图中A~H均为中学化学中常见的物质,A、B、H是气体,A是有刺激性气味的气体,B、H是无色无味气体,它们之间有如下转化关系。(反应中生成的水已略去)
请回答以下问题:
(1)C是___________ ,E是___________ ,G是___________ 。(填化学式)。
(2)C物质在日常生活中可作___________ 剂。
(3)写出反应①的化学方程式:___________ 。写出反应②的化学方程式:___________ 。
(4)写出实验室制取A气体的化学反应方程式:___________

请回答以下问题:
(1)C是
(2)C物质在日常生活中可作
(3)写出反应①的化学方程式:
(4)写出实验室制取A气体的化学反应方程式:
您最近一年使用:0次
解题方法
7 . Ⅰ.某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气并探究其性质。请回答下列问题:
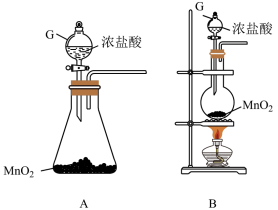

(1)装置G的名称为___________ ;
(2)装置F的作用为___________ ;
(3)从上图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为___________ (用仪器下方字母表示,例如A→B→C)
(4)制备氯气的反应中体现了浓盐酸的___________ 性和___________ 性。
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(5)浓硫酸的作用是___________ ;
(6)证明氯气和水反应的实验现象为___________
(7)漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是___________ 。


(1)装置G的名称为
(2)装置F的作用为
(3)从上图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为
(4)制备氯气的反应中体现了浓盐酸的
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(5)浓硫酸的作用是
(6)证明氯气和水反应的实验现象为
(7)漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是
您最近一年使用:0次
8 . 电解锰工业中会产生大量含铬、锰元素的工业废水。废水处理和铬、锰的回收工艺如下:
Ⅰ.含铬、锰元素工业废水(主要含Cr3+、Mn2+、CrO 和少量有机物)的处理。
和少量有机物)的处理。

已知:①重铬酸是一种酸性较强的无机酸,化学式为H2Cr2O7;
②Ksp(BaCrO4)=1.0×10-9,Ksp(BaSO4)=1.07×10-10,Ksp(CaSO4)=7.1×10-5。
(1)“氧化”过程中需保持溶液呈碱性,则该过程中Cr3+发生反应的离子方程式为_______ 。
(2)H2O2也可用于“氧化”过程,与NaClO相比,缺点为_______ 。
(3)“二级处理”的目的为_______ 。
Ⅱ.铬渣中铬元素的回收。

(4)“转化”过程中发生反应的化学方程式为_______ 。
Ⅲ.锰渣中锰元素的回收。
第一步:将MnO2和固体KOH粉碎,混合均匀,在空气中加热熔化并连续搅拌得到K2MnO4;
第二步:电解K2MnO4浓溶液制备KMnO4,电解装置原理如图所示:

(5)电解过程中以铁网和石墨为电极材料,其中B极的电极材料为_______ ;阳极的电极反应式为_______ 。
Ⅰ.含铬、锰元素工业废水(主要含Cr3+、Mn2+、CrO
 和少量有机物)的处理。
和少量有机物)的处理。
已知:①重铬酸是一种酸性较强的无机酸,化学式为H2Cr2O7;
②Ksp(BaCrO4)=1.0×10-9,Ksp(BaSO4)=1.07×10-10,Ksp(CaSO4)=7.1×10-5。
(1)“氧化”过程中需保持溶液呈碱性,则该过程中Cr3+发生反应的离子方程式为
(2)H2O2也可用于“氧化”过程,与NaClO相比,缺点为
(3)“二级处理”的目的为
Ⅱ.铬渣中铬元素的回收。

(4)“转化”过程中发生反应的化学方程式为
Ⅲ.锰渣中锰元素的回收。
第一步:将MnO2和固体KOH粉碎,混合均匀,在空气中加热熔化并连续搅拌得到K2MnO4;
第二步:电解K2MnO4浓溶液制备KMnO4,电解装置原理如图所示:

(5)电解过程中以铁网和石墨为电极材料,其中B极的电极材料为
您最近一年使用:0次
解题方法
9 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______ 。该反应需要在加压下进行,原因是_______ 。
(2)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_______ 。
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
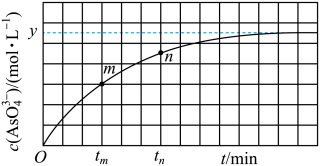
①下列可判断反应达到平衡的是_______ (填标号)。
a.溶液的pH不再变化 b.v(I−)=2v( )
)
c. c( )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1
②tm时v逆_______ tn时v逆(填“大于”“小于”或“等于”),理由是_______ 。
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为_______ 。
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(2)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I−)=2v(
 )
)c. c(
 )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1②tm时v逆
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
10 . B、E、H是生活中常见的有机物,H常用于食品包装,A的产量是石油化工发展水平的标志。根据如图转化关系回答问题:
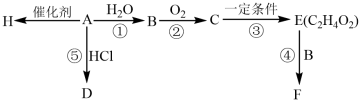
(1)A的官能团名称___________ ,反应④的反应类型___________ 。
(2)写出C和D的结构简式:C___________ ,D___________ 。
(3)请写出:①A→H的化学方程式:___________ ;
②E→F的化学方程式:___________ 。

(1)A的官能团名称
(2)写出C和D的结构简式:C
(3)请写出:①A→H的化学方程式:
②E→F的化学方程式:
您最近一年使用:0次



