1 . 利用相关知识填空。
(1)标准状况下11.2LNH3含___________ 个氨分子,含___________ mol氢原子。
(2)等质量的SO2和SO3物质的量之比是___________ ;所含的氧原子个数之比是___________ 。
(3)4.8gCH4中所含氢原子数与___________ g水所含氢原子数相等。
(4)已知A是一种金属,82gA(NO3)2中含有6.02×1023个硝酸根离子,则该硝酸盐的摩尔质量为___________ 。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为___________ 。若此时压强为101kPa,则温度___________ 0℃(填“高于”“低于”或“等于”)。
(6)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫25.6%,则混合物中含氧的质量分数为___________ 。
(1)标准状况下11.2LNH3含
(2)等质量的SO2和SO3物质的量之比是
(3)4.8gCH4中所含氢原子数与
(4)已知A是一种金属,82gA(NO3)2中含有6.02×1023个硝酸根离子,则该硝酸盐的摩尔质量为
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为
(6)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫25.6%,则混合物中含氧的质量分数为
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)标准状况下,2.24LCl2的质量为__ g;标准状况下,将aLHCl气体溶于水配成500mL0.4mol•L-1的溶液,则a=__ 。
(2)在无土栽培中,1L营养液的标准配置为5mol/LNH4Cl、1.6mol/LKCl、2.4mol/LK2SO4,若改用KCl、NH4Cl、(NH4)2SO4配制1L营养液,则NH4Cl的物质的量浓度为__ 。
(3)标准状况下,mg气体A和ng气体B具有相等的体积,则同温同压下A、B的密度之比为__ ,同质量的A、B的分子数目之比为__ 。
(4)在标准状况下,由CO和CO2组成的混合气体11.2L,质量为20g,该混合气体中,CO和CO2物质的量之比为___ ,碳与氧两种原子的数目之比为__ 。
(1)标准状况下,2.24LCl2的质量为
(2)在无土栽培中,1L营养液的标准配置为5mol/LNH4Cl、1.6mol/LKCl、2.4mol/LK2SO4,若改用KCl、NH4Cl、(NH4)2SO4配制1L营养液,则NH4Cl的物质的量浓度为
(3)标准状况下,mg气体A和ng气体B具有相等的体积,则同温同压下A、B的密度之比为
(4)在标准状况下,由CO和CO2组成的混合气体11.2L,质量为20g,该混合气体中,CO和CO2物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___ 。
(2)反应前A的物质的量浓度是___ 。
(3)10s末,生成物D的浓度为___ 。
(4)A与B的平衡转化率之比为___ 。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):降低温度___ ;增大A的浓度___ ;恒容下充入氖气___ 。
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。(1)用C表示10s内反应的平均反应速率为
(2)反应前A的物质的量浓度是
(3)10s末,生成物D的浓度为
(4)A与B的平衡转化率之比为
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):降低温度
您最近一年使用:0次
2021-06-30更新
|
554次组卷
|
2卷引用:广西玉林市直六所普通高中2020-2021学年高一下学期期中联合考试化学试题
4 . (1)反应Fe(s)+CO2(g)⇌FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)⇌FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______ (用ΔH1和ΔH2表示),K=_______ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是_______ 反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是_______ (填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
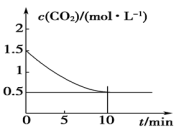
①该条件下反应的平衡常数为___ ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,10分钟达到平衡,则平衡时CO2的浓度为____ mol·L-1,v(CO)为____ 。
②下列措施中能使平衡时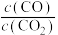 增大的是
增大的是___ (填字母)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为
②下列措施中能使平衡时
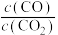 增大的是
增大的是A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
解题方法
5 . CH4—CO2催化重整是减少温室气体排放的重要途径。已知以下的热化学反应方程式:
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+ O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol
写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:___________ 。
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+
 O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:
您最近一年使用:0次
解题方法
6 . 在某体积为2L的密闭容器中充入1.5molNO2和2molCO,在一定条件下发生反应:NO2(g)+CO(g) CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol,求:
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol,求:
(1)此段时间内,用CO2表示的平均反应速率___ 。(列出三段式解答,写出计算过程)
(2)2min时,CO的转化率___ 。
 CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol,求:
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol,求:(1)此段时间内,用CO2表示的平均反应速率
(2)2min时,CO的转化率
您最近一年使用:0次
7 . 已知:
①CH4(g)+ H2O(g)⇌CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=-41.0kJ/mol
③CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) △H3
请回答:
(1)反应①属于___________ (填“放热、吸热”)反应。
(2)反应①消耗8gCH4(g)时,△H=___________ kJ/mol。
(3)反应②生成2mol H2(g)时,△H=___________ kJ/mol。
(4)反应③的△H3=___________ kJ/mol。
①CH4(g)+ H2O(g)⇌CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=-41.0kJ/mol
③CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) △H3
请回答:
(1)反应①属于
(2)反应①消耗8gCH4(g)时,△H=
(3)反应②生成2mol H2(g)时,△H=
(4)反应③的△H3=
您最近一年使用:0次
2021-05-03更新
|
544次组卷
|
5卷引用:广西钦州市第四中学2020-2021学年高二下学期4月月试化学试题
广西钦州市第四中学2020-2021学年高二下学期4月月试化学试题(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省镇原县第二中学2021-2022学年高二上学期期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期10月月考化学试题新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第一次月考化学试题
8 . (1)某温度(t℃)时,水的Kw=1×10-12,则该温度___________ (填“>”“<”或“=”)25℃,其理由是___________ 。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈___________ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=___________ mol·L-1。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________ 移动。
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是___________ (填序号)。
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度___________ pH=10的Ba(OH)2溶液中水的电离程度。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度
您最近一年使用:0次
2021-04-16更新
|
1600次组卷
|
5卷引用:广西贵港市立德高级中学2020-2021学年高二下学期3月月考化学试题
广西贵港市立德高级中学2020-2021学年高二下学期3月月考化学试题(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山东省滨州市沾化区实验高级中学2022-2023学年高二10月月考化学试题
名校
解题方法
9 . 取一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为___________ L (假设气体全部逸出)。将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:___________ (任写一个)。计算反应后所得沉淀的质量为___________ g(保留到0.1g)。
您最近一年使用:0次
名校
10 . 化学科学家采用丙烯歧化法制取乙烯和丁烯的反应原理为2C3H6(g) C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:
(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
①a=_______ ,p初始:p5min=_______ 。
②其他条件不变,若缩小反应器的体积,则C3H6转化率_______ (填“增大”“减小”或“不变”)。
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:
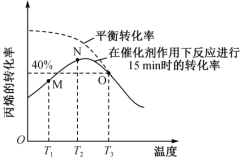
①N点_______ (填“有”或“没有”)达到平衡状态,原因是_______ 。
②M→N过程中C3H6转化率升高的原因是_______ 。
③T3时Kc=_______ ,若其他条件不变,往反应器中再加入2 mol C3H6,反应重新达到平衡时混合体系中乙烯的体积分数为_______ 。
 C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| C2H4的物质的量/mol | 0 | 0.8 | 1.2 | 1.5 | a | 1.5 |
①a=
②其他条件不变,若缩小反应器的体积,则C3H6转化率
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:

①N点
②M→N过程中C3H6转化率升高的原因是
③T3时Kc=
您最近一年使用:0次
2021-03-21更新
|
213次组卷
|
3卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题



