名校
1 . 已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______ 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
您最近一年使用:0次
2 . 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中还原剂是_______ ,氧化产物是 _______ 。
(2)若反应中有0.20mol 电子发生转移,生成氯气的体积为_______ (标准状况),被氧化的HCl的物质的量是_______ 。
(3)用“单线桥”法标出上述反应中电子转移的方向和数目:_____ 。
(1)该反应中还原剂是
(2)若反应中有0.20mol 电子发生转移,生成氯气的体积为
(3)用“单线桥”法标出上述反应中电子转移的方向和数目:
您最近一年使用:0次
3 . 有 和
和 的混合物共
的混合物共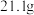 ,将其放入
,将其放入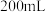 某浓度的盐酸中恰好完全反应。另取等质量该混合物与
某浓度的盐酸中恰好完全反应。另取等质量该混合物与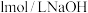 溶液反应,当混合物质量不再减少时,消耗
溶液反应,当混合物质量不再减少时,消耗 溶液
溶液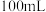 。
。
求:
(1)原混合物中 和
和 的质量各多少克
的质量各多少克_______ ?
(2)盐酸的物质的量浓度为多少_______ ?
 和
和 的混合物共
的混合物共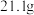 ,将其放入
,将其放入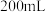 某浓度的盐酸中恰好完全反应。另取等质量该混合物与
某浓度的盐酸中恰好完全反应。另取等质量该混合物与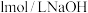 溶液反应,当混合物质量不再减少时,消耗
溶液反应,当混合物质量不再减少时,消耗 溶液
溶液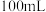 。
。求:
(1)原混合物中
 和
和 的质量各多少克
的质量各多少克(2)盐酸的物质的量浓度为多少
您最近一年使用:0次
4 . NA为阿伏加德罗常数的值,请完成以下有关计算。
(1)0.05 mol的硫酸钠中含有_______ 个氧原子;其所含Na+与_______ g NaCl中所含有的Na+数目相同。
(2)溶质质量分数为98%、密度为1.84 g·cm-3的某浓硫酸,溶质的物质的量浓度为_______ 。
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为_______ 。
(1)0.05 mol的硫酸钠中含有
(2)溶质质量分数为98%、密度为1.84 g·cm-3的某浓硫酸,溶质的物质的量浓度为
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为
您最近一年使用:0次
解题方法
5 . 合成氨工业为人类解决粮食问题做出了巨大贡献。一定温度下,在2L恒容密闭容器中发生反应 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:
求:
(1)0~5min内用NH3表示的平均反应速率为_______ 。
(2)N2的平衡转化率_______ ;初始时与平衡时混合气体压强之比________ (要求写出具体计算过程)。
 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:| t/min | 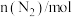 | 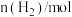 | 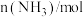 |
| 0 | 1.0 | 1.2 | 0 |
| 5 | 0.9 | 0.9 | x |
| 10 | 0.8 | y | z |
| 15 | w | 0.6 | m |
(1)0~5min内用NH3表示的平均反应速率为
(2)N2的平衡转化率
您最近一年使用:0次
名校
6 . 完成下列填空
(1)已知下列两个热化学方程式: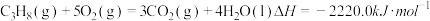 ,
,
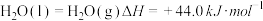 ,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为___________ kJ
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧热的热化学方程式:___________ 。
(3)足量H2在1molO2中完全燃烧生成 液态水,放出571.6kJ的热量,
液态水,放出571.6kJ的热量, 的燃烧热ΔH=
的燃烧热ΔH=___________ 。
(4)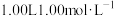 硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出
硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出 的热量,表示其中和热的热化学方程式为
的热量,表示其中和热的热化学方程式为___________ 。
(5)已知: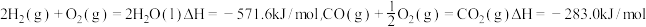 。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为___________ 。
(1)已知下列两个热化学方程式:
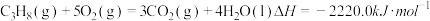 ,
,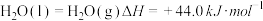 ,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧热的热化学方程式:
(3)足量H2在1molO2中完全燃烧生成
 液态水,放出571.6kJ的热量,
液态水,放出571.6kJ的热量, 的燃烧热ΔH=
的燃烧热ΔH=(4)
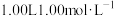 硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出
硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出 的热量,表示其中和热的热化学方程式为
的热量,表示其中和热的热化学方程式为(5)已知:
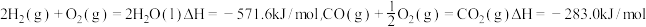 。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
您最近一年使用:0次
2021-12-18更新
|
400次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题
解题方法
7 . 36g H2O气体的物质的量是___________ ,分子个数是___________ ,氢原子的物质的量是___________ 。
您最近一年使用:0次
解题方法
8 . 氮元素的单质及其化合物是化学研究的热点。回答下列问题:
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为_______ 。
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为_______ L(标准状况下)。
(2)一定温度时,在体积为2 L的恒容反应器中发生反应: ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
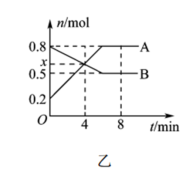
①A为_______ (填化学式)。
②4 min时,v正_______ (填“>”“<”或“=”) v逆。
③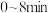 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)=_______ (保留两位有效数字) 。
。
④
_______ ,反应进行4 min时,N2的转化率为_______  。
。
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为
(2)一定温度时,在体积为2 L的恒容反应器中发生反应:
 ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
①A为
②4 min时,v正
③
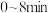 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)= 。
。④

 。
。
您最近一年使用:0次
2021-07-17更新
|
712次组卷
|
4卷引用:安徽省合肥市六校2020-2021学年高一下学期期末联考化学试题
解题方法
9 . 燃烧法是测定有机物分子式的一种重要方法。将0.1mol某烃在氧气中完全燃烧,得到二氧化碳在标准状况下体积为11.2L,生成水为10.8g,求:
(1)该烃的分子式___________ 。
(2)写出可能的结构简式___________ 。
(1)该烃的分子式
(2)写出可能的结构简式
您最近一年使用:0次
2021-07-09更新
|
410次组卷
|
2卷引用:安徽省蚌埠市2020-2021学年高一下学期期末考试化学试题
名校
10 . 一定温度下,在容积为VL的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
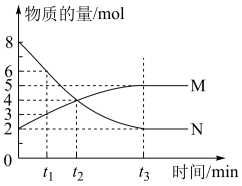
(1)该反应的化学反应方程式是___________ ;
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:___________ ;
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=___________ L;
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是___________ (填序号)
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
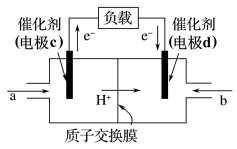
①则电极d是___________  填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为___________ ;
②若线路中转移2mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。

(1)该反应的化学反应方程式是
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
①则电极d是
 填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为②若线路中转移2mol电子,则该燃料电池理论上消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2021-07-09更新
|
840次组卷
|
4卷引用:安徽省安庆市2020-2021学年高一下学期期末考试化学试题



