名校
解题方法
1 . 利用所学化学反应原理知识进行计算:
(1)某温度下,纯水中的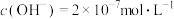 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使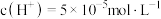 ,则由水电离出的
,则由水电离出的
___________ 。
(2)将99mLpH=2盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
___________ 。
(3)0.2mol/L的 和0.1mol/L NaOH溶液等体积混合后的溶液中:
和0.1mol/L NaOH溶液等体积混合后的溶液中: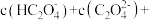
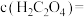
___________ mol/L。
(4)常温下,向100mL0.2mol/L的 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时, ,混合后溶液中
,混合后溶液中
___________ mol/L。
(1)某温度下,纯水中的
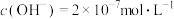 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使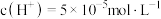 ,则由水电离出的
,则由水电离出的
(2)将99mLpH=2盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的

(3)0.2mol/L的
 和0.1mol/L NaOH溶液等体积混合后的溶液中:
和0.1mol/L NaOH溶液等体积混合后的溶液中: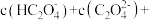
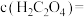
(4)常温下,向100mL0.2mol/L的
 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时, ,混合后溶液中
,混合后溶液中
您最近一年使用:0次
名校
解题方法
2 . 化学计量在生产和科研中应用广泛。回答下列问题:
(1)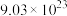 个
个 分子在标准状况下的体积为
分子在标准状况下的体积为___________ ,其质子的物质的量为___________ 。
(2)某气态氧化物的化学式为 ,标准状况下
,标准状况下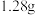 该氧化物的体积为
该氧化物的体积为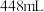 ,则
,则 的摩尔质量为
的摩尔质量为___________ 。
(3)若 g某气体A2,含有的分子数为
g某气体A2,含有的分子数为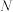 ,
, 气体在标准状况下的体积约为
气体在标准状况下的体积约为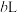 ,则阿伏加德罗常数的数值可表示为
,则阿伏加德罗常数的数值可表示为___________ (用含字母的代数式表示)。
(4)标准状况下将a LX气体(摩尔质量为 )全部溶于0.1 L水(水的密度为
)全部溶于0.1 L水(水的密度为 )中(假设气体与水不反应),所得溶液的密度为
)中(假设气体与水不反应),所得溶液的密度为 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为___________ 。
(5)将 溶液与
溶液与 溶液相混合,则混合溶液中
溶液相混合,则混合溶液中 的物质的量浓度为
的物质的量浓度为___________ (忽略混合前后溶液体积的变化)。
(6)某混合溶液中含有离子: 、
、 、
、 、
、 ,测得
,测得 、
、 和
和 的物质的量浓度依次为:
的物质的量浓度依次为: 、
、 、
、 ,则该混合溶液中
,则该混合溶液中
___________ 。
(1)
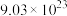 个
个 分子在标准状况下的体积为
分子在标准状况下的体积为(2)某气态氧化物的化学式为
 ,标准状况下
,标准状况下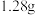 该氧化物的体积为
该氧化物的体积为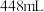 ,则
,则 的摩尔质量为
的摩尔质量为(3)若
 g某气体A2,含有的分子数为
g某气体A2,含有的分子数为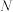 ,
, 气体在标准状况下的体积约为
气体在标准状况下的体积约为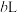 ,则阿伏加德罗常数的数值可表示为
,则阿伏加德罗常数的数值可表示为(4)标准状况下将a LX气体(摩尔质量为
 )全部溶于0.1 L水(水的密度为
)全部溶于0.1 L水(水的密度为 )中(假设气体与水不反应),所得溶液的密度为
)中(假设气体与水不反应),所得溶液的密度为 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为(5)将
 溶液与
溶液与 溶液相混合,则混合溶液中
溶液相混合,则混合溶液中 的物质的量浓度为
的物质的量浓度为(6)某混合溶液中含有离子:
 、
、 、
、 、
、 ,测得
,测得 、
、 和
和 的物质的量浓度依次为:
的物质的量浓度依次为: 、
、 、
、 ,则该混合溶液中
,则该混合溶液中
您最近一年使用:0次
2023-09-21更新
|
234次组卷
|
2卷引用:安徽省合肥六校联考2023-2024学年高三上学期期中联考化学试题
解题方法
3 . 100mL6.0mol•L-1稀硝酸,恰好使铜和氧化铜完全溶解,同时收集到标准状况下NO2.24L。请回答以下问题:
(1)铜和稀硝酸反应的化学方程式_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
(2)原混合物中铜的物质的量为多少_______ ?氧化铜的质量为多少_______ ?(写出计算过程)
(1)铜和稀硝酸反应的化学方程式
(2)原混合物中铜的物质的量为多少
您最近一年使用:0次
名校
解题方法
4 . 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为___________ 。
(2)上述反应中的氧化剂是___________ ,反应产生的气体可用___________ 吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO =2H3AsO4+3S↓+10NO2↑+2H2O。若生成2 mol H3AsO4,则反应中被S元素还原的NO
=2H3AsO4+3S↓+10NO2↑+2H2O。若生成2 mol H3AsO4,则反应中被S元素还原的NO 的物质的量为
的物质的量为___________
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的碳反应所产生的CO2的物质的量___________ (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为
(2)上述反应中的氧化剂是
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO
 =2H3AsO4+3S↓+10NO2↑+2H2O。若生成2 mol H3AsO4,则反应中被S元素还原的NO
=2H3AsO4+3S↓+10NO2↑+2H2O。若生成2 mol H3AsO4,则反应中被S元素还原的NO 的物质的量为
的物质的量为(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的碳反应所产生的CO2的物质的量
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
您最近一年使用:0次
名校
5 . I.如图为10mL一定物质的量浓度的盐酸用一定浓度的NaOH溶液滴定的图示。
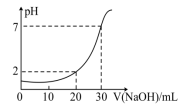
(1)盐酸的浓度为______ 。
(2)NaOH溶液的浓度为______ 。
(3)当滴加NaOH溶液至26mL时,溶液的pH为______ 。
Ⅱ.已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,Ksp[Mg(OH)2]=4.0×10-12,lg5=0.7。请回答下列问题:
(4)25℃时,若向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,混合后溶液中的c(Ag+)为______ mol•L-1,pH为______ 。
(5)25℃时,Mg(OH)2饱和溶液______ (填“能”或“不能”)使石蕊溶液变蓝色。

(1)盐酸的浓度为
(2)NaOH溶液的浓度为
(3)当滴加NaOH溶液至26mL时,溶液的pH为
Ⅱ.已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,Ksp[Mg(OH)2]=4.0×10-12,lg5=0.7。请回答下列问题:
(4)25℃时,若向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,混合后溶液中的c(Ag+)为
(5)25℃时,Mg(OH)2饱和溶液
您最近一年使用:0次
6 . I.回答下列问题:
(1)某有机化合物的蒸汽对氢气的相对密度为30,其分子中含碳40%,含氢6.7%,其余为氧。该有机物的分子式为_____ ;若该物质能与Na2CO3溶液反应放出CO2,则该物质的结构简式为_____ 。
II.某烃M的相对分子质量为84。
(2)烃M的分子式为_____ 。
(3)下列物质与烃M以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____ (填字母序号,下同);若总质量一定,充分燃烧消耗氧气的量不变的是_____ 。
A.C7H8 B.C4H14 C.C7H14 D.C8H8
(4)若烃M为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则烃M的结构简式为_____ 。
(1)某有机化合物的蒸汽对氢气的相对密度为30,其分子中含碳40%,含氢6.7%,其余为氧。该有机物的分子式为
II.某烃M的相对分子质量为84。
(2)烃M的分子式为
(3)下列物质与烃M以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是
A.C7H8 B.C4H14 C.C7H14 D.C8H8
(4)若烃M为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则烃M的结构简式为
您最近一年使用:0次
名校
解题方法
7 . 化学学科中由于物质种类和反应的多样性,通过类别思想和价态规律来分析物质的性质成为重要的学习思路,同时需要将定性和学科知识进行定量的计算。结合所学完成下面问题。
(1)与标准状况下5.6L 所含氧原子数目相同的水的质量是
所含氧原子数目相同的水的质量是_______ 。
(2)12.4g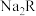 含0.4mol
含0.4mol ,则
,则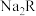 的摩尔质量为
的摩尔质量为_______ 。
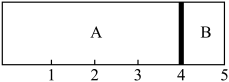
(3)某密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧A中充入1mol ,右侧B中充入CO和
,右侧B中充入CO和 的混合气体共8g时,隔板处于如图位置(左、右两侧温度,相同),右侧B中CO与
的混合气体共8g时,隔板处于如图位置(左、右两侧温度,相同),右侧B中CO与 分子数之比为
分子数之比为_______ 。
(4)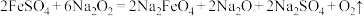 ,每生成8g氧气,反应中转移电子的物质的量为
,每生成8g氧气,反应中转移电子的物质的量为_______ 。
(5)某元素的核素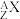 ,1.11g该核素的氯化物
,1.11g该核素的氯化物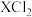 配成的溶液需用20 mL 1
配成的溶液需用20 mL 1  的
的 溶液才能把
溶液才能把 完全沉淀下来,已知此核素中质子数与中子数相等,则:
完全沉淀下来,已知此核素中质子数与中子数相等,则:
①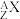 的质量数A是
的质量数A是_______ 。
②37g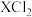 中所含质子数的物质的量为
中所含质子数的物质的量为_______ 。
(6)密闭容器中装有1mol 和0.6mol
和0.6mol  ,充分加热待完全反应后,容器内残留固体的成分为
,充分加热待完全反应后,容器内残留固体的成分为_______ 。
(1)与标准状况下5.6L
 所含氧原子数目相同的水的质量是
所含氧原子数目相同的水的质量是(2)12.4g
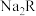 含0.4mol
含0.4mol ,则
,则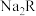 的摩尔质量为
的摩尔质量为(3)某密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧A中充入1mol
 ,右侧B中充入CO和
,右侧B中充入CO和 的混合气体共8g时,隔板处于如图位置(左、右两侧温度,相同),右侧B中CO与
的混合气体共8g时,隔板处于如图位置(左、右两侧温度,相同),右侧B中CO与 分子数之比为
分子数之比为
(4)
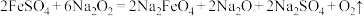 ,每生成8g氧气,反应中转移电子的物质的量为
,每生成8g氧气,反应中转移电子的物质的量为(5)某元素的核素
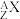 ,1.11g该核素的氯化物
,1.11g该核素的氯化物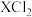 配成的溶液需用20 mL 1
配成的溶液需用20 mL 1  的
的 溶液才能把
溶液才能把 完全沉淀下来,已知此核素中质子数与中子数相等,则:
完全沉淀下来,已知此核素中质子数与中子数相等,则:①
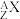 的质量数A是
的质量数A是②37g
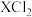 中所含质子数的物质的量为
中所含质子数的物质的量为(6)密闭容器中装有1mol
 和0.6mol
和0.6mol  ,充分加热待完全反应后,容器内残留固体的成分为
,充分加热待完全反应后,容器内残留固体的成分为
您最近一年使用:0次
名校
8 . 在容积为2L的密闭容器中进行反应:A(g)+2B(g)⇌3C(g)+nD(g)。开始时A的物质的量为4mol,B的物质的量为6mol;5min末到达平衡状态,此时测得C的物质的量为3mol,反应前后压强之比为5:6。
(1)5min末A的物质的量浓度为_______ 。
(2)前5min内用B表示的化学反应速率v(B)为_______ 。
(3)化学方程式中n的值为_______ 。
(4)若10min后继续往容器中加入3molA和C,此时V正_______ V逆(填“>”、“<”或“=”),理由是________
(1)5min末A的物质的量浓度为
(2)前5min内用B表示的化学反应速率v(B)为
(3)化学方程式中n的值为
(4)若10min后继续往容器中加入3molA和C,此时V正
您最近一年使用:0次
2022-06-22更新
|
398次组卷
|
2卷引用:安徽省六安市舒城晓天中学2023-2024学年高二上学期期中考试化学试题
名校
9 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:
(1)用 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: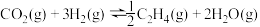 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
_______ (用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的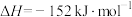 ,则表中的x=
,则表中的x=_______ 。
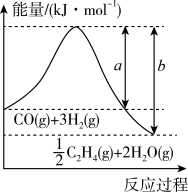
注:乙烯结构如图: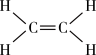
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有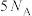 个电子转移时,放出
个电子转移时,放出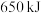 的热量。其燃烧热的热化学方程式为
的热量。其燃烧热的热化学方程式为_______ 。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
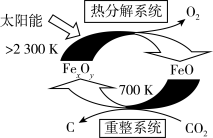
已知“重整系统”发生的反应中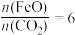 ,则
,则 的化学式为
的化学式为_______ 。“热分解系统”中每分解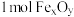 ,转移电子的物质的量为
,转移电子的物质的量为_______ mol。
②工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: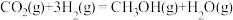
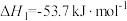 ,
,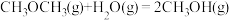
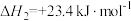 ,则
,则
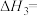
_______  。
。
(1)用
 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: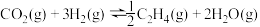 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
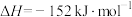 ,则表中的x=
,则表中的x=
| 化学键 |  |  | 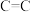 |  |  |
键能/ | 803 | 436 | x | 414 | 464 |
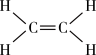
(2)用
 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有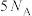 个电子转移时,放出
个电子转移时,放出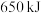 的热量。其燃烧热的热化学方程式为
的热量。其燃烧热的热化学方程式为(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
已知“重整系统”发生的反应中
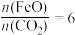 ,则
,则 的化学式为
的化学式为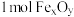 ,转移电子的物质的量为
,转移电子的物质的量为②工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: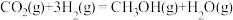
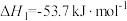 ,
,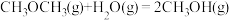
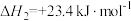 ,则
,则
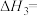
 。
。
您最近一年使用:0次
2022-05-20更新
|
295次组卷
|
2卷引用:安徽省黄山市2023-2024学年屯溪一中高一上学期10月化学月考
名校
10 . 100mL 6.0 mol·L-1稀硝酸,恰好使铜和氧化铜完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:
(1)原混合物中铜的物质的量为___________ mol,氧化铜的物质的量为___________ mol。
(2)假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为___________ mol·L-1。
(3)若要将生成的NO气体完全转化为硝酸,需通氧气___________ (标准状况下)L。
(1)原混合物中铜的物质的量为
(2)假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为
(3)若要将生成的NO气体完全转化为硝酸,需通氧气
您最近一年使用:0次
2022-03-23更新
|
575次组卷
|
2卷引用:安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题



