解题方法
1 . 在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求等因素,以选取最适当的方法。例如,工业上制取NaOH(a)一般不采用Na2O(b)与H2O(c)反应的方法(Na2O作为原料,来源少、成本高),而主要采用电解饱和食盐水的方法,过去也曾采用Na2CO3(d)与Ca(OH)2(e)反应的方法。回答下列问题:
(1)Na与水反应的离子方程式为______ 。
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
①该反应中的还原剂为______ 填化学式,下同),被氧化的物质为______ 。
②用双线桥法表示该反应中电子转移的方向和数目:______ 。
③每生成0.2gH2,同时生成Cl2的质量为______ g。
(3)d和e反应可制得a:将Na2CO3溶液加入澄清石灰水中,发生反应的离子方程式为______ 。
(1)Na与水反应的离子方程式为
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O
 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。①该反应中的还原剂为
②用双线桥法表示该反应中电子转移的方向和数目:
③每生成0.2gH2,同时生成Cl2的质量为
(3)d和e反应可制得a:将Na2CO3溶液加入澄清石灰水中,发生反应的离子方程式为
您最近一年使用:0次
2 . 回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近一年使用:0次
3 . 按要求填空
(1)0.5mol SO2共约含有____ 个原子,它与___ 克SO3所含硫原子数相等。
(2)将质量比为14 :15的N2和NO混合,则N2和NO的物质的量之比为_____ ,混合气体中氮原子和氧原子的个数比为________ 。
(3)同温同压下,质量相同的五种气体:①CO2 ②H2 ③O2 ④CH4 ,所占的体积由大到小的顺序是(填序号)__________ 。
(4)标准状况下,有N2和CO2混合气体质量为18g,体积为11.2L,则此混合气体中N2的物质的量为_____ mol; CO2的质量是____ 克。
(1)0.5mol SO2共约含有
(2)将质量比为14 :15的N2和NO混合,则N2和NO的物质的量之比为
(3)同温同压下,质量相同的五种气体:①CO2 ②H2 ③O2 ④CH4 ,所占的体积由大到小的顺序是(填序号)
(4)标准状况下,有N2和CO2混合气体质量为18g,体积为11.2L,则此混合气体中N2的物质的量为
您最近一年使用:0次
4 . 某纯碱样品中含有少量氯化钠。江津中学化学兴趣小组为测定样品中碳酸钠的质量分数,现称取该样品 ,加入到盛有
,加入到盛有 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为
稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为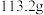 。计算:
。计算:
(1)产生的二氧化碳质量是多少_____ ?
(2)纯碱样品中碳酸钠的质量分数_____ ;(结果精确到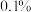 )
)
(3)反应后所得溶液的溶质质量分数_____ 。(结果精确到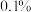 )
)
 ,加入到盛有
,加入到盛有 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为
稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为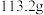 。计算:
。计算:(1)产生的二氧化碳质量是多少
(2)纯碱样品中碳酸钠的质量分数
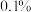 )
)(3)反应后所得溶液的溶质质量分数
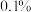 )
)
您最近一年使用:0次
解题方法
5 . 工业上常用电解 溶液制得
溶液制得 ,反应方程式为:
,反应方程式为: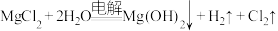 。现将
。现将 溶质质量分数为
溶质质量分数为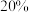 的
的 溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体
溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体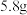 和若干滤液。试计算:
和若干滤液。试计算:
(1) 中
中 和
和 的质量比为
的质量比为________ 。
(2)滤液中 的质量分数(结果精确到
的质量分数(结果精确到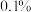 )
)_______ 。
(3)若要将滤液中的 恢复到原来的量分数,并把溶液质量增加到
恢复到原来的量分数,并把溶液质量增加到 。应在滤液中加入一定量水和
。应在滤液中加入一定量水和 固体,计算加入水的体积(水的密度为
固体,计算加入水的体积(水的密度为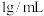 )
)_______ 。
 溶液制得
溶液制得 ,反应方程式为:
,反应方程式为: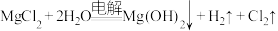 。现将
。现将 溶质质量分数为
溶质质量分数为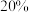 的
的 溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体
溶液通电一段时间后停止通电,将溶液中物质过滤,得到固体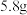 和若干滤液。试计算:
和若干滤液。试计算:(1)
 中
中 和
和 的质量比为
的质量比为(2)滤液中
 的质量分数(结果精确到
的质量分数(结果精确到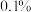 )
)(3)若要将滤液中的
 恢复到原来的量分数,并把溶液质量增加到
恢复到原来的量分数,并把溶液质量增加到 。应在滤液中加入一定量水和
。应在滤液中加入一定量水和 固体,计算加入水的体积(水的密度为
固体,计算加入水的体积(水的密度为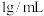 )
)
您最近一年使用:0次
名校
6 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: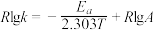 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;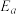 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能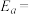
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
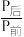 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: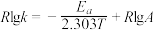 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比;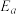 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
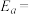

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
470次组卷
|
2卷引用:重庆市西南大学附属中学2022-2023学年高一下学期期末考试化学试题



