1 . (I)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别 胶体和
胶体和 溶液的方法是
溶液的方法是__________ 。
(2)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式__________ ,现象为__________ 。
(3)绿矾( )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
①为防止 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量___________ 。
②甲同学取 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为__________ 。乙同学认为甲同学的实验不够严谨,该组同学在 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是__________ 。
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有 和
和 ,且
,且 。
。
(4)从废液中可回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:___________ (填物质名称)。
②物质X为___________ 。
A. B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。
①对反应后的溶液分析错误的是___________ 。
A.溶液中一定含有
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有 ,则可能有固体析出
,则可能有固体析出
D.溶液若有 剩余,则一定没有固体析出
剩余,则一定没有固体析出
②若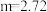 ,则充分反应后得到
,则充分反应后得到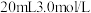 氯化亚铁溶液和
氯化亚铁溶液和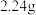 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)鉴别
 胶体和
胶体和 溶液的方法是
溶液的方法是(2)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式(3)绿矾(
 )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。①为防止
 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量②甲同学取
 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有
 和
和 ,且
,且 。
。(4)从废液中可回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案: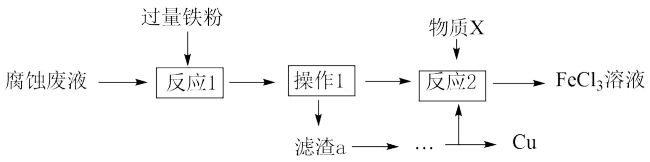
②物质X为
A.
 B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液
 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。①对反应后的溶液分析错误的是
A.溶液中一定含有

B.若有固体剩余,则固体中一定含有铁
C.若溶液中有
 ,则可能有固体析出
,则可能有固体析出D.溶液若有
 剩余,则一定没有固体析出
剩余,则一定没有固体析出②若
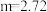 ,则充分反应后得到
,则充分反应后得到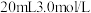 氯化亚铁溶液和
氯化亚铁溶液和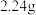 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解题方法
2 . 化学实验是研究化学的重要途径之一。七校某化学兴趣小组在实验室分组进行实验。
I.兴趣小组一:配 溶液,请回答下列问题:
溶液,请回答下列问题:
(1)计算需要 的质量为
的质量为___________ g。
(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有________ 和________ (填名称)。
(3)在此配制过程中,下列情况会使所得溶液的浓度偏高的是___________ (填序号)。
A.转移溶液时未洗涤烧杯和玻璃棒
B.定容时俯视刻度线观察液面
C.容量瓶用蒸馏水洗净后未干燥
D.称量固体时,砝码上沾有杂质
E.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线
Ⅱ.A、B、C、D、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。______________ ;A的水溶液放置一段时间后,溶液的酸性变化为___________ (填“增大”、“减小”或“不变”)。
(5)若A为金属单质,C俗称烧碱。A与 反应的离子方程式为
反应的离子方程式为__________________ 。铝和烧碱溶液反应的化学方程式___________________ 。
(6)若C是磁性氧化物,则A与 反应化学方程式为
反应化学方程式为__________ ;X是稀硫酸则检验D中金属阳离子的试分别是__________ 、__________ 。
(7)除去铁红中氧化铝的离子方程式__________ 。
(8)为了验证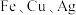 三种金属的活动性顺序,下列选用的药品可行的是
三种金属的活动性顺序,下列选用的药品可行的是__________ (填标号)。
①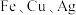 、稀盐酸
、稀盐酸
② 溶液、
溶液、 溶液
溶液
③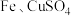 溶液、
溶液、
④ 溶液、
溶液、 溶液、
溶液、
⑤ 溶液、
溶液、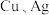
I.兴趣小组一:配
 溶液,请回答下列问题:
溶液,请回答下列问题:(1)计算需要
 的质量为
的质量为(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
(3)在此配制过程中,下列情况会使所得溶液的浓度偏高的是
A.转移溶液时未洗涤烧杯和玻璃棒
B.定容时俯视刻度线观察液面
C.容量瓶用蒸馏水洗净后未干燥
D.称量固体时,砝码上沾有杂质
E.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线
Ⅱ.A、B、C、D、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
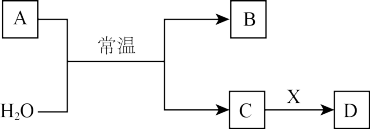
(5)若A为金属单质,C俗称烧碱。A与
 反应的离子方程式为
反应的离子方程式为(6)若C是磁性氧化物,则A与
 反应化学方程式为
反应化学方程式为(7)除去铁红中氧化铝的离子方程式
(8)为了验证
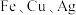 三种金属的活动性顺序,下列选用的药品可行的是
三种金属的活动性顺序,下列选用的药品可行的是①
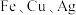 、稀盐酸
、稀盐酸②
 溶液、
溶液、 溶液
溶液③
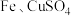 溶液、
溶液、
④
 溶液、
溶液、 溶液、
溶液、
⑤
 溶液、
溶液、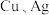
您最近一年使用:0次
解题方法
3 . 微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:

已知: 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸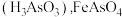 和
和 难溶于水。
难溶于水。
(1)基态 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为______ , 中
中 的化合价为
的化合价为______ 。
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为______ ;增大浸出率可采取的措施是______  写出两条
写出两条 。
。
(3)“除砷”过程中, 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
(4)“除重金属”过程中加入 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时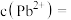
______ 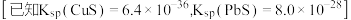 。
。
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式______ 。
(6)流程中可循环利用的物质有 、
、______ 、______  填化学式
填化学式 。
。
 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:
已知:
 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸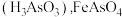 和
和 难溶于水。
难溶于水。(1)基态
 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为 中
中 的化合价为
的化合价为(2)“浸出”过程中
 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为 写出两条
写出两条 。
。(3)“除砷”过程中,
 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)“除重金属”过程中加入
 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时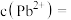
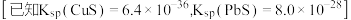 。
。(5)“沉锌”前锌元素以
 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式(6)流程中可循环利用的物质有
 、
、 填化学式
填化学式 。
。
您最近一年使用:0次
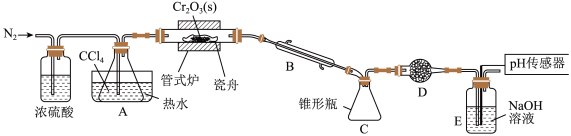
4 . 三氯化铬是有机金属化学中的重要原料,为紫色晶体,熔点为83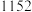 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到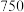 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知: 沸点
沸点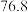 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。
Ⅰ.制备 :
:
(1)仪器 的名称是
的名称是______ 。
(2)装置 、
、 的作用分别是
的作用分别是______ 、______ 。
(3)实验前先通入一段时间 的目的是
的目的是______ 。
(4)制备 的化学方程式为
的化学方程式为______ 。
(5)判断反应结束的依据是______ 。
Ⅱ.测定 纯度:
纯度:
称取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液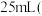 已知
已知 被
被 还原为
还原为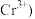 。
。
(6) 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为______ 。
(7)产品中 的纯度为
的纯度为______  杂质不参与反应
杂质不参与反应 。
。
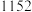 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到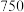 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知:
 沸点
沸点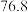 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。Ⅰ.制备
 :
:(1)仪器
 的名称是
的名称是(2)装置
 、
、 的作用分别是
的作用分别是(3)实验前先通入一段时间
 的目的是
的目的是(4)制备
 的化学方程式为
的化学方程式为(5)判断反应结束的依据是
Ⅱ.测定
 纯度:
纯度:称取
 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液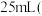 已知
已知 被
被 还原为
还原为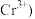 。
。(6)
 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为(7)产品中
 的纯度为
的纯度为 杂质不参与反应
杂质不参与反应 。
。
您最近一年使用:0次
解题方法
5 . 有一瓶澄清的无色溶液,其中可能含有H+、Na+、Mg2+、Ba2+、Fe3+、Cl-、CO 、SO
、SO 。取该溶液进行以下实验:
。取该溶液进行以下实验:
(1)由题干可知溶液中一定不存在_______ (填离子符号,下同);用pH试纸检验,溶液呈强酸性,可以排除_______ 的存在。
(2)取出部分溶液滴加过量的NaOH溶液,只产生白色沉淀,则可证明_______ (填离子符号)的存在,生成白色沉淀的离子方程式为_______ 。
(3)取出部分上述碱性溶液滴加Na2SO4溶液,有白色沉淀生成,证明______ (填离子符号,下同)的存在,同时可排除原溶液中______ 的存在,产生白色沉淀的离子方程式为______ 。
(4)根据上述实验事实可知原溶液中不能确定是否存在的离子有______ ,如果要确定该离子确实存在,可以通过______ 方法。
 、SO
、SO 。取该溶液进行以下实验:
。取该溶液进行以下实验:(1)由题干可知溶液中一定不存在
(2)取出部分溶液滴加过量的NaOH溶液,只产生白色沉淀,则可证明
(3)取出部分上述碱性溶液滴加Na2SO4溶液,有白色沉淀生成,证明
(4)根据上述实验事实可知原溶液中不能确定是否存在的离子有
您最近一年使用:0次
名校
解题方法
6 . 法匹拉韦
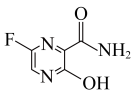
 对新型冠状病毒(2019nCOV)有良好的抑制作用。H是合成法匹拉韦的重要中间体,其合成路线如下:
对新型冠状病毒(2019nCOV)有良好的抑制作用。H是合成法匹拉韦的重要中间体,其合成路线如下:
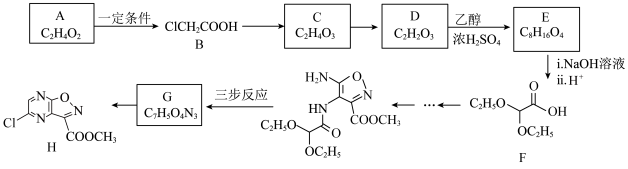
已知:I.R-CHO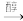

 R-CHO
R-CHO
II.R-NH2+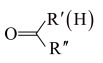

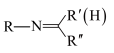 +H2O
+H2O
(2)B的名称为
(3)E的结构简式为
(4)写出D与银氨溶液反应的化学方程式
(5)流程中设置D→E这一步的目的是
(6)有机物X是D的同系物,其相对分子质量比D多14,则X的链状同分异构体中含有酯基或羧基且不含碳碳双键的有
(7)已知G→H为取代反应,合成G分如下图所示三步进行,Z和G互为同分异构体,则Y和G的结构简式分别为

您最近一年使用:0次
2024-03-19更新
|
197次组卷
|
2卷引用:重庆市云阳盘石中学校2023-2024学年高三上学期12月月考化学试题
解题方法
7 . 原理综合题
汽车尾气中含有 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
Ⅰ.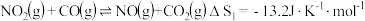
Ⅱ.
Ⅲ.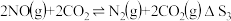
(1)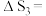
______  忽略
忽略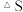 受温度的影响
受温度的影响 。
。
(2)反应Ⅰ的平衡常数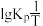 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为______  填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为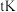 时,
时,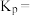
______ ,向恒容密闭容器中加入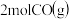 和
和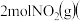 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为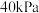 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为______ , 的平衡分压为
的平衡分压为______ 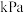 。
。
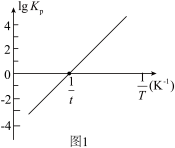
(3)将等物质的量的 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:______ 。
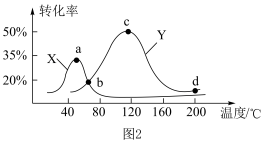
(4)间接电解法可对大气污染物 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
①电极 的电极反应式为
的电极反应式为______ 。
②工作时有 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为______  。
。
汽车尾气中含有
 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:Ⅰ.
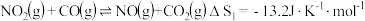
Ⅱ.

Ⅲ.
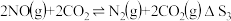
(1)
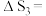
 忽略
忽略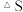 受温度的影响
受温度的影响 。
。(2)反应Ⅰ的平衡常数
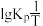 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为 填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为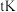 时,
时,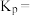
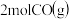 和
和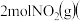 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为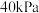 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的平衡分压为
的平衡分压为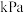 。
。
(3)将等物质的量的
 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因:
(4)间接电解法可对大气污染物
 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。
①电极
 的电极反应式为
的电极反应式为②工作时有
 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
2024-03-19更新
|
35次组卷
|
2卷引用:重庆市云阳盘石中学校2023-2024学年高三上学期12月月考化学试题
8 . 某学习小组在实验室制取 气体的过程中,不慎用到了浓盐酸,导致制得的
气体的过程中,不慎用到了浓盐酸,导致制得的 气体中混有
气体中混有 气体,他们设计了如下除去氯化氢气体并探究
气体,他们设计了如下除去氯化氢气体并探究 与过氧化钠
与过氧化钠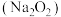 反应的实验,同时还可收集到
反应的实验,同时还可收集到 。已知
。已知 中试剂过量,请回答下列问题:
中试剂过量,请回答下列问题:
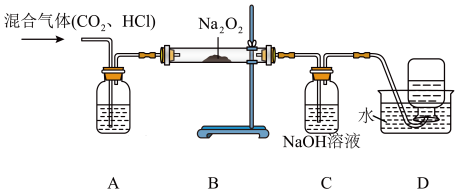
(1)装置A中盛装的试剂为_______ (填化学式);
(2)写出 中
中 与
与 发生反应的化学方程式为
发生反应的化学方程式为_______ ,该反应中,若消耗2个 ,则转移
,则转移_______ 个电子;
(3)装置 的作用是
的作用是_______ ,写出 中发生反应的离子方程式
中发生反应的离子方程式_______ ;
(4)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量反应后 中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含
中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含_______ ,该小组同学继续进行探究。
(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一: ,猜想二:
,猜想二: 和
和 。
。
(5)(实验验证)小组同学取少量溶液 于试管中,向其中加入过量的
于试管中,向其中加入过量的_______ 溶液。
A.氯化钡 B.氢氧化钠 C.氢氧化钡
若产生白色沉淀,过滤,向滤液中滴加几滴酚䣭试液,溶液变红,则证明猜想二成立。根据此猜想,写出产生白色沉淀的离子反应方程式:_______ 。
 气体的过程中,不慎用到了浓盐酸,导致制得的
气体的过程中,不慎用到了浓盐酸,导致制得的 气体中混有
气体中混有 气体,他们设计了如下除去氯化氢气体并探究
气体,他们设计了如下除去氯化氢气体并探究 与过氧化钠
与过氧化钠 反应的实验,同时还可收集到
反应的实验,同时还可收集到 。已知
。已知 中试剂过量,请回答下列问题:
中试剂过量,请回答下列问题:
(1)装置A中盛装的试剂为
(2)写出
 中
中 与
与 发生反应的化学方程式为
发生反应的化学方程式为 ,则转移
,则转移(3)装置
 的作用是
的作用是 中发生反应的离子方程式
中发生反应的离子方程式(4)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量反应后
 中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含
中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一:
 ,猜想二:
,猜想二: 和
和 。
。(5)(实验验证)小组同学取少量溶液
 于试管中,向其中加入过量的
于试管中,向其中加入过量的A.氯化钡 B.氢氧化钠 C.氢氧化钡
若产生白色沉淀,过滤,向滤液中滴加几滴酚䣭试液,溶液变红,则证明猜想二成立。根据此猜想,写出产生白色沉淀的离子反应方程式:
您最近一年使用:0次
9 .  为四种可溶性盐,它们的阳离子分别是
为四种可溶性盐,它们的阳离子分别是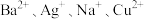 中的一种,阴离子分别是
中的一种,阴离子分别是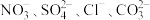 中的一种(离子在物质中不能重复出现)。
中的一种(离子在物质中不能重复出现)。
现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色。
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题:
(1)写出相应物质的化学式:A______ ,B______ ,C______ ,D______ 。
(2)写出盐酸与D反应产生气体的离子方程式:____________ 。
(3)写出C与 溶液反应的离子方程式:
溶液反应的离子方程式:____________ 。
(4)将含相同数目A、B、C的溶液混合后,写出溶液中存在的离子______ ;在此溶液中加入锌粒,写出发生反应的离子方程式____________ 。
 为四种可溶性盐,它们的阳离子分别是
为四种可溶性盐,它们的阳离子分别是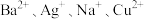 中的一种,阴离子分别是
中的一种,阴离子分别是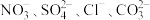 中的一种(离子在物质中不能重复出现)。
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色。
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题:
(1)写出相应物质的化学式:A
(2)写出盐酸与D反应产生气体的离子方程式:
(3)写出C与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)将含相同数目A、B、C的溶液混合后,写出溶液中存在的离子
您最近一年使用:0次
名校
10 . 合成维生素A的中间体I方法如下所示。回答下列问题:
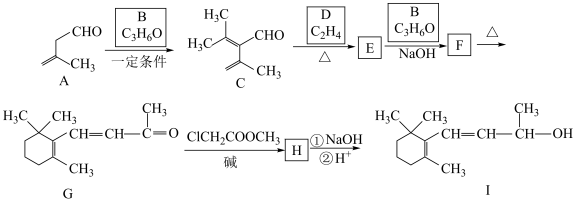
已知:
①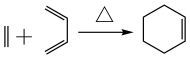
②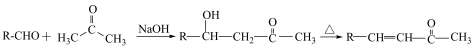
③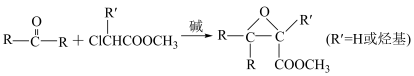
(1)A中含氧官能团的名称___________ 。
(2)B的名称为___________ 。
(3)E的结构简式为___________ ,F→G的反应类型___________ 。
(4)H的结构简式为___________ 。
(5)有机物ClCH2COOCH3与足量NaOH溶液加热时的化学方程式___________ 。
(6)M与C互为同系物,其相对质量比C少28,M的结构有___________ 种(不考虑立体异构,且同一个碳上接两个双键非常不稳定),写出一种不含支链的结构简式___________ 。

已知:
①

②
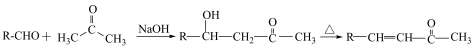
③

(1)A中含氧官能团的名称
(2)B的名称为
(3)E的结构简式为
(4)H的结构简式为
(5)有机物ClCH2COOCH3与足量NaOH溶液加热时的化学方程式
(6)M与C互为同系物,其相对质量比C少28,M的结构有
您最近一年使用:0次



