1 . 醋酸是常见的一元弱酸。请运用化学反应原理回答下列问题:
(1)室温下,pH=2的醋酸中,水电离出的c(H+)=___________ mol·L-1该醋酸和pH=2的盐酸溶液相比,导电性___________ (填“相同”“不同”或“无法判断”)。
(2)pH相同的盐酸和醋酸分别与足量的锌粒反应,生成等量的H2时所需时间较短的是___________ 。
(3)向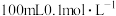 醋酸溶液中滴入
醋酸溶液中滴入 溶液,下列浓度大小顺序不可能出现的是
溶液,下列浓度大小顺序不可能出现的是___________ (填字母)。
a.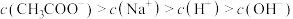
b.
c.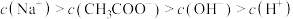
d.
(4)常温下,将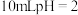 的醋酸溶液稀释至
的醋酸溶液稀释至 ,溶液的
,溶液的
___________ (填“>”“<”或“=”)4;在醋酸稀释过程中下列数值变大的是___________ 。
A. B.
B. C.
C. D.
D.
(5)醋酸中存在平衡: ,下列措施可使醋酸的
,下列措施可使醋酸的 增大,并且电离平衡向右移动的是___________。
增大,并且电离平衡向右移动的是___________。
(1)室温下,pH=2的醋酸中,水电离出的c(H+)=
(2)pH相同的盐酸和醋酸分别与足量的锌粒反应,生成等量的H2时所需时间较短的是
(3)向
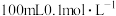 醋酸溶液中滴入
醋酸溶液中滴入 溶液,下列浓度大小顺序不可能出现的是
溶液,下列浓度大小顺序不可能出现的是a.
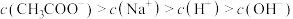
b.

c.
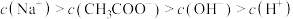
d.

(4)常温下,将
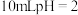 的醋酸溶液稀释至
的醋酸溶液稀释至 ,溶液的
,溶液的
A.
 B.
B. C.
C. D.
D.
(5)醋酸中存在平衡:
 ,下列措施可使醋酸的
,下列措施可使醋酸的 增大,并且电离平衡向右移动的是___________。
增大,并且电离平衡向右移动的是___________。A.加入 溶液 溶液 | B.加入盐酸 | C.加水稀释 | D.对醋酸溶液加热 |
您最近一年使用:0次
解题方法
2 . 有A、B两种常见化合物,其焰色试验均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)。回答下列问题:______ 。
(2)B加热产生D的化学方程式:____________ 。
(3)请用化学方程式表示A在潜水艇中的一种重要用途:____________ 。
(4)A、B在密闭装置中加热,充分反应后,若只得到一种固体化合物E,其化学式为______ 。
(5)写出一种将E转化为B的化学方程式:____________ 。

(2)B加热产生D的化学方程式:
(3)请用化学方程式表示A在潜水艇中的一种重要用途:
(4)A、B在密闭装置中加热,充分反应后,若只得到一种固体化合物E,其化学式为
(5)写出一种将E转化为B的化学方程式:
您最近一年使用:0次
解题方法
3 . Ⅰ.按要求回答下列问题:
(1)某粒子有1个原子核、核中有17个质子、20个中子,核外有18个电子,该粒子的化学符号是___________ 。
(2)写出下列物质的电子式:
NaOH___________ Cl2 ___________ NH4I ___________ 。
(3)用电子式表示下列化合物的形成过程:
Na2S___________ 。
H2O___________ 。
Ⅱ. 如图为元素周期表的一部分,列出了10种元素在元素周期表中的位置,试回答下列问题:___________ 。(填化学式)。
(5)10种元素中,原子半径最小的是___________ (填序号)。
(6)元素⑦的简单氢化物与元素⑧的单质反应的离子方程式为___________ 。
(7)元素②和⑤的最高价氧化物对应水化物相互反应的化学方程式为___________ 。
(8)元素⑩的原子序数为___________ 。
(9)元素⑨的单质易溶于元素⑥与⑧形成的化合物中,所得溶液颜色为___________ 色。
(1)某粒子有1个原子核、核中有17个质子、20个中子,核外有18个电子,该粒子的化学符号是
(2)写出下列物质的电子式:
NaOH
(3)用电子式表示下列化合物的形成过程:
Na2S
H2O
Ⅱ. 如图为元素周期表的一部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
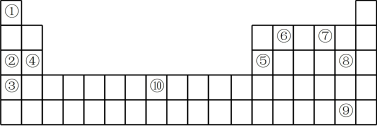
(5)10种元素中,原子半径最小的是
(6)元素⑦的简单氢化物与元素⑧的单质反应的离子方程式为
(7)元素②和⑤的最高价氧化物对应水化物相互反应的化学方程式为
(8)元素⑩的原子序数为
(9)元素⑨的单质易溶于元素⑥与⑧形成的化合物中,所得溶液颜色为
您最近一年使用:0次
解题方法
4 . A、B、C为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。请回答下列问题:___________ 、 X ___________ 。
(2)反应⑥说明D溶液中含有___________ 离子,⑥反应的离子方程式是 ___________ 。
(3)反应⑦的化学方程式是___________ 。
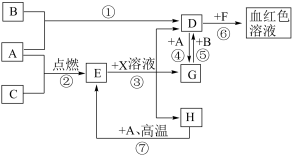
(2)反应⑥说明D溶液中含有
(3)反应⑦的化学方程式是
您最近一年使用:0次
解题方法
5 . Ⅰ、化学实验中,通常需要使用到硫酸
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式___________ 。
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式___________ 。
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=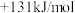
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=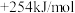
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=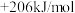
④CH3OH(1)=CO(g)+2H2(g) △H4=
(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式___________ 。反应②需要在___________ (高温、低温)下才能自发进行
(4)几种化学键的键能如下表所示:
根据以上有关反应的△H,计算x=___________ 。
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ: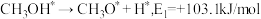
方式Ⅱ:
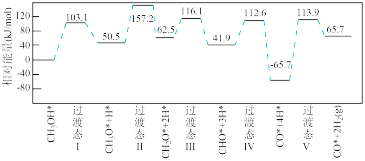
活化能E值推测,甲醇脱氢过程中主要历程的方式为___________ (填"Ⅰ"或"Ⅱ")。计算机模拟的各步反应的能量变化示意图如下。___________ 。
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
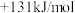
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=
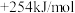
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=
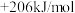
④CH3OH(1)=CO(g)+2H2(g) △H4=

(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式
(4)几种化学键的键能如下表所示:
| 化学键 | C=O | H—H | 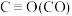 | C—H | O—H |
| 键能/kJ·mol-1 | 803 | 436 | x | 414 | 463 |
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
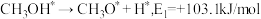
方式Ⅱ:

活化能E值推测,甲醇脱氢过程中主要历程的方式为
您最近一年使用:0次
解题方法
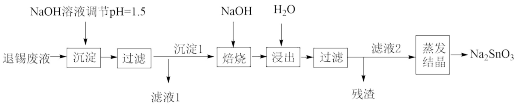
6 . 电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
(1)Na2SnO3的回收
①产品Na2SnO3中Sn的化合价是___________ 。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是___________ ,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为___________ 。
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是___________ 。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于___________ mol•L-1.
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。
终点时的现象为___________ ,产生I2的离子反应方程式为___________ 。
| 化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
| 溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO
 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。终点时的现象为
您最近一年使用:0次
名校
7 . 乙烯是重要的化工原料,有关乙烯的部分转化关系如图:
(1)写出A的结构简式:___________ 。
(2)反应②的反应类型为___________ 。
(3)反应③的化学方程式为___________ 。
(4)乙二醇和乙酸发生酯化反应得到产物 ,为测定B的分子式,取有机物
,为测定B的分子式,取有机物 ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和
,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和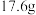 ,写出有机物
,写出有机物 的分子式
的分子式___________ 。
(5)有机物 的同分异构体
的同分异构体 ,
,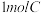 与足量的
与足量的 粉末反应,生成
粉末反应,生成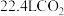 (标准状况),若与足量金属钠反应则生成
(标准状况),若与足量金属钠反应则生成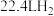 (标准状况),则
(标准状况),则 可能的结构有
可能的结构有___________ 种。

(1)写出A的结构简式:
(2)反应②的反应类型为
(3)反应③的化学方程式为
(4)乙二醇和乙酸发生酯化反应得到产物
 ,为测定B的分子式,取有机物
,为测定B的分子式,取有机物 ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和
,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和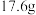 ,写出有机物
,写出有机物 的分子式
的分子式(5)有机物
 的同分异构体
的同分异构体 ,
,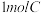 与足量的
与足量的 粉末反应,生成
粉末反应,生成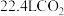 (标准状况),若与足量金属钠反应则生成
(标准状况),若与足量金属钠反应则生成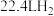 (标准状况),则
(标准状况),则 可能的结构有
可能的结构有
您最近一年使用:0次
名校
解题方法
8 . 汽车尾气中含有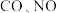 等有害气体。
等有害气体。
(1)汽车尾气中 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图:___________ 。
(2)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 。
。
①该反应的化学方程式为___________ 。
②某温度下,在 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为___________  ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为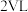 ,则该反应的速率会
,则该反应的速率会___________ (填“增大”“减小”或“不变”)。
③下列可以表明上述可逆反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的气体压强保持不变
b.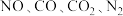 的浓度之比为
的浓度之比为
c. 的浓度不再改变
的浓度不再改变
d.相同时间内,反应消耗 的同时消耗
的同时消耗
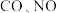 等有害气体。
等有害气体。(1)汽车尾气中
 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图: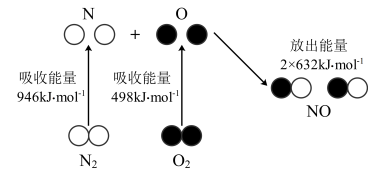
(2)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 。
。①该反应的化学方程式为
②某温度下,在
 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间/ | 0 | 1 | 2 | 3 | … |
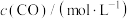 | 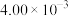 |  |  |  | … |
 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为 ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为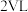 ,则该反应的速率会
,则该反应的速率会③下列可以表明上述可逆反应已达到化学平衡状态的是
a.容器中的气体压强保持不变
b.
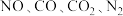 的浓度之比为
的浓度之比为
c.
 的浓度不再改变
的浓度不再改变d.相同时间内,反应消耗
 的同时消耗
的同时消耗
您最近一年使用:0次
名校
解题方法
9 . 某实验小组以BaS溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
可选用试剂:NaCl晶体、BaS溶液、浓 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水
步骤1: 的制备
的制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。 的含量测定
的含量测定
①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100mol/L 溶液;
溶液;
③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量所得白色固体,质量为0.4660g。
回答下列问题:
(1)Ⅰ是制取______ 气体的装置,Ⅱ中b仪器的作用是________ ;Ⅲ中的试剂应选用_______ 。
(2)Ⅱ中发生主要反应的化学方程式为_________ 。
(3)在沉淀过程中,某同学在加入一定量的热 溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是_________ 。
(4)沉淀过程中需加入过量的 溶液,原因是
溶液,原因是_________ 。
(5)在过滤操作中,下列仪器不需要用到的是_______ (填名称)。 的质量分数为
的质量分数为________ (保留三位有效数字)。
 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:可选用试剂:NaCl晶体、BaS溶液、浓
 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水步骤1:
 的制备
的制备按如图所示装置进行实验,得到
 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。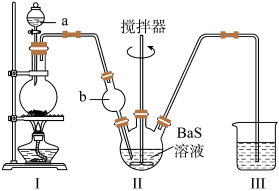
 的含量测定
的含量测定①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100mol/L
 溶液;
溶液;③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量所得白色固体,质量为0.4660g。
回答下列问题:
(1)Ⅰ是制取
(2)Ⅱ中发生主要反应的化学方程式为
(3)在沉淀过程中,某同学在加入一定量的热
 溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已经完全的方法是(4)沉淀过程中需加入过量的
 溶液,原因是
溶液,原因是(5)在过滤操作中,下列仪器不需要用到的是

 的质量分数为
的质量分数为
您最近一年使用:0次
名校
10 . 工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
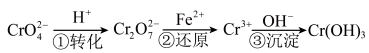
其中第①步存在平衡: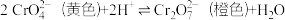
(1)若平衡体系显比较强的酸性,此时溶液显______________ 色。
(2)能说明第①步反应达平衡状态的是______________ 。
a.溶液的pH不变 b. Cr2O 和CrO
和CrO 的浓度相同
的浓度相同
c.2υ(Cr2O )=υ(CrO
)=υ(CrO ) d.溶液的颜色不变
) d.溶液的颜色不变
(3)第②步反应的离子方程式为______________ 。
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡: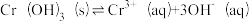 ,常温下,Cr(OH)3的溶度积
,常温下,Cr(OH)3的溶度积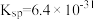 ,要使c(Cr3+)降至10-5mo1·L-1时,溶液的pH应调至
,要使c(Cr3+)降至10-5mo1·L-1时,溶液的pH应调至______________ 。(已知:1g2=0.3)
(5)室温下,初始浓度为1.0mol.L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示:
)随c(H+)的变化如图所示:
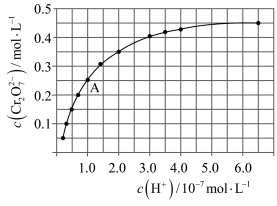
由图可知,溶液酸性增大,CrO 的平衡转化率
的平衡转化率_____________ (填“增大“减小”或“不变”)。根据A点数据,计算出此时CrO 的平衡转化率为
的平衡转化率为______________ 。
(6)有人提出用Fe做电极电解处理含Cr2O 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
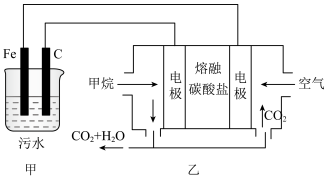
甲中碳电极上发生的反应式为_____________ ,该燃料电池正极的电极反应式为_________ ,燃料电池中若有2.4gCH4参加反应,则甲中碳电极理论上生成的气体在标准状况下体积为__________ 。
 和CrO
和CrO ,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为: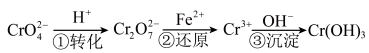
其中第①步存在平衡:
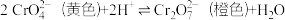
(1)若平衡体系显比较强的酸性,此时溶液显
(2)能说明第①步反应达平衡状态的是
a.溶液的pH不变 b. Cr2O
 和CrO
和CrO 的浓度相同
的浓度相同c.2υ(Cr2O
 )=υ(CrO
)=υ(CrO ) d.溶液的颜色不变
) d.溶液的颜色不变(3)第②步反应的离子方程式为
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:
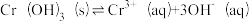 ,常温下,Cr(OH)3的溶度积
,常温下,Cr(OH)3的溶度积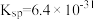 ,要使c(Cr3+)降至10-5mo1·L-1时,溶液的pH应调至
,要使c(Cr3+)降至10-5mo1·L-1时,溶液的pH应调至(5)室温下,初始浓度为1.0mol.L-1的Na2CrO4溶液中c(Cr2O
 )随c(H+)的变化如图所示:
)随c(H+)的变化如图所示:
由图可知,溶液酸性增大,CrO
 的平衡转化率
的平衡转化率 的平衡转化率为
的平衡转化率为(6)有人提出用Fe做电极电解处理含Cr2O
 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
甲中碳电极上发生的反应式为
您最近一年使用:0次



