名校
1 . 回答下列问题。
(1)已知反应 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:
若有 生成,该反应
生成,该反应_______ (填“吸收”或“放出”)_______  能量。
能量。
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:_______ 。
(3)反应从开始至2min,用Z的浓度变化表示的平均反应速率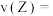
_______ 。
(4)2min后反应达到平衡,容器内混合气体的平均相对分子质量比起始时_______ (填“增大”“减小”或“不变”下同);混合气体的密度_______ 。
(5)将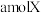 与
与 的混合气体通入
的混合气体通入 的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:
的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足: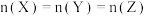 ,则原混合气体中
,则原混合气体中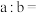
_______ 。
(6)下列措施能加快反应速率的是_______ (填序号,下同)。
A.恒压时充入 B.恒容时充入He
B.恒容时充入He
C.恒容时充入X D.及时分离出
E.升高温度 F.选择高效的催化剂
(7)下列说法正确的是_______ 。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢
(1)已知反应
 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:| 化学键 |  |  | 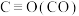 |  |  |
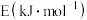 | 436 | 343 | 1076 | 465 | 413 |
 生成,该反应
生成,该反应 能量。
能量。某温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:
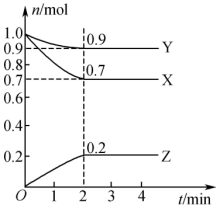
(3)反应从开始至2min,用Z的浓度变化表示的平均反应速率
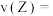
(4)2min后反应达到平衡,容器内混合气体的平均相对分子质量比起始时
(5)将
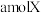 与
与 的混合气体通入
的混合气体通入 的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:
的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足: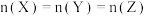 ,则原混合气体中
,则原混合气体中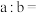
(6)下列措施能加快反应速率的是
A.恒压时充入
 B.恒容时充入He
B.恒容时充入HeC.恒容时充入X D.及时分离出

E.升高温度 F.选择高效的催化剂
(7)下列说法正确的是
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢
您最近一年使用:0次
名校
解题方法
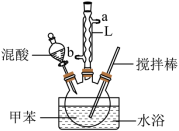
2 . 某同学设计如图所示装置制备一硝基甲苯。
①配制浓硫酸和浓硝酸(按体积比1:3)的混合物(混酸);
②在三颈烧瓶里装15mL甲苯;
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量(淡黄色油状)液体出现;
⑥分离出—硝基甲苯(已知:甲苯的密度为0.866g∙cm-3,沸点为110.6℃;硝基苯的密度为1.20 g∙cm-3,沸点为210.9℃)。
根据上述实验,回答下列问题:
(1)实验方案中缺少一种必要的仪器,它是_______ 。本实验的关键是控制温度在30℃左右,如果温度过高,可能产生的后果是_______ 。
(2)L仪器名称是_______ ,其作用是_______ 。
(3)甲苯与混酸反应生成对硝基甲苯的化学方程式是_______ ,反应类型是_______ 。
(4)分离产品方案如图:_______ ;产品2的核磁共振氢谱中有5个峰,它的名称为_______ 。
①配制浓硫酸和浓硝酸(按体积比1:3)的混合物(混酸);
②在三颈烧瓶里装15mL甲苯;
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量(淡黄色油状)液体出现;
⑥分离出—硝基甲苯(已知:甲苯的密度为0.866g∙cm-3,沸点为110.6℃;硝基苯的密度为1.20 g∙cm-3,沸点为210.9℃)。
根据上述实验,回答下列问题:
(1)实验方案中缺少一种必要的仪器,它是
(2)L仪器名称是
(3)甲苯与混酸反应生成对硝基甲苯的化学方程式是
(4)分离产品方案如图:

您最近一年使用:0次
名校
解题方法
3 . 烃A(结构简式:CH2=CHCH3)是有机化学工业的基本原料,可从石油中获得。烃A可发生如图所示的一系列化学反应。
(1)F的分子式为_______ 。
(2)B的名称是_______ ,可鉴别A、E两种物质的试剂是_______ (填一种)。
(3)C是A通过加聚反应制得的有机高分子材料,其结构简式为_______ 。
(4)G的官能团是_______ (填名称),D与F反应的化学方程式是_______ 。

(1)F的分子式为
(2)B的名称是
(3)C是A通过加聚反应制得的有机高分子材料,其结构简式为
(4)G的官能团是
您最近一年使用:0次
真题
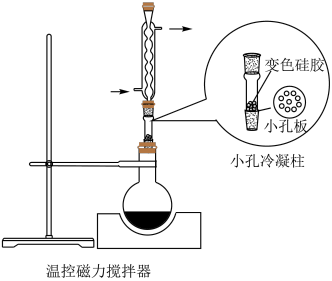
4 . 某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下: 烧瓶中分别加入
烧瓶中分别加入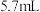 乙酸(
乙酸(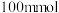 )、
)、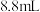 乙醇(
乙醇(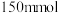 )、
)、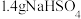 固体及4~6滴
固体及4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
II.加热回流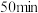 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
III.冷却后,向烧瓶中缓慢加入饱和 溶液至无
溶液至无 逸出,分离出有机相。
逸出,分离出有机相。
IV.洗涤有机相后,加入无水 ,过滤。
,过滤。
V.蒸馏滤液,收集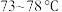 馏分,得无色液体
馏分,得无色液体 ,色谱检测纯度为
,色谱检测纯度为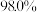 。
。
回答下列问题:
(1) 在反应中起
在反应中起_______ 作用,用其代替浓 的优点是
的优点是_______ (答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可_______ 。
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是_______ (填名称)。_______ (精确至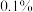 )。
)。
(6)若改用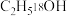 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为_______ (精确至1)。
 烧瓶中分别加入
烧瓶中分别加入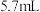 乙酸(
乙酸(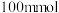 )、
)、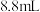 乙醇(
乙醇(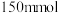 )、
)、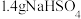 固体及4~6滴
固体及4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。II.加热回流
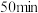 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。III.冷却后,向烧瓶中缓慢加入饱和
 溶液至无
溶液至无 逸出,分离出有机相。
逸出,分离出有机相。IV.洗涤有机相后,加入无水
 ,过滤。
,过滤。V.蒸馏滤液,收集
 馏分,得无色液体
馏分,得无色液体 ,色谱检测纯度为
,色谱检测纯度为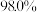 。
。回答下列问题:
(1)
 在反应中起
在反应中起 的优点是
的优点是(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
| A.无需分离 | B.增大该反应平衡常数 |
| C.起到沸石作用,防止暴沸 | D.不影响甲基紫指示反应进程 |
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是
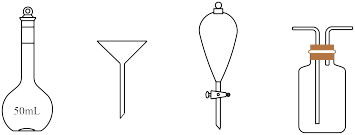
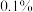 )。
)。(6)若改用
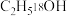 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
您最近一年使用:0次
7日内更新
|
2081次组卷
|
4卷引用:2024年黑龙江省高考化学试卷
名校
解题方法
5 . 铝的化合物在化工、医药、材料等方面应用广泛。回答下列问题:
(1) 分子中心原子的杂化方式为
分子中心原子的杂化方式为_______ ,其空间结构为_______ 。
(2) 属于
属于_______ (填“极性”或“非极性”)分子,其熔点低于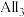 ,原因是
,原因是_______ 。
(3) (共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。
(共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。 晶胞中含有
晶胞中含有_______ 个Al,其配位数为_______ 。
②熔融 晶体,需要破坏的作用力是
晶体,需要破坏的作用力是_______ 。
③若 晶体的密度为
晶体的密度为 ,其晶胞参数为
,其晶胞参数为_______ nm(设 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)
 分子中心原子的杂化方式为
分子中心原子的杂化方式为(2)
 属于
属于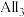 ,原因是
,原因是(3)
 (共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。
(共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。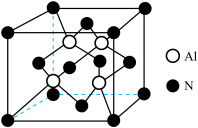
 晶胞中含有
晶胞中含有②熔融
 晶体,需要破坏的作用力是
晶体,需要破坏的作用力是③若
 晶体的密度为
晶体的密度为 ,其晶胞参数为
,其晶胞参数为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
名校
6 . 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。请回答下列问题。
(1)工业合成氨反应: 是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知
是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知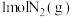 完全反应生成
完全反应生成 可放出
可放出 热量。如果将
热量。如果将 和足量
和足量 混合,使其充分反应,放出的热量
混合,使其充分反应,放出的热量_______ (填“大于”、“小于”或“等于”)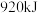 。
。
(2)实验室模拟工业合成氨时,在容积为 的密闭容器内,反应经过
的密闭容器内,反应经过 后,生成
后,生成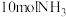 ,用
,用 表示的化学反应速率为
表示的化学反应速率为_______ 。
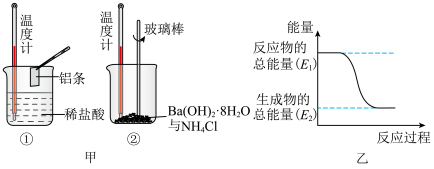
(3)某实验小组同学进行如图甲所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______ (填“升高”或“降低”),反应过程_______ (填“①”或“②”)的能量变化可用图乙表示。_______ (填字母)。
A.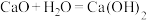
B.
C.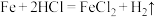
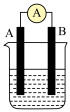
(5)如图为原电池装置示意图。 为
为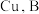 为石墨,电解质为
为石墨,电解质为 溶液,工作时的总反应为
溶液,工作时的总反应为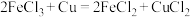 。
。_______ 极(填“正”或“负”)。
②该电池在工作时,溶液中 向
向_______ (填“A”或“B”)移动, 电极的质量将
电极的质量将_______ (填“增加”、“减小”或“不变”)。
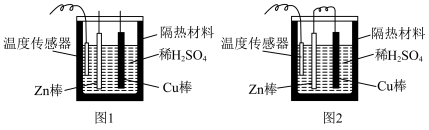
(6)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。_______ 。
②有关反应一段时间后的实验现象,下列说法正确的是_______ (填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(1)工业合成氨反应:
 是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知
是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知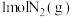 完全反应生成
完全反应生成 可放出
可放出 热量。如果将
热量。如果将 和足量
和足量 混合,使其充分反应,放出的热量
混合,使其充分反应,放出的热量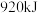 。
。(2)实验室模拟工业合成氨时,在容积为
 的密闭容器内,反应经过
的密闭容器内,反应经过 后,生成
后,生成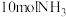 ,用
,用 表示的化学反应速率为
表示的化学反应速率为(3)某实验小组同学进行如图甲所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度
A.
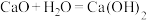
B.

C.
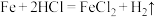
(5)如图为原电池装置示意图。
 为
为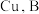 为石墨,电解质为
为石墨,电解质为 溶液,工作时的总反应为
溶液,工作时的总反应为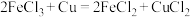 。
。
②该电池在工作时,溶液中
 向
向 电极的质量将
电极的质量将(6)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。
②有关反应一段时间后的实验现象,下列说法正确的是
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
您最近一年使用:0次
名校
解题方法
7 . 有机物K是重要的药物中间体,一种K的合成路线如下:
(1)A→B的反应条件是___________ 。D→E的反应类型为___________ 。
(2)F的结构简式为___________ 。
(3)I的化学名称是___________ 。J中官能团的名称是___________ 。
(4)反应B→C的化学方程式为___________ 。
(5)鉴别D的水溶液与I的水溶液的化学试剂为___________ 。
(6)L是D与乙醇酯化后的产物,同时满足下列条件的L的同分异构体有___________ 种;
①含有苯环;
②能发生水解反应且1molL需要2molNaOH发生反应。
其中,核磁共振氢谱有4组峰,且峰面积比为6:2:1:1的物质的结构简式为___________ (任写一种)。
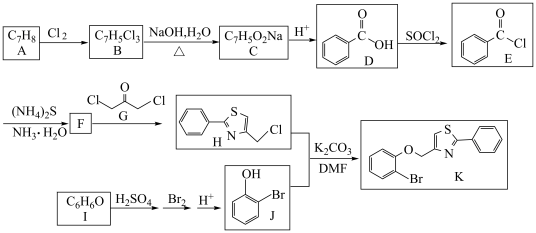
已知:①
②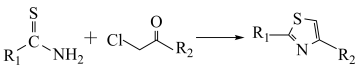
(1)A→B的反应条件是
(2)F的结构简式为
(3)I的化学名称是
(4)反应B→C的化学方程式为
(5)鉴别D的水溶液与I的水溶液的化学试剂为
(6)L是D与乙醇酯化后的产物,同时满足下列条件的L的同分异构体有
①含有苯环;
②能发生水解反应且1molL需要2molNaOH发生反应。
其中,核磁共振氢谱有4组峰,且峰面积比为6:2:1:1的物质的结构简式为
您最近一年使用:0次
8 . 有机物G可用于麦田除草,其合成路线如图所示:
(1)A遇 溶液显紫色,且苯环上的一氯代物有2种,A的名称是
溶液显紫色,且苯环上的一氯代物有2种,A的名称是_______ 。
(2)B的结构简式为_______ ;B→C的反应类型为_______ 。
(3)D中官能团的名称为_______ ,写出D与银氨溶液反应的化学方程式:_______ 。
(4)已知E与F反应除了生成G外,还有小分子 生成,F的结构简式为
生成,F的结构简式为_______ 。
(5)满足下列条件的E的芳香族同分异构体有_______ 种(不含立体异构)。
①苯环上含有两个取代基,其中一个含酯基;
②能与银氨溶液反应;
③与 溶液能发生显色反应。
溶液能发生显色反应。
(6)设计以苯乙烯为原料合成 的合成路线:
的合成路线:_______ (无机试剂任选)。
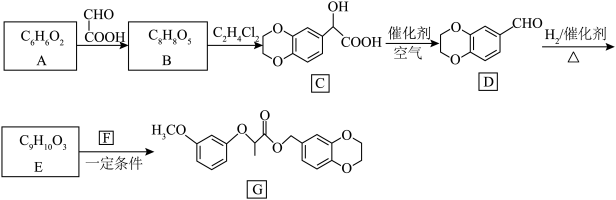
已知:  (R、R′为烃基)
(R、R′为烃基)
(1)A遇
 溶液显紫色,且苯环上的一氯代物有2种,A的名称是
溶液显紫色,且苯环上的一氯代物有2种,A的名称是(2)B的结构简式为
(3)D中官能团的名称为
(4)已知E与F反应除了生成G外,还有小分子
 生成,F的结构简式为
生成,F的结构简式为(5)满足下列条件的E的芳香族同分异构体有
①苯环上含有两个取代基,其中一个含酯基;
②能与银氨溶液反应;
③与
 溶液能发生显色反应。
溶液能发生显色反应。(6)设计以苯乙烯为原料合成
 的合成路线:
的合成路线:
您最近一年使用:0次
名校
解题方法
9 . 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下,它是无色油状液体,密度为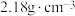 ,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示:
,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示:
(1)向装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入_______ ,烧瓶内发生反应的化学方程式为_______ 。
(2)装置B的作用是_______ ;实验进行时若装置D中长导管发生堵塞,此时装置B中的现象为_______ 。
(3)装置C中盛有10%的 溶液,其作用是
溶液,其作用是_______ 。
(4)开始反应时需向装置D中的烧杯里加入冰水,这是为了_______ ;烧杯中试管内发生反应的化学方程式是_______ 。
(5)进行此实验时,装置D中试管内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为_______ 。
 ,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示:
,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示: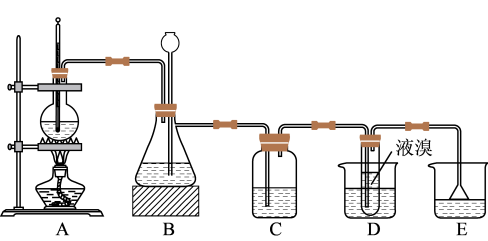
(1)向装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入
(2)装置B的作用是
(3)装置C中盛有10%的
 溶液,其作用是
溶液,其作用是(4)开始反应时需向装置D中的烧杯里加入冰水,这是为了
(5)进行此实验时,装置D中试管内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为
您最近一年使用:0次
10 . 某化学兴趣小组利用铜跟浓硫酸反应,探究 的部分性质。
的部分性质。___________ 。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是___________ (填序号);
①水 ②饱和的 溶液 ③饱和的
溶液 ③饱和的 溶液 ④酸性
溶液 ④酸性 溶液
溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于 与溶液中的
与溶液中的 反应使碱性减弱,而D中则是由于
反应使碱性减弱,而D中则是由于 具有
具有___________ 性。
(4)若实验中用一定质量的铜片和
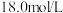 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾___________ mol。
 的部分性质。
的部分性质。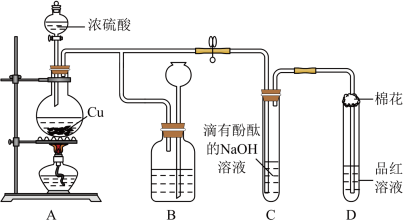
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的
 溶液 ③饱和的
溶液 ③饱和的 溶液 ④酸性
溶液 ④酸性 溶液
溶液(3)装置C和D中产生的现象相同,但原因却不同。C中是由于
 与溶液中的
与溶液中的 反应使碱性减弱,而D中则是由于
反应使碱性减弱,而D中则是由于 具有
具有(4)若实验中用一定质量的铜片和

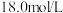 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
您最近一年使用:0次



