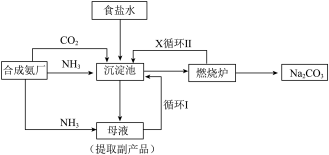
1 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示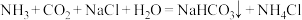 。
。
(1)“侯氏制碱法”誉满全球,其中的“碱”为_______ ,俗称_______ 。
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
(3)燃烧炉中发生反应的化学方程式为_______ 。
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了_______ (填I或Ⅱ)的循环。上述流程中X的分子式_______ 。
(5)该流程提取的副产品为_______ 。
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,_______ ,则证明含有NaCl。
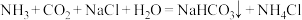 。
。(1)“侯氏制碱法”誉满全球,其中的“碱”为
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
A. | B. | C. | D.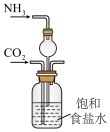 |
(3)燃烧炉中发生反应的化学方程式为
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(5)该流程提取的副产品为
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,
您最近一年使用:0次
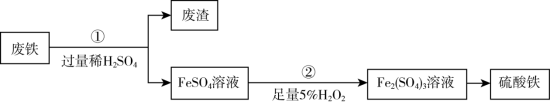
2 . 为充分利用资源,变废为宝,某研究小组采用废铁(主要成分为铁)制备硫酸铁,主要流程如下(部分 条件省略) :
(1)步骤①中主要反应的离子方程式是___________ 。
(2)分离废渣与FeSO4溶液的操作是___________ (选填“过滤”或“蒸发”)。
(3)步骤②中加入H2O2溶液发生的反应类型是___________ (选填“氧化还原反应”或“非氧化还原反应”);产生的现象是___________ 。
(4)检验SO42-的实验操作是___________ 。
(5)废铁中含有少量硫化物,反应产生的副产物与H2S,可用___________ 吸收(填选项代号)。
A.稀硫酸 B.氢氧化钠溶液 C.硫酸钠溶液
(1)步骤①中主要反应的离子方程式是
(2)分离废渣与FeSO4溶液的操作是
(3)步骤②中加入H2O2溶液发生的反应类型是
(4)检验SO42-的实验操作是
(5)废铁中含有少量硫化物,反应产生的副产物与H2S,可用
A.稀硫酸 B.氢氧化钠溶液 C.硫酸钠溶液
您最近一年使用:0次
3 . 现有A、B、C、D、E、F、G、H8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1) 的电子式为
的电子式为________ 。(A、C为字母代号,请将字母代号用元素符号表示,下同)。
(2)B元素基态原子中能量最高的电子所占据的原子轨道呈________ 形。
(3)E元素基态原子的核外价电子轨道表示式为________ ,该元素的 远远大于
远远大于 ,其原因是
,其原因是________ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是________________ 。
(5)G的最高价氧化物对应的水化物与E的氧化物反应的离子方程式________________________ 。
(6)H位于元素周期表中________ 区(按电子排布分区)。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p能级电子数比s能级电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别是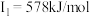 , ,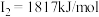 , ,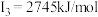 , ,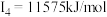 |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第8列 |
 的电子式为
的电子式为(2)B元素基态原子中能量最高的电子所占据的原子轨道呈
(3)E元素基态原子的核外价电子轨道表示式为
 远远大于
远远大于 ,其原因是
,其原因是(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)G的最高价氧化物对应的水化物与E的氧化物反应的离子方程式
(6)H位于元素周期表中
您最近一年使用:0次
4 . 实验室中可用MnO2或KMnO4固体制备氯气,反应的化学方程式如下:
①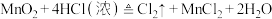
②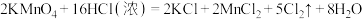
回答下列问题:
(1)对比反应①和②的反应原理,下列作为反应②的发生装置的是_______ (填字母序号)。

(2)反应①和②中,浓盐酸均体现出_______ 性和_______ 性。
(3)用双线桥法,标出下列反应中的电子转移情况_______ 。
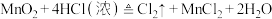
(4)若反应②在水溶液中进行,将反应②改写成离子方程式_______ 。
(5)化学实验中经常提到“酸性高锰酸钾溶液”,这里的“酸性”是因为配制高锰酸钾溶液时加入了_______ (填“硫酸”或“盐酸”)的缘故。
(6)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热到450℃时,用空气中的氧气来氧化氯化氢气体制取氯气的方法——地康法。根据信息,写出该反应的化学方程式_______ 。
①
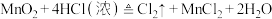
②
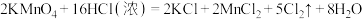
回答下列问题:
(1)对比反应①和②的反应原理,下列作为反应②的发生装置的是

(2)反应①和②中,浓盐酸均体现出
(3)用双线桥法,标出下列反应中的电子转移情况
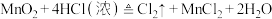
(4)若反应②在水溶液中进行,将反应②改写成离子方程式
(5)化学实验中经常提到“酸性高锰酸钾溶液”,这里的“酸性”是因为配制高锰酸钾溶液时加入了
(6)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热到450℃时,用空气中的氧气来氧化氯化氢气体制取氯气的方法——地康法。根据信息,写出该反应的化学方程式
您最近一年使用:0次
解题方法
5 . 下列实验装置可用于实验室制备少量无水 ,已知
,已知 遇水会强烈反应。
遇水会强烈反应。
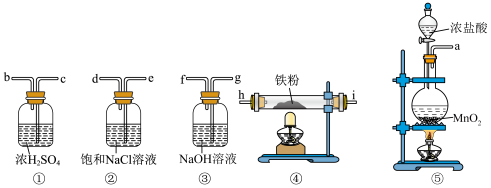
(1)装置⑤装有浓盐酸的仪器名称为_______ ,装有 的仪器名称为
的仪器名称为_______ 。
(2)为达到实验目的,各装置的正确连接顺序是:
__________ 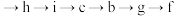 (填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(3)请写出装置⑤中制备氯气的离子方程式_______ 。
(4)装置②的作用_______ 。
(5)请写出④制备 的化学方程式
的化学方程式_______ 。
(6)用离子方程式表示③的作用_______ 。
(7)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃_______ (填装置序号)处酒精灯,后点燃_______ (填装置序号)处酒精灯。
(8)①装置前后两次使用,第1次使用时①装置的作用为_______ ,第2次使用时①装置的作用为_______ 。
 ,已知
,已知 遇水会强烈反应。
遇水会强烈反应。
(1)装置⑤装有浓盐酸的仪器名称为
 的仪器名称为
的仪器名称为(2)为达到实验目的,各装置的正确连接顺序是:

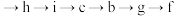 (填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。(3)请写出装置⑤中制备氯气的离子方程式
(4)装置②的作用
(5)请写出④制备
 的化学方程式
的化学方程式(6)用离子方程式表示③的作用
(7)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃
(8)①装置前后两次使用,第1次使用时①装置的作用为
您最近一年使用:0次
6 . 甲醇、乙烯都是重要的有机化工原料,工业上可利用 和
和 在催化剂作用下合成,发生的主要反应有:
在催化剂作用下合成,发生的主要反应有:
ⅰ.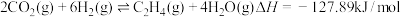
ⅱ.
ⅲ.
(1)上述反应ⅲ中的活化能
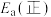
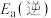 (填“>”或“<”),该反应应选择
(填“>”或“<”),该反应应选择(2)不同压强下
 的平衡转化率与温度的关系如图:
的平衡转化率与温度的关系如图: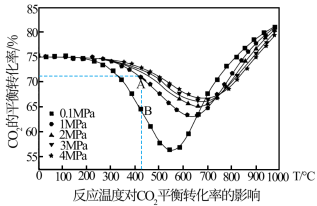
①如图B点
 (填“>”“<”或“=”),在B点给定的温度和压强下,提高
(填“>”“<”或“=”),在B点给定的温度和压强下,提高 平衡转化率的方法有
平衡转化率的方法有
②在恒定压强下,随着温度的升高, 的平衡转化率先降低后升高。表明在较低温度下体系中合成低碳烯烃时
的平衡转化率先降低后升高。表明在较低温度下体系中合成低碳烯烃时
③在较高温度如850℃时, 的平衡转化率随着压强的升高而减小的原因是
的平衡转化率随着压强的升高而减小的原因是
a.温度300~400℃ b.温度900~1000℃ c压强0.1~1.0MPa d.压强2.0~3.0MPa
您最近一年使用:0次
解题方法
7 . 某工业原料主要成分是 、
、 和
和 。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
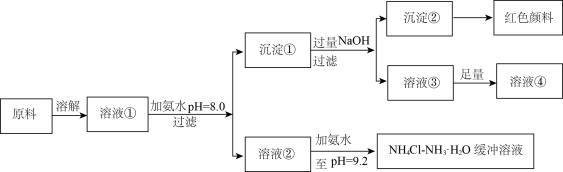
已知: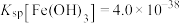
(1)用稀硫酸中和等体积等
 值的氨水和烧碱溶液,前者消耗的酸液体积
值的氨水和烧碱溶液,前者消耗的酸液体积(2)计算溶液②中
 的物质的量浓度为
的物质的量浓度为(3)缓冲溶液中存在的平衡体系有:(Ⅰ)
 ;此时溶液中
;此时溶液中
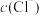 (填>、=、<)。
(填>、=、<)。(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
您最近一年使用:0次
解题方法
8 . “84消毒液”能有效杀灭甲型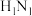 病毒,子涵同学查阅相关资料和消毒液包装发现“威露士”牌“84消毒液”;浓度为
病毒,子涵同学查阅相关资料和消毒液包装发现“威露士”牌“84消毒液”;浓度为 ,质量分数
,质量分数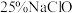 、密度
、密度 。子涵同学想在实验室自己配制
。子涵同学想在实验室自己配制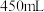 “威露士”牌“84消毒液”。按下列操作步骤填上适当的文字,以使整个操作完整。
“威露士”牌“84消毒液”。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。
完成本实验所必需的仪器有:天平、药匙、烧杯、胶头滴管、_______ 、_______ 以及等质量的两片同种纸片。
(2)计算。配制该溶液需称量 晶体
晶体_______ g。
称量。
(3)接下来溶液配制的基本步骤如下:
将上述实验步骤 到
到 按实验过程先后顺字排列(不重复)
按实验过程先后顺字排列(不重复)_______ 。
(4)下列操作对“84消毒液”溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①摇匀后发现液面低于刻度线再加水_______ ;
②容量瓶中原有少量蒸馏水_______ ;
③定容时俯视观察液面_______ 。
(5)子涵同学取 自制的“84消毒液”稀释至
自制的“84消毒液”稀释至 用于消毒,稀释后的溶液中
用于消毒,稀释后的溶液中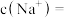
_______ ,稀释后溶液中 物质的量为
物质的量为_______ ,能吸收空气中_______  (标准状况)而变质。(已知:
(标准状况)而变质。(已知: )
)
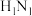 病毒,子涵同学查阅相关资料和消毒液包装发现“威露士”牌“84消毒液”;浓度为
病毒,子涵同学查阅相关资料和消毒液包装发现“威露士”牌“84消毒液”;浓度为 ,质量分数
,质量分数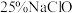 、密度
、密度 。子涵同学想在实验室自己配制
。子涵同学想在实验室自己配制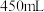 “威露士”牌“84消毒液”。按下列操作步骤填上适当的文字,以使整个操作完整。
“威露士”牌“84消毒液”。按下列操作步骤填上适当的文字,以使整个操作完整。(1)选择仪器。
完成本实验所必需的仪器有:天平、药匙、烧杯、胶头滴管、
(2)计算。配制该溶液需称量
 晶体
晶体称量。
(3)接下来溶液配制的基本步骤如下:
将上述实验步骤
 到
到 按实验过程先后顺字排列(不重复)
按实验过程先后顺字排列(不重复)
(4)下列操作对“84消毒液”溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①摇匀后发现液面低于刻度线再加水
②容量瓶中原有少量蒸馏水
③定容时俯视观察液面
(5)子涵同学取
 自制的“84消毒液”稀释至
自制的“84消毒液”稀释至 用于消毒,稀释后的溶液中
用于消毒,稀释后的溶液中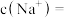
 物质的量为
物质的量为 (标准状况)而变质。(已知:
(标准状况)而变质。(已知: )
)
您最近一年使用:0次
9 . 化学源于生活,她与我们生活息息相关。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
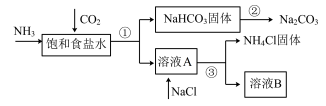
(1)①~③所涉及的操作方法中,包含过滤的是_______ (填序号)。
(2)根据上图,将化学方程式补充完整:
_______ 
_______ 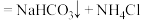
(3)煅烧 固体的化学方程式是
固体的化学方程式是_______ 。
(4)关于上述过程,下列说法中正确的是_______ (填字母)。
a. 不可循环使用
不可循环使用
b.副产物 可用作肥料
可用作肥料
c.反应过程中应先通入极易溶于水的 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体
Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠( )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是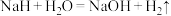 ,该反应中氧化剂是
,该反应中氧化剂是_______ ,还原剂是_______ ;被氧化与被还原元素的物质的量之比为:_______ 。
(6)某离子反应中涉及 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是_______ 。
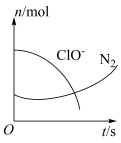
a.该反应的氧化剂是
b.消耗 还原剂,转移
还原剂,转移 电子
电子
c.氧化剂与还原剂的物质的量之比为
d.当生成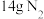 时,消耗的
时,消耗的 为
为
e.氧化性: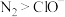
(7)高铁酸钠( ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为_______ ;写出制备高铁酸钠的离子方程式_______ 。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:


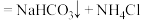
(3)煅烧
 固体的化学方程式是
固体的化学方程式是(4)关于上述过程,下列说法中正确的是
a.
 不可循环使用
不可循环使用b.副产物
 可用作肥料
可用作肥料c.反应过程中应先通入极易溶于水的
 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠(
 )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是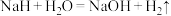 ,该反应中氧化剂是
,该反应中氧化剂是(6)某离子反应中涉及
 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是
a.该反应的氧化剂是

b.消耗
 还原剂,转移
还原剂,转移 电子
电子c.氧化剂与还原剂的物质的量之比为

d.当生成
 时,消耗的
时,消耗的 为
为
e.氧化性:
(7)高铁酸钠(
 ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为
您最近一年使用:0次
10 . 按要求回答下列问题:
(1)下列B原子的电子排布式的状态中,能量最高的是________(用字母表示)。
(2)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛,回答下列问题:
①基态Ge原子的简化的电子排布式为________ ,基态原子核外有________ 种空间运动状态。
②比较下列锗卤化物的熔点和沸点,分析呈现该变化规律的原因是________________________________ 。
③光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子 的空间构型为
的空间构型为________ ,Na在空气中燃烧则发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为________ 光谱(填“发射”或“吸收”)。
(4)元素镍与镍钴合金的晶胞结构分别如图a、b所示:
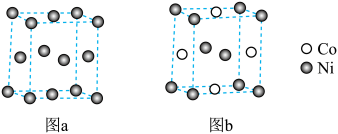
①镍钴合金若写作NixCo1-x,则图b合金中x=________
②已知晶胞(图a)的边长为m pm,设NA为阿伏加德罗常数的值,则镍的密度为________ g/cm3(列出计算式)。
(1)下列B原子的电子排布式的状态中,能量最高的是________(用字母表示)。
A. | B.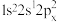 | C. | D.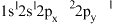 |
(2)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛,回答下列问题:
①基态Ge原子的简化的电子排布式为
②比较下列锗卤化物的熔点和沸点,分析呈现该变化规律的原因是
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子
 的空间构型为
的空间构型为(4)元素镍与镍钴合金的晶胞结构分别如图a、b所示:

①镍钴合金若写作NixCo1-x,则图b合金中x=
②已知晶胞(图a)的边长为m pm,设NA为阿伏加德罗常数的值,则镍的密度为
您最近一年使用:0次



